Dansk Selskab for Anæstesi og Intensiv Medicin
Udvalget for Anæstesi og Perioperativ Medicin
2022
Morten Bundgaard-Nielsen, overlæge, dr.med. Afd. for bedøvelse og operation, CKO, Rigshospitalet.
Jakob Højlund, overlæge, klinisk lektor, Anæstesiologisk afdeling, Hvidovre Hospital (formand)
Lars Knudsen, overlæge, ph.d., Bedøvelse og Operation 1 (Syd), Aarhus Universitetshospital
Liselotte Boldrup Lundbech, overlæge, Bedøvelse og Operation 1 (Syd), Aarhus Universitetshospital
Jens Aage Kølsen Petersen, overlæge, ph.d., klinisk lektor, Bedøvelse og Operation 2 (Nord), Aarhus Universitetshospital
Frank Christian Pott, overlæge, dr.med., klinisk lektor, Anæstesiafdeling Z, Bispebjerg Hospital
Jakob Stensballe, overlæge, ph.d., Afdeling for Bedøvelse, Operation og Opvågning, TraumeCenter og Akutmodtagelse, HOC, Rigshospitalet & Transfusionsmedicinsk Enhed, Blodbanken i Region Hovedstaden
Jannie Bisgaard Stæhr, afdelingslæge, ph.d., Anæstesiafdelingen, Aalborg Universitetshospital; Klinisk lektor, Det sundhedsvidenskabelige fakultet, Klinisk Institut, Aalborg Universitet.
Baggrund
Væsketerapi er en fundamental del af anæstesiologisk praksis og har betydning for patientforløbet(1–4). Anæstesiudvalget under Dansk Selskab for Anæstesi og Intensiv Medicin (DASAIM) fremkom 2014 med den første vejledning i perioperativ væsketerapi. Denne vejledning er en opdatering ud fra nytilkommen evidens, med fokus på øget brugervenlighed.
Vi gennemførte en systematisk litteratursøgning i PubMed og Cochrane-biblioteket samt manuelt i reference-lister fra relevant international og national litteratur og vejledninger, og udvalgte både primær og sekundær litteratur samt systematiske oversigtsartikler. Det har ikke været gruppens intention at tage stilling til evidensstyrken af de enkelte studier. Anbefaling er i visse tilfælde opnået på baggrund af en god praksis anbefaling som følge af manglende evidens.
Vejledningen har som sigte klinisk beslutningsstøtte for perioperativ væskebehandling og bør tilpasses lokale og regionale forhold samt kirurgisk procedure.
Rekommandation
Patientgruppe
Patienter >15 år der får foretaget kirurgiske indgreb, fraset hjertekirurgi.
Baggrund
Korrekt væskebehandling og blodkomponentterapi er afgørende for et optimalt perioperativt forløb. Både hypovolæmi og hypervolæmi bidrager til kardiel, pulmonal og gastrointestinal morbiditet, samt sårkomplikationer. Væskebehandling har som andre behandlinger bivirkninger og bør anvendes på indikation og med klare mål.
Elektive patienter der følger faste-/tørste-reglerne har som udgangspunkt ikke reduceret blodvolumen ved begyndelsen af anæstesien.a
Væskedeficit kan ses hos akutte patienter ved forlænget faste-/tørsteperiode, tab relateret til præoperativ blødning, abnorme gastrointestinale tab, endothel dysfunktion med lækage som ved sepsis med videre.
Som udgangspunkt er de basale tab i forbindelse med anæstesi og kirurgi som følger:
Perspiratio insensibilis (luftveje, hud, operationsfelt): 0,5 – 1 mL/kg/t
Diureser: 0,5 – 1 mL/kg/t
I klinisk praksis anbefales en basal vedligeholdelsesinfusion, inklusive medicin, på 2 mL/kg/t i det perioperative forløb indtil peroralt indtag genoptages. Hertil lægges erstatning af blodtab eller yderligere væske styret af specifikke mål (figur 1 + afsnit 4).
Rekommandation
- Det anbefales at elektive patienter tilbydes klare væsker (vand/kulhydratholdig væske) indtil 2 timer før anæstesi.
- Væskedeficit som følge af forlænget faste-/tørsteperiode erstattes af balanceret krystalloid 2 mL/kg per times tørste over 2 timer.b
- Basale tab erstattes med balanceret krystalloid infusion 2 mL/kg/time.b
- På klinisk mistanke om hypovolæmi (appendiks A 1.) gives bolus krystalloid 3 mL/kgb eller 250-500mL. Ved manglende effekt revurderes indikationen.
- På klinisk mistanke om anæstesi-/kirurgiudløst vasodilation kan vasopressor administreres.
- Målstyret væsketerapi (MVT) anbefales til høj-risiko indgreb/patienter.
- Blodtab erstattes i forhold 1:2 med krystalloid indtil 1,5-2 liters blodtab. På særlig indikation kan vælges 5% human albumin i forholdet 1:1
- Ved stor kirurgi med pågående blødning > 1,5-2 liter, sv.t. > ca. 1/3 af blodvolumen, kan plasma overvejes som volumensubstitution i forholdet 1:1
- Blodkomponentterapi i henhold til Sundhedsstyrelsens vejledning fra 2018 og Dansk Selskab for Klinisk Immunologi (DSKI) fra 2019.(5,6)
- Isoton NaCl anbefales ved neurokritiske tilstande.
- Ved akut kirurgi anbefales individualisering af væsketerapi baseret på den aktuelle patofysiologi.
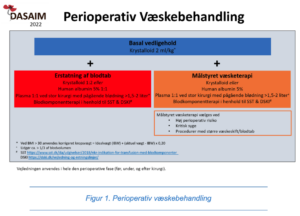
Valg af væske
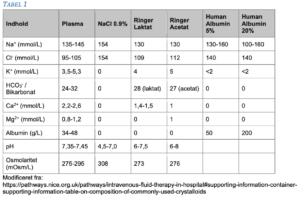
Intravenøse væsker er lægemidler med virkninger og bivirkninger, som er relateret til den specifikke sammensætning samt dosis. Der anvendes krystalloider (Ringer acetat/-laktat, isoton natriumklorid m.fl.), naturligt kolloid (human albumin), og plasma (Tabel 1).
Krystalloider
Opløsningerne indeholder forskellige koncentrationer af salte og bruges på indikation til at erstatte perspiratio, diurese og blodtab. Ved infusion af et krystalloid vil en fraktion passere fra det intravaskulære til det interstitielle rum som et normalt fysiologisk væskeskift. Dette er mest udtalt ved normovolæmi og mindre udtalt ved hypovolæmi hvor retentionen er større.(7) Denne fordeling gør at man ved erstatning af blodtab bør beregne erstatning svarende til 2 mL erstatning per mL blodtab.(8–10) I tilfælde, hvor krystalloider indgives i hyper- eller i velfyldt normovolæm tilstand, leder infusion til udfiltrering til det interstitielle rum og ødemer.(11)
Infusion af større mængder NaCl medfører hyperkloræmisk acidose og elektrolytforstyrrelser.(12) Balancerede krystalloider (Ringer-acetat, Ringer-laktat etc.) har en elektrolyt sammensætning, der minder mere om plasmas og anbefales derfor til de fleste patienter,(13) medmindre patienten har hyponatriæmi, hypokloræmi (f.eks. grundet store ventrikelaspirater), svær hyperkaliæmi eller neurokritiske tilstande (tilstande med hjerneødem f.eks. traumatisk hjerne-/medullær skade, forhøjet intrakranielt tryk, cerebrale blødninger og meningitis). Isoton NaCl er primær væsketype til neurokritiske tilstande hvor der ses øget dødelighed ved anvendelse af Ringer-laktat som primær væske.(6,14)
Laktat metaboliseres primært i leveren og kan specielt ved leversvigt og dårlig leverperfusion interferere med laktatmålinger.(15)
Naturlige kolloider
Human albumin udvindes fra raske bloddonorer og findes i 5 % og 20 % opløsning (50 og 200 g/L).
Human albumin 20 % er hyperosmotisk i forhold til plasma, øger det kolloidosmotiske tryk i blodbanen og mobiliserer dermed den interstitielle og intracellulære væske, resulterende i en øgning af plasmavolumen med ca. 2 gange det infunderede volumen.(7) Human albumin 5 % er isoosmotisk med plasma og øger plasmavolumen med ca. 1 gang det infunderede volumen.(7) Under normale forhold og ved normovolæmi vil 10 % af det tilførte albumin forlade det intravaskulære rum per time og fordeles i interstitielrummet. Ved hypervolæmi, endothelial lækage og inflammation forlader en større del blodbanen. Human albumin betragtes som sikkert til de fleste patienter.(16) Human albumin kan, ligesom krystalloider, inducere fortyndingsudløst koagulopati målt på hæmostaseparametre (TEG-MA, ROTEM-MCF) som kan associeres til blødningsmængden, men synes ikke at øge blødning eller transfusionsbehov.(11,17,18) Human albumin er derfor egnet til erstatning af blødning når den beskrevne volumeneffekt ønskes. Blødning erstattes i forholdet 1:1 med human albumin 5 %.(16)
Ved udbredt endothelskade og kapillærutæthed, som det ses ved stor kirurgi, sepsis, traume m.v. vil der forekomme et patologisk væskeskift væk fra det intravaskulære rum.(19) Human albumins krystalloidbesparende effekt bliver anvendt for at undgå uhensigtsmæssigt stort væskeoverskud, hvilket er relateret til postoperative komplikationer.(17) Trods administration af Human Albumin synes at være sikker, tilsiger den manglende evidens for positive outcomes at det bør bruges restriktivt.
Human albumin synes at øge mortaliteten hos visse typer af traumepatienter, særligt patienter med traumatisk hjerneskade, hvorfor det her må anses for kontraindiceret.(20)
Infusion af større mængder human albumin kan medføre hyperkloræmisk acidose på grund af højt indhold af natrium og klorid (ca. 140 mmol/L). Der er ingen evidens for maksimal dosis, men maksimal dosis på 2 g/kg/døgn – svarende til 40 mL/kg/døgn human albumin 5% – anbefales.(21)
Human Albumin 20% anbefales ikke som standard til volumenterapi af kirurgiske patienter.
Plasma
Donorplasma (frisk frosset plasma, flydende plasma, frysetørret plasma m.v.) indeholder mere end 1000 forskellige proteiner, herunder albumin og koagulationsfaktorer. Behandling med plasma indgår som en del af den balancerede komponentterapi ved kontrollabel og livstruende blødning.
Plasma har generelt først været anbefalet til volumenterapi ved blodtab over et halvt blodvolumen eller efter 4 SAGM på grund af forekomst af bivirkninger og komplikationer som transfusionsrelateret akut lungeskade (TRALI), smitsomme sygdomme overført fra donorer (HIV, hepatitis mv.), transfusionsrelateret immunmodulation (TRIM) og allergiske reaktioner. I dag er disse bivirkninger reduceret pga. bedre kontrol af bloddonorkorpset, screening og behandling af de enkelte plasmaportioner. På den baggrund kan plasma benyttes som en delkomponent af væsketerapien ved stor kirurgi med pågående blødning > 1,5-2 liter, ligesom Human albumin, for at undgå uhensigtsmæssigt stort krystalloidoverskud og for at undgå udvikling af fortyndingsudløst koagulopati og endothelskade som er et særligt problem ved stor kirurgi og større blødning.(22,23) Anvendelse af plasma bør fortages som del af lokal vejledning herunder med anvendelse af hæmostasemonitorering i henhold til vejledning fra DSKI.(6)
Plasma er antikoaguleret med citrat og for at undgå hypocalcæmi bør B-Calcium derfor monitoreres løbende med mål at holde B-Calcium i normalområdet, specielt ved transfusion af større mængder plasma.
Syntetiske kolloider
De syntetiske kolloider er hydroxyethylstivelse (HES), dekstran, samt gelatin. HES og dekstraner er kolloider af polysaccharid typen og deres egenskaber afhænger af molekylvægt, molekylvægtfordeling og forgreningsgrad, samt af koncentrationen af den kolloidosmotiske substans. Syntetiske kolloider, især HES, har tidligere være anvendt meget i både anæstesi og intensiv terapi, men flere undersøgelser har fundet en øget risiko for alvorlige bivirkninger (24) og sikkerhedskomitéen for det europæiske medicin agentur (EMA) har anbefalet, at markedsføringstilladelserne for HES til infusion suspenderes i hele EU.(25)
Rekommendation af væsketype
Balancerede krystalloider anvendes til erstatning af basalt væskebehov.
Krystalloider anvendes til erstatning af blødning i forholdet 2 mL krystalloid per mL blodtab indtil 1,5-2 liters blodtab. På særlig indikation kan vælges 5% human albumin i forholdet 1:1.
Ved stor kirurgi med pågående blødning > 1,5-2 liter, sv.t. > ca. 1/3 af blodvolumen, kan plasma overvejes som volumensubstitution i forholdet 1:1.
Brugen af balancerede krystalloider og human albumin frarådes hos patienter med neurokritiske tilstande, her anbefales isoton NaCl.
Human albumins og/eller plasmas krystalloid-besparende effekt kan anvendes ved stor kirurgi med risiko for betydende endothel dysfunktion for at undgå uhensigtsmæssigt stort væskeoverskud.
Syntetiske kolloider anbefales ikke.
Mængde af væske
Flere studier har undersøgt effekten af forskellige væskevolumina under kirurgiske indgreb, såkaldt liberal versus restriktiv væsketerapi. En entydig fortolkning er desværre ikke mulig pga. heterogeniteten i studierne med forskel i indgreb og definitionen af liberal og restriktiv væskemængde.(26) Studierne har dog bidraget til at klarlægge de skadelige effekter ved at indgive for lidt eller for meget væske (Fig. 2). En individualiseret strategi for den enkelte patient anbefales.

Væske til mindre kirurgi
Ved mindre kirurgiske indgreb, defineret som indgreb af kortere varighed og med mindre kirurgisk stress-respons, er væsketerapi mindre betydende sammenlignet med major kirurgi. Sammenfattende er det fundet at indgift af <1 L forsinker udskrivelse pga. symptomer på dehydratio såsom hovedpine, tørst og kvalme.(29) I overensstemmelse hermed anbefales at undgå væskeunderskud for at reducere PONV.(30)
Målstyret væsketerapi (MVT)
Formål
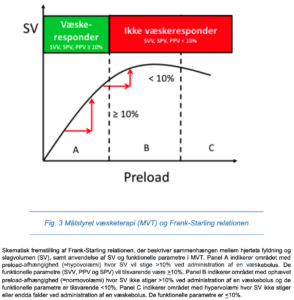
Hovedformålet med hæmodynamisk håndtering af en patient er at sikre normal cellulær metabolisk funktion. Denne funktion afhænger af en velfungerende mikrocirkulation hvor en velfungerende makrocirkulation er grundlaget. Vurdering af mikrocirkulation er vanskelig og teknisk udfordrende og for nuværende ikke mulig i daglig klinisk praksis. Ved konventionel hæmodynamisk håndtering anvendes typisk parametre som blodtryk, hjertefrekvens, centralt venetryk (CVP), diurese og væskebalance til vurdering af kredsløbet. Disse parametre kan dog hverken i sig selv eller kombineret identificere dysfunktion på det cellulære metaboliske niveau. Formålet med målstyret væsketerapi (MVT; internationalt benævnt goal-directed therapy, GDT) er at danne grundlaget for en velfungerende makrocirkulation ved optimering af flowrelaterede parametre. Den grundlæggende idé ved MVT omhandler vurdering af hjertets fyldning. Ved MVT optimeres hjertets slagvolumen ved en øgning af preload således at hjertet opererer nær toppen af Frank/Starling kurven.
Mortalitet
Evidensen for at MVT kan reducere mortalitet er fortsat usikker på baggrund af mange mindre og heterogene studier. Et systematisk review fra 2022 inkluderede 76 studier (9081 patienter) og foretog subgruppeanalyser, sensitivitetsanalyser og metaregressioner.(31) Ingen af de inkluderede studier med >200 patienter fandt en mortalitetsgevinst ved MVT. Flere metaanalyser viser effekt på mortaliteten ved MVT hos højrisikopatienter (forventet mortalitet > 10%(32,33), eller > 20%(34)). Højrisikopatienter udgør en mindre del af den samlede kirurgiske aktivitet, men bidrager med 80% af den globale postoperative mortalitet.(4,35).
Morbiditet
Der er god evidens for at MVT reducerer komplikationsraten sammenlignet med standard terapi hos både høj og lavrisikopatienter.(31) Både når man undersøger det samlede antal såvel som organspecifikke komplikationer, synes der er være en effekt af MVT. Nogle metaanalyser bekræfter dette resultat,(34,36), mens effekten manglende eller var mindre udpræget i andre undersøgelser.(31,37) MVT synes at have effekt på udvikling af postoperativ nyreinsufficiens,(4,38) pulmonale komplikationer (thorakal infektion eller pneumoni, ARDS, lungeødem, lungeemboli),(31,39) infektioner (sårinfektion, pneumoni, urinvejsinfektion),(31,40,41) gastrointestinale komplikationer (både major: anastomoselækage, intraabdominal hæmorhagi, og minor: kvalme, opkastning, paralytisk ileus)(31,42,43) og kardielle komplikationer (især arytmier og lungeødem).(33,44)
Kirurgitype
Abdominalkirurgi er den mest undersøgte gruppe, og anvendelsen af MVT ser ud til at kunne reducere den postoperative morbiditet.(31,45–47) Andre specialers internationale faglige selskaber anbefaler også MVT som en del af Enhanced Recovery After Surgery-tilgangen.(48–51)
Strategi og parametre
Timing
MVT-protokollen bør startes tidligt i den perioperative fase.(52,53) Isoleret postoperativ MVT har i to studier vist en gavnlig effekt på outcome i åben hjertekirurgi(54) og blandet ”high risk surgery”.(55) Kombineret intra- og postoperativ MVT har en teoretisk fordel, idet patienten fortsat er skrøbelig overfor såvel hypo- som hypervolæmi i den tidlige postoperative fase.(56)
Hjertets slagvolumen
Slagvolumen (SV) er den mest repræsentative og dynamiske parameter relateret til flow. Optimering af patientens SV til nær toppen af Frank-Starling-kurven kan foretages løbende under operationen. Målet er således at opnå den optimale fyldning af hjertet ved at optimere preload. Preload øges ved at indgive væskebolus på 200-300 mL eller 3 mL/kg. Et øget preload vil medføre et øget SV, hvis hjertet opererer på det ascenderende ben af kurven (A) indtil et kritisk punkt (B), hvorefter SV ikke længere kan øges, og hjertets kontraktilitet måske endda svækkes (C) (Figur 3). Således vejleder MVT både om, hvornår der skal administreres volumen, og hvornår der skal stoppes. Efter optimering monitoreres SV, og der administreres kun volumen når SV falder >10%.
Funktionelle parametre
Alternativt, eller sideløbende, anvendes funktionelle parametre: stroke volume variation (SVV), systolic pressure variation (SPV) eller pulse pressure variation (PPV), der alle er validerede metoder hos den dybt sederede patient med sinusrytme, under overtryksventilation (TV 8-10 mL/kg), hvorved det kan vurderes om patienten responderer med SV-stigning, hvis volumen administreres.(57,58) Hyppigste anvendte indikation for væskeadministration er en variation >10- 13% .(59) En fordel ved funktionelle parametre er, at unødig væskeadministration, som ikke medfører SV-stigning, kan undgås.
Monitorering af hjertets minutvolumen bør anvendes ved højrisiko-patienter og -procedurer, mens funktionelle parametre er et værdifuldt supplement ved alle patienter med kontinuerlig arteriel blodtryksmonitorering til længere procedurer med større væskeskift.
Central venøs saturation
Central venøs saturation (ScvO2) kan anvendes som støtte til vurdering af patientens minutvolumen. Et enkelt studie har anvendt en individualiseret algoritme med maksimering af ScvO2 og vist reduktion i forekomst af ileus.(60) (appendiks A 2.2.)
Praktisk tilgang
Det anbefales at have en procedurespecifik tilgang til anvendelse af målstyret væsketerapi inkluderende akutte/elektive procedurer og højrisiko procedurer og -patienter. Dette omhandler valg af parametre (SV, SvO2, ekkokardiografi eller andet), mængde af basalvæske, type af væske anvendt og erstatning af blødning.
Under anæstesi gives ofte vasopressor (typisk noradrenalin) for at imødegå anæstesi- og kirurgiinduceret vasodilatation og opnå en total perifer modstand der sikrer et MAP>60-65 mmHg. Man bør holde sig for øje at al vasopressor terapi medfører øgning af preload, såvel som afterload. Til at dække basale behov anbefales det at anvende et balanceret krystalloid i mængden 2 mL/kg/t. Dette inkluderer yderligere væsker såsom medicin (fx anæstetika og antibiotika).
Krystalloid eller kolloid kan anvendes som bolus. I litteraturen er HES 130/0,6 (Voluven) ofte anvendt som bolus, men efter iagttagelse af skadelige effekter (nyresvigt og død), når administreret uden monitorering af preload på septisk shockerede patienter(61) er anvendelse af denne væske stort set ophørt. Flere randomiserede studier har undersøgt effekten af kolloid vs. krystalloid ved målstyret væsketerapi. Samlet set findes ingen forskel i outcomes, men en mindre volumenbesparende effekt ved anvendelse af kolloid som bolus (500-1000 mL).(62–64) Ved procedurer hvor selv et mindre væskeoverskud findes potentielt skadeligt (fx procedurer med sårbare anastomoser, stort inflammatorisk respons eller kardiel/pulmonal morbiditet) kan human albumin/plasma således vælges. Der synes dog ikke at være forskel på systemisk eller regional iltleverance ved bolus human albumin 5% fremfor Ringers acetat.(65)
Når man ønsker at vurdere effekten af en væskebolus er det vigtigt at dette ikke sker i umiddelbar relation til bolusindgift af vasopressor eller ændring af infusionshastighed af vasopressor / inotropi; dette vil umuliggøre vurdering af den isolerede effekt af væskebolus på preload. Såfremt kriterierne for at anvende SVV er opfyldt, vil denne parameter dog kunne anvendes også under disse forhold.
Ved monitorering af SV kan man komme i en situation hvor SV falder >10% fra etableret højeste SV og en væskebolus derfor administreres. Ved manglende opretning af SV skal følgende overvejes:
1) Er der et pågående blodtab så nettoindgiften er mindre end ventet og yderligere væske skal administreres. I dette tilfælde vil slagvolumenvariationen (SVV) være steget og ikke falde til tidligere niveau efter væskeindgift.
2) Skyldes faldet i preload excessiv vasodilatation eller lejringsændringer (anti-Trendelenburg) vil SV falde og SVV stige, dette skyldes ikke nedsat cirkulerende volumen, men venøs pooling, og dermed nedsat central blodvolumen (=preload). I begge tilfælde er vasopressor hensigtsmæssig.
3) Er der andre faktorer (f.eks. temperatur, pH, kardielt svigt) der kan påvirke kontraktiliteten således at det ikke er preload der begrænser SV? I dette tilfælde vil SVV ikke stige da det faldende SV ikke skyldes preload-afhængighed. Yderligere væskebolus undgås og et nyt mål for SV skal fastsættes og/eller inotropi overvejes.
MVT til den akutte kirurgiske patient
Der foreligger aktuelt kun en enkelt randomiseret kontrolleret undersøgelse vedrørende væskebehandling til den akutte kirurgiske patient. 312 patienter inkluderedes over 3 år på 5 centre med randomisering til en af to typer af mål-styrede algoritmer, en blodtryksstyret væske- ”liberal” versus en SV-styret væske-restriktiv behandlingsarm.(66) Man opnåede et mindre intraoperativt administreret volumen, primært drevet af brug af human albumin 5% i den SVstyrede gruppe, men der fandtes ingen forskelle på død eller komplikationsrate mellem grupperne.
I England er en stor randomiseret kontrolleret undersøgelse med protokolleret CO-styret terapi versus standard behandling/monitorering undervejs (FLO-ELA). Der skal inkluderes mere end 7.500 akutte abdominal-kirurgiske patienter.(67)
Opgørelser af akutte kirurgiske patienter har fundet association mellem større væskevolumina og komplikationer og død, (68–71) om end signalet ikke er entydigt.(72) En nylig dansk opgørelse af akutte højrisiko abdominalkirurgiske patienter har vist en betydelig frekvens af elektrolyt forstyrrelser, hvor hypokloræmi var associeret til øget mortalitet.(73)
En tværfaglig multimodal intervention inkluderende protokolleret MVT førte hos akutte højrisiko abdominal-kirurgiske patienter til en relativ risikoreduktion for død efter 30 døgn på 29% i forhold til en historisk kontrol (fra 21,8% til 15,5%).(74) En tilsvarende model gøres nu landsdækkende i regi af Danske Regioners lærings- og kvalitetsteams (LKT).
Rekommendation
Det anbefales, at MVT og udvidet hæmodynamisk monitorering bruges ved patienter med høj forventet perioperativ mortalitet, kritisk syge samt procedurer med større væskeskifte/blodtab, særlig følsomhed for hypoperfusion og/eller interstitielt ødem.
Det anbefales at tage udgangspunkt i den enkelte patients patofysiologi vurderet ved MVT og udvidet hæmodynamisk monitorering, herunder vælge væsketype for at forebygge eller korrigere elektrolyt forstyrrelser.(75)
Store væskevolumina bør undgås. Volumen overload kan mindskes ved systematisk monitorering af preload (MVT), tidlig intervention med vasopressor (til øgning af preload og/eller MAP), samt brug af human albumin i stedet for krystalloid.(76,77)
Referencer
1. Chappell D, Jacob M, Hofmann-Kiefer K, Conzen P, Rehm M. A rational approach to perioperative fluid management. Bd. 109, Anesthesiology. 2008. s. 723–40.
2. Strunden MS, Heckel K, Goetz AE, Reuter DA. Perioperative fluid and volume management: physiological basis, tools and strategies. 20110321. udg. Bd. 1, Ann Intensive Care. 2011. s. 2.
3. Holte K. Pathophysiology and clinical implications of peroperative fluid management in elective surgery. Dan Med Bull. juli 2010;57(7):B4156.
4. Chong MA, Wang Y, Berbenetz NM, McConachie I. Does goal-directed haemodynamic and fluid therapy improve peri-operative outcomes?: A systematic review and meta-analysis. Bd. 35, Eur J Anaesthesiol. 2018. s. 469–83.
5. NKR: Indikation for transfusion med blodkomponenter [Internet]. [henvist 3. marts 2022]. Tilgængelig hos: https://www.sst.dk/da/udgivelser/2018/nkr-indikation-for-transfusion-medblodkomponenter
6. DSKI – Dansk Selskab for Klinisk Immunologi. VEJLEDNING OG RETNINGSLINJER [Internet]. [henvist 3. marts 2022]. Tilgængelig hos: https://dski.dk/vejledning-og-retningslinjer/
7. Rehm M, Hulde N, Kammerer T, Meidert AS, Hofmann-Kiefer K. State of the art in fluid and volume therapy : A user-friendly staged concept. English version. Bd. 68, Anaesthesist. 2019. s. 1–14.
8. Wuethrich PY, Burkhard FC, Thalmann GN, Stueber F, Studer UE. Restrictive deferred hydration combined with preemptive norepinephrine infusion during radical cystectomy reduces postoperative complications and hospitalization time: a randomized clinical trial. Bd. 120, Anesthesiology. 2014. s. 365–77.
9. Wuethrich PY, Studer UE, Thalmann GN, Burkhard FC. Intraoperative continuous norepinephrine infusion combined with restrictive deferred hydration significantly reduces the need for blood transfusion in patients undergoing open radical cystectomy: results of a prospective randomised trial. 20130828. udg. Bd. 66, Eur Urol. 2014. s. 352–60.
10. Finfer S, Myburgh J, Bellomo R. Intravenous fluid therapy in critically ill adults. Bd. 14, Nat Rev Nephrol. 2018. s. 541–57.
11. Rasmussen KC, Hojskov M, Johansson PI, Kridina I, Kistorp T, Salling L, m.fl. Impact of Albumin on Coagulation Competence and Hemorrhage During Major Surgery: A Randomized Controlled Trial. Bd. 95, Medicine (Baltimore). 2016. s. e2720.
12. Orbegozo Cortés D, Rayo Bonor A, Vincent JL. Isotonic crystalloid solutions: a structured review of the literature. Br J Anaesth. juni 2014;112(6):968–81.
13. Semler MW, Kellum JA. Balanced Crystalloid Solutions. Bd. 199, Am J Respir Crit Care Med. 2019. s. 952–60.
14. Overgaard-Steensen C, et. al. Neuroprotektionsvejledning [Internet]. DASAIM og DSIT; 2021. Tilgængelig hos: http://www.dasaim.dk/wpcontent/uploads/2021/03/Neuroprotektionsvejledning-DASAIM-2021.pdf
15. Shin W-J, Kim Y-K, Bang J-Y, Cho S-K, Han S-M, Hwang G-S. Lactate and liver function tests after living donor right hepatectomy: a comparison of solutions with and without lactate. Acta Anaesthesiol Scand. 2011;55(5):558–64.
16. Patel A, Laffan MA, Waheed U, Brett SJ. Randomised trials of human albumin for adults with sepsis: systematic review and meta-analysis with trial sequential analysis of all-cause mortality. 20140722. udg. Bd. 349, Bmj. 2014. s. g4561.
17. Rasmussen KC. Effect of perioperative colloid and crystalloid fluid therapy on coagulation competence, haemorrhage and outcome. Dan Med J. september 2016;63(9).
18. Niemi TT, Suojaranta-Ylinen RT, Kukkonen SI, Kuitunen AH. Gelatin and hydroxyethyl starch, but not albumin, impair hemostasis after cardiac surgery. Bd. 102, Anesth Analg. 2006. s. 998–1006.
19. Lindroos AC, Niiya T, Silvasti-Lundell M, Randell T, Hernesniemi J, Niemi TT. Stroke volume-directed administration of hydroxyethyl starch or Ringer’s acetate in sitting position during craniotomy. 20130403. udg. Bd. 57, Acta Anaesthesiol Scand. 2013. s. 729–36.
20. Myburgh J, Cooper DJ, Finfer S, Bellomo R, Norton R, Bishop N, m.fl. Saline or albumin for fluid resuscitation in patients with traumatic brain injury. Bd. 357, N Engl J Med. 2007. s. 874–84.
21. Albumin (Human) 20% – FDA prescribing information, side effects and uses [Internet]. Drugs.com. [henvist 21. februar 2022]. Tilgængelig hos: https://www.drugs.com/pro/albuminhuman-20.html
22. van den Brink DP, Kleinveld DJB, Sloos PH, Thomas KA, Stensballe J, Johansson PI, m.fl. Plasma as a resuscitation fluid for volume‐depleted shock: Potential benefits and risks. Transfusion (Paris). juli 2021;61(Suppl 1):S301–12.
23. Stensballe J, Ulrich AG, Nilsson JC, Henriksen HH, Olsen PS, Ostrowski SR, m.fl. Resuscitation of Endotheliopathy and Bleeding in Thoracic Aortic Dissections: The VIPER-OCTA Randomized Clinical Pilot Trial. Anesth Analg. oktober 2018;127(4):920–7.
24. Reinhart K, Perner A, Sprung CL, Jaeschke R, Schortgen F, Groeneveld AB, m.fl. Unless high-quality clinical data show they are safe, synthetic colloids should not be used in patients with head injury. 20120720. udg. Bd. 38, Intensive Care Med. 2012. s. 1563–4.
25. EMA. PRAC recommends suspending hydroxyethyl-starch solutions for infusion from the market [Internet]. European Medicines Agency. 2022 [henvist 21. februar 2022]. Tilgængelig hos: https://www.ema.europa.eu/en/news/prac-recommends-suspending-hydroxyethyl-starchsolutions-infusion-market-0
26. Bundgaard-Nielsen M, Holte K, Secher NH, Kehlet H. Monitoring of peri-operative fluid administration by individualized goal- directed therapy. Acta Anaesthesiol Scand. marts 2007;51(3):331–40.
27. Bellamy MC. Wet, dry or something else? Br J Anaesth. december 2006;97(6):755–7.
28. Bundgaard-Nielsen M, Secher NH, Kehlet H. “Liberal” vs. “restrictive” perioperative fluid therapy–a critical assessment of the evidence. Acta Anaesthesiol Scand. august 2009;53(7):843– 51.
29. Holte K, Kehlet H. Fluid therapy and surgical outcomes in elective surgery: a need for reassessment in fast-track surgery. J Am Coll Surg. juni 2006;202(6):971–89.
30. Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, m.fl. Fourth Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg. august 2020;131(2):411–48.
31. Jessen MK, Vallentin MF, Holmberg MJ, Bolther M, Hansen FB, Holst JM, m.fl. Goaldirected haemodynamic therapy during general anaesthesia for noncardiac surgery: a systematic review and meta-analysis. 20211213. udg. Br J Anaesth. 2021.
32. Brienza N, Biancofiore G, Cavaliere F, Corcione A, De Gasperi A, De Rosa RC, m.fl. Clinical guidelines for perioperative hemodynamic management of non cardiac surgical adult patients. 20190617. udg. Bd. 85, Minerva Anestesiol. 2019. s. 1315–33.
33. Giglio M, Manca F, Dalfino L, Brienza N. Perioperative hemodynamic goal-directed therapy and mortality: a systematic review and meta-analysis with meta-regression. Minerva Anestesiol. 20160413. udg. november 2016;82(11):1199–213.
34. Cecconi M, Corredor C, Arulkumaran N, Abuella G, Ball J, Grounds RM, m.fl. Clinical review: Goal-directed therapy-what is the evidence in surgical patients? The effect on different risk groups. 20130305. udg. Bd. 17, Crit Care. 2013. s. 209.
35. Jhanji S, Thomas B, Ely A, Watson D, Hinds CJ, Pearse RM. Mortality and utilisation of critical care resources amongst high-risk surgical patients in a large NHS trust. 20080516. udg. Bd. 63, Anaesthesia. 2008. s. 695–700.
36. Feldheiser A, Aziz O, Baldini G, Cox BP, Fearon KC, Feldman LS, m.fl. Enhanced Recovery After Surgery (ERAS) for gastrointestinal surgery, part 2: consensus statement for anaesthesia practice. 20151030. udg. Bd. 60, Acta Anaesthesiol Scand. 2016. s. 289–334.
37. de Waal EEC, Frank M, Scheeren TWL, Kaufmann T, de Korte-de Boer D, Cox B, m.fl. Perioperative goal-directed therapy in high-risk abdominal surgery. A multicenter randomized controlled superiority trial. 20210915. udg. Bd. 75, J Clin Anesth. 2021. s. 110506.
38. Brienza N, Giglio MT, Marucci M, Fiore T. Does perioperative hemodynamic optimization protect renal function in surgical patients? A meta-analytic study. Bd. 37, Crit Care Med. 2009. s. 2079–90.
39. Dushianthan A, Knight M, Russell P, Grocott MP. Goal-directed haemodynamic therapy (GDHT) in surgical patients: systematic review and meta-analysis of the impact of GDHT on postoperative pulmonary complications. Perioper Med Lond. 20201015. udg. 2020;9:30.
40. Dalfino L, Giglio MT, Puntillo F, Marucci M, Brienza N. Haemodynamic goal-directed therapy and postoperative infections: earlier is better. A systematic review and meta-analysis. 20110624. udg. Bd. 15, Crit Care. 2011. s. R154.
41. Yuan J, Sun Y, Pan C, Li T. Goal-directed fluid therapy for reducing risk of surgical site infections following abdominal surgery – A systematic review and meta-analysis of randomized controlled trials. 20170123. udg. Bd. 39, Int J Surg. 2017. s. 74–87.
42. Giglio MT, Marucci M, Testini M, Brienza N. Goal-directed haemodynamic therapy and gastrointestinal complications in major surgery: a meta-analysis of randomized controlled trials. Bd. 103, Br J Anaesth. 2009. s. 637–46.
43. Som A, Maitra S, Bhattacharjee S, Baidya DK. Goal directed fluid therapy decreases postoperative morbidity but not mortality in major non-cardiac surgery: a meta-analysis and trial sequential analysis of randomized controlled trials. 20161013. udg. Bd. 31, J Anesth. 2017. s. 66– 81.
44. Arulkumaran N, Corredor C, Hamilton MA, Ball J, Grounds RM, Rhodes A, m.fl. Cardiac complications associated with goal-directed therapy in high-risk surgical patients: a meta-analysis. 20140110. udg. Bd. 112, Br J Anaesth. 2014. s. 648–59.
45. Rollins KE, Lobo DN. Intraoperative Goal-directed Fluid Therapy in Elective Major Abdominal Surgery: A Meta-analysis of Randomized Controlled Trials. Bd. 263, Ann Surg. 2016. s. 465–76.
46. Sun Y, Chai F, Pan C, Romeiser JL, Gan TJ. Effect of perioperative goal-directed hemodynamic therapy on postoperative recovery following major abdominal surgery-a systematic review and meta-analysis of randomized controlled trials. 20170612. udg. Bd. 21, Crit Care. 2017. s. 141.
47. Melloul E, Hubner M, Scott M, Snowden C, Prentis J, Dejong CH, m.fl. Guidelines for Perioperative Care for Liver Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations. Bd. 40, World J Surg. 2016. s. 2425–40.
48. Debono B, Wainwright TW, Wang MY, Sigmundsson FG, Yang MMH, Smid-Nanninga H, m.fl. Consensus statement for perioperative care in lumbar spinal fusion: Enhanced Recovery After Surgery (ERAS(R)) Society recommendations. 20210112. udg. Bd. 21, Spine J. 2021. s. 729– 52.
49. Dort JC, Farwell DG, Findlay M, Huber GF, Kerr P, Shea-Budgell MA, m.fl. Optimal Perioperative Care in Major Head and Neck Cancer Surgery With Free Flap Reconstruction: A Consensus Review and Recommendations From the Enhanced Recovery After Surgery Society. Bd. 143, JAMA Otolaryngol Head Neck Surg. 2017. s. 292–303.
50. Temple-Oberle C, Shea-Budgell MA, Tan M, Semple JL, Schrag C, Barreto M, m.fl. Consensus Review of Optimal Perioperative Care in Breast Reconstruction: Enhanced Recovery after Surgery (ERAS) Society Recommendations. Bd. 139, Plast Reconstr Surg. 2017. s. 1056e–71e.
51. Engelman DT, Ben Ali W, Williams JB, Perrault LP, Reddy VS, Arora RC, m.fl. Guidelines for Perioperative Care in Cardiac Surgery: Enhanced Recovery After Surgery Society Recommendations. Bd. 154, JAMA Surg. 2019. s. 755–66.
52. Kaufmann T, Saugel B, Scheeren TWL. Perioperative goal-directed therapy – What is the evidence? 20190518. udg. Bd. 33, Best Pract Res Clin Anaesthesiol. 2019. s. 179–87.
53. Saugel B, Michard F, Scheeren TWL. Goal-directed therapy: hit early and personalize! Bd. 32, J Clin Monit Comput. Netherlands; 2018. s. 375–7.
54. McKendry M, McGloin H, Saberi D, Caudwell L, Brady AR, Singer M. Randomised controlled trial assessing the impact of a nurse delivered, flow monitored protocol for optimisation of circulatory status after cardiac surgery. 20040708. udg. Bd. 329, Bmj. 2004. s. 258.
55. Pearse R, Dawson D, Fawcett J, Rhodes A, Grounds RM, Bennett ED. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445]. 20051108. udg. Bd. 9, Crit Care. 2005. s. R687-93.
56. Kern JW, Shoemaker WC. Meta-analysis of hemodynamic optimization in high-risk patients. Crit Care Med. august 2002;30(8):1686–92.
57. Hofer CK, Muller SM, Furrer L, Klaghofer R, Genoni M, Zollinger A. Stroke volume and pulse pressure variation for prediction of fluid responsiveness in patients undergoing off-pump coronary artery bypass grafting. Chest. august 2005;128(2):848–54.
58. Kramer A, Zygun D, Hawes H, Easton P, Ferland A. Pulse pressure variation predicts fluid responsiveness following coronary artery bypass surgery. Chest. november 2004;126(5):1563–8.
59. Marik PE. Noninvasive cardiac output monitors: a state-of the-art review. 20120519. udg. Bd. 27, J Cardiothorac Vasc Anesth. 2013. s. 121–34.
60. Jammer I, Ulvik A, Erichsen C, Lodemel O, Ostgaard G. Does central venous oxygen saturation-directed fluid therapy affect postoperative morbidity after colorectal surgery? A randomized assessor- blinded controlled trial. Bd. 113, Anesthesiology. 2010. s. 1072–80.
61. Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Aneman A, m.fl. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. 20120627. udg. Bd. 367, N Engl J Med. 2012. s. 124–34.
62. Futier E, Garot M, Godet T, Biais M, Verzilli D, Ouattara A, m.fl. Effect of Hydroxyethyl Starch vs Saline for Volume Replacement Therapy on Death or Postoperative Complications Among High-Risk Patients Undergoing Major Abdominal Surgery: The FLASH Randomized Clinical Trial. Bd. 323, Jama. 2020. s. 225–36.
63. Joosten A, Delaporte A, Ickx B, Touihri K, Stany I, Barvais L, m.fl. Crystalloid versus Colloid for Intraoperative Goal-directed Fluid Therapy Using a Closed-loop System: A Randomized, Double-blinded, Controlled Trial in Major Abdominal Surgery. Bd. 128, Anesthesiology. 2018. s. 55–66.
64. Kabon B, Sessler DI, Kurz A. Effect of Intraoperative Goal-directed Balanced Crystalloid versus Colloid Administration on Major Postoperative Morbidity: A Randomized Trial. Bd. 130, Anesthesiology. 2019. s. 728–44.
65. Bisgaard J, Madsen R, Dybdal LL, Lauridsen JT, Mortensen MB, Jensen AG. Goal-directed therapy with bolus albumin 5% is not superior to bolus ringer acetate in maintaining systemic and mesenteric oxygen delivery in major upper abdominal surgery: A randomised controlled trial. Eur J Anaesthesiol. juni 2020;37(6):491–502.
66. Aaen AA, Voldby AW, Storm N, Kildsig J, Hansen EG, Zimmermann-Nielsen E, m.fl. Goaldirected fluid therapy in emergency abdominal surgery: a randomised multicentre trial. Br J Anaesth. oktober 2021;127(4):521–31.
67. ISRCTN – ISRCTN14729158: A clinical trial of blood flow optimisation for patients who have emergency bowel surgery [Internet]. [henvist 30. marts 2022]. Tilgængelig hos: https://www.isrctn.com/ISRCTN14729158
68. Glatz T, Kulemann B, Marjanovic G, Bregenzer S, Makowiec F, Hoeppner J. Postoperative fluid overload is a risk factor for adverse surgical outcome in patients undergoing esophagectomy for esophageal cancer: a retrospective study in 335 patients. BMC Surg. 13. januar 2017;17(1):6.
69. Weinberg L, Li M, Churilov L, Armellini A, Gibney M, Hewitt T, m.fl. Associations of fluid amount, type, and balance and acute kidney injury in patients undergoing major surgery. Anaesth Intensive Care. januar 2018;46(1):79–87.
70. Sim J, Kwak JY, Jung YT. Association between postoperative fluid balance and mortality and morbidity in critically ill patients with complicated intra-abdominal infections: a retrospective study. Acute Crit Care. august 2020;35(3):189–96.
71. Cihoric M, Kehlet H, Lauritsen ML, Højlund J, Kanstrup K, Foss NB. Inflammatory response, fluid balance and outcome in emergency high-risk abdominal surgery. Acta Anaesthesiol Scand. juli 2021;65(6):730–9.
72. Myles PS, Bellomo R, Corcoran T, Forbes A, Peyton P, Story D, m.fl. Restrictive versus Liberal Fluid Therapy for Major Abdominal Surgery. N Engl J Med. 14. juni 2018;378(24):2263–74.
73. Cihoric M, Kehlet H, Lauritsen ML, Højlund J, Foss NB. Electrolyte and Acid–Base Disturbances in Emergency High-Risk Abdominal Surgery, a Retrospective Study. World J Surg [Internet]. 9. marts 2022 [henvist 28. marts 2022]; Tilgængelig hos: https://link.springer.com/10.1007/s00268-022-06499-9
74. Tengberg LT, Bay-Nielsen M, Bisgaard T, Cihoric M, Lauritsen ML, Foss NB, m.fl. Multidisciplinary perioperative protocol in patients undergoing acute high-risk abdominal surgery. Br J Surg. marts 2017;104(4):463–71.
75. Edwards MR, Mythen MG. Fluid therapy in critical illness. Extreme Physiol Med. 2014;3:16.
76. Foss NB, Kehlet H. Challenges in optimising recovery after emergency laparotomy. Anaesthesia. januar 2020;75 Suppl 1:e83–9.
77. Jacobs R, Lochy S, Malbrain MLNG. Phenylephrine-induced recruitable preload from the venous side. J Clin Monit Comput. juni 2019;33(3):373–6.
78. Secher NH, Sander Jensen K, Werner C, Warberg J, Bie P. Bradycardia during severe but reversible hypovolemic shock in man. Circ Shock. 1984;14(4):267–74.
79. Schiller AM, Howard JT, Convertino VA. The physiology of blood loss and shock: New insights from a human laboratory model of hemorrhage. Exp Biol Med. april 2017;242(8):874–83.
80. Matot I, Paskaleva R, Eid L, Cohen K, Khalaileh A, Elazary R, m.fl. Effect of the volume of fluids administered on intraoperative oliguria in laparoscopic bariatric surgery: a randomized controlled trial. Arch Surg. marts 2012;147(3):228–34.
81. van der Zee EN, Egal M, Gommers D, Groeneveld ABJ. Targeting urine output and 30-day mortality in goal-directed therapy: a systematic review with meta-analysis and meta-regression. BMC Anesthesiol. december 2017;17(1):22.
82. Monnet X, Marik PE, Teboul J-L. Prediction of fluid responsiveness: an update. Ann Intensive Care. december 2016;6(1):111.
83. Pickett JD, Bridges E, Kritek PA, Whitney JD. Passive Leg-Raising and Prediction of Fluid Responsiveness: Systematic Review. Crit Care Nurse. april 2017;37(2):32–47.
84. Beaucoté V, Geri G, Vieillard-Baron A. The passive leg raising under pressure: focus on the impact of intra-abdominal hypertension. Ann Transl Med. juni 2020;8(12):801.
85. Biais M, Larghi M, Henriot J, de Courson H, Sesay M, Nouette-Gaulain K. End-Expiratory Occlusion Test Predicts Fluid Responsiveness in Patients With Protective Ventilation in the Operating Room: Anesth Analg. december 2017;125(6):1889–95.
86. Marik PE, Cavallazzi R. Does the central venous pressure predict fluid responsiveness? An updated meta-analysis and a plea for some common sense. Bd. 41, Crit Care Med. 2013. s. 1774– 81.
87. Perner A, Haase N, Wiis J, White JO, Delaney A. Central venous oxygen saturation for the diagnosis of low cardiac output in septic shock patients. Acta Anaesthesiol Scand. januar 2010;54(1):98–102.
88. Giraud R, Vujovic B, Assouline B, Neto Silva I, Bendjelid K. Do ScvO2 variations induced by passive leg raising predict fluid responsiveness? A prospective study. Bd. 9, Physiol Rep. 2021. s. e15012.
89. De Backer D, Vincent J-L. The pulmonary artery catheter: is it still alive? Curr Opin Crit Care. juni 2018;24(3):204–8.
90. Szabo C, Betances-Fernandez M, Navas-Blanco JR, Modak RK. PRO: The pulmonary artery catheter has a paramount role in current clinical practice. Ann Card Anaesth. marts 2021;24(1):4– 7.
91. Senoner T, Velik-Salchner C, Tauber H. The Pulmonary Artery Catheter in the Perioperative Setting: Should It Still Be Used? Diagn Basel Switz. 12. januar 2022;12(1):177.
92. Saugel B, Kouz K, Scheeren TWL, Greiwe G, Hoppe P, Romagnoli S, m.fl. Cardiac output estimation using pulse wave analysis-physiology, algorithms, and technologies: a narrative review. 20201124. udg. Bd. 126, Br J Anaesth. 2021. s. 67–76.
93. Felbinger TW, Reuter DA, Eltzschig HK, Bayerlein J, Goetz AE. Cardiac index measurements during rapid preload changes: a comparison of pulmonary artery thermodilution with arterial pulse contour analysis. J Clin Anesth. juni 2005;17(4):241–8.
94. Della Rocca G, Costa MG. Volumetric monitoring: principles of application. Minerva Anestesiol. juni 2005;71(6):303–6.
95. Fayad A, Shillcutt SK. Perioperative transesophageal echocardiography for non-cardiac surgery. 20171117. udg. Bd. 65, Can J Anaesth. 2018. s. 381–98.
96. Abbas SM, Hill AG. Systematic review of the literature for the use of oesophageal Doppler monitor for fluid replacement in major abdominal surgery. Bd. 63, Anaesthesia. 2008. s. 44–51.
97. Lee JH, Kim JT, Yoon SZ, Lim YJ, Jeon Y, Bahk JH, m.fl. Evaluation of corrected flow time in oesophageal Doppler as a predictor of fluid responsiveness. Br J Anaesth. 20070709. udg. september 2007;99(3):343–8.
98. Martina JR, Westerhof BE, van Goudoever J, de Beaumont EM, Truijen J, Kim YS, m.fl. Noninvasive continuous arterial blood pressure monitoring with Nexfin(R). Bd. 116, Anesthesiology. 2012. s. 1092–103.
99. Broch O, Renner J, Gruenewald M, Meybohm P, Schottler J, Caliebe A, m.fl. A comparison of the Nexfin(R) and transcardiopulmonary thermodilution to estimate cardiac output during coronary artery surgery. 20120211. udg. Bd. 67, Anaesthesia. 2012. s. 377–83.
100. Lima AP, Beelen P, Bakker J. Use of a peripheral perfusion index derived from the pulse oximetry signal as a noninvasive indicator of perfusion. Crit Care Med. juni 2002;30(6):1210–3.
101. Reisner A, Shaltis PA, McCombie D, Asada HH. Utility of the photoplethysmogram in circulatory monitoring. Bd. 108, Anesthesiology. 2008. s. 950–8.
102. Klijn E, Groeneveld AB, van Genderen ME, Betjes M, Bakker J, van Bommel J. Peripheral Perfusion Index Predicts Hypotension during Fluid Withdrawal by Continuous Veno-Venous Hemofiltration in Critically Ill Patients. 20150630. udg. Bd. 40, Blood Purif. 2015. s. 92–8.
103. van Genderen ME, Bartels SA, Lima A, Bezemer R, Ince C, Bakker J, m.fl. Peripheral perfusion index as an early predictor for central hypovolemia in awake healthy volunteers. 20130109. udg. Bd. 116, Anesth Analg. 2013. s. 351–6.
104. Hojlund J, Agerskov M, Clemmesen CG, Hvolris LE, Foss NB. The Peripheral Perfusion Index tracks systemic haemodynamics during general anaesthesia. 20191109. udg. Bd. 34, J Clin Monit Comput. 2020. s. 1177–84.
105. Beurton A, Teboul JL, Gavelli F, Gonzalez FA, Girotto V, Galarza L, m.fl. The effects of passive leg raising may be detected by the plethysmographic oxygen saturation signal in critically ill patients. 20190118. udg. Bd. 23, Crit Care. 2019. s. 19.
106. Agerskov M, Thusholdt ANW, Holm-Sorensen H, Wiberg S, Meyhoff CS, Hojlund J, m.fl. Association of the intraoperative peripheral perfusion index with postoperative morbidity and mortality in acute surgical patients: a retrospective observational multicentre cohort study. 20210703. udg. Bd. 127, Br J Anaesth. 2021. s. 396–404.
107. Sanders M, Servaas S, Slagt C. Accuracy and precision of non-invasive cardiac output monitoring by electrical cardiometry: a systematic review and meta-analysis. J Clin Monit Comput. juni 2020;34(3):433–60.
108. Sørensen H, Secher NH, Siebenmann C, Nielsen HB, Kohl-Bareis M, Lundby C, m.fl. Cutaneous vasoconstriction affects near-infrared spectroscopy determined cerebral oxygen saturation during administration of norepinephrine. Anesthesiology. august 2012;117(2):263–70.
109. Sørensen H. Near infrared spectroscopy evaluated cerebral oxygenation during anesthesia. Dan Med J. december 2016;63(12):B5318.
110. Chan MJ, Chung T, Glassford NJ, Bellomo R. Near-Infrared Spectroscopy in Adult Cardiac Surgery Patients: A Systematic Review and Meta-Analysis. J Cardiothorac Vasc Anesth. august 2017;31(4):1155–65.
111. Scheeren TWL, Kuizenga MH, Maurer H, Struys MMRF, Heringlake M. Electroencephalography and Brain Oxygenation Monitoring in the Perioperative Period. Anesth Analg. februar 2019;128(2):265–77.
112. Pillinger NL, Kam P. Endothelial glycocalyx: basic science and clinical implications. Anaesth Intensive Care. maj 2017;45(3):295–307.
113. Astapenko D, Benes J, Pouska J, Lehmann C, Islam S, Cerny V. Endothelial glycocalyx in acute care surgery – what anaesthesiologists need to know for clinical practice. 20191220. udg. Bd. 19, BMC Anesthesiol. 2019. s. 238.
114. Jedlicka J, Becker BF, Chappell D. Endothelial Glycocalyx. 20200206. udg. Bd. 36, Crit Care Clin. 2020. s. 217–32.
115. Kamp-Jensen M, Olesen KL, Bach V, Schutten HJ, Engquist A. Changes in serum electrolyte and atrial natriuretic peptide concentrations, acid-base and haemodynamic status after rapid infusion of isotonic saline and Ringer lactate solution in healthy volunteers. Br J Anaesth. maj 1990;64(5):606–10.
116. Bruegger D, Jacob M, Rehm M, Loetsch M, Welsch U, Conzen P, m.fl. Atrial natriuretic peptide induces shedding of endothelial glycocalyx in coronary vascular bed of guinea pig hearts. Am J Physiol Heart Circ Physiol. 20050617. udg. november 2005;289(5):H1993-9.
117. Nygren A, Redfors B, Thoren A, Ricksten SE. Norepinephrine causes a pressure-dependent plasma volume decrease in clinical vasodilatory shock. 20100506. udg. Bd. 54, Acta Anaesthesiol Scand. 2010. s. 814–20.
118. Damen T, Saadati S, Forssell-Aronsson E, Hesse C, Bentzer P, Ricksten SE, m.fl. Effects of different mean arterial pressure targets on plasma volume, ANP and glycocalyx-A randomized trial. 20201005. udg. Bd. 65, Acta Anaesthesiol Scand. 2021. s. 220–7.
119. Aldecoa C, Llau JV, Nuvials X, Artigas A. Role of albumin in the preservation of endothelial glycocalyx integrity and the microcirculation: a review. Ann Intensive Care. 20200622. udg. 22. juni 2020;10(1):85.
120. Milford EM, Reade MC. Resuscitation Fluid Choices to Preserve the Endothelial Glycocalyx. 20190309. udg. Bd. 23, Crit Care. 2019. s. 77.
Appendiks A. Monitorering af væsketerapi
A 1. Klinisk vurdering af hypovolæmi
Flere kliniske tegn kan tyde på hypovolæmi, bl.a. hypotension (og evt. vasopressorbehov) som ikke forklares af excessiv vasodilatation f.eks. pga. anæstesi, stigende laktat, stigende puls (OBS! Pludselig bradykardi kan indikere livstruende hypovolæmi)(78,79), kolde og/eller marmorerede ekstremiteter eller fluktuationer i arteriekurven. Det er vigtigt at pointere at disse symptomer ikke nødvendigvis skal give anledning til væskeindgift da de også kan skyldes kardielt svigt. Ved den kliniske vurdering skal der desuden tages højde for mulige reversible årsager som kan påvirke preload/kontraktilitet så som lejring, intraabdominal/-thorakal tryk, anæstesidybde, lav pH med videre. I lighed med faldende blodtryk bør aftagende intraoperative diureser ikke anvendes som isoleret trigger for væskeindgift da dette ofte ville medføre unødvendigt og skadeligt væskeoverskud.(80,81)
A 2. Metoder til hæmodynamisk monitorering
Målstyret væsketerapi er baseret på optimering af preload hhv. hjertets slagvolumen og kræver avancerede metoder til hæmodynamisk overvågning. I de følgende afsnit beskrives de mest udbredte modaliteter.
Selv ved grundig klinisk vurdering og avanceret monitorering kan der herske tvivl om patientens kredsløbspåvirkning skyldes behov for væske. I disse tilfælde ville indgift af en væskebolus i forbindelse med MVT kunne resultere i uhensigtsmæssigt væskeoverskud hos “ikke væskeresponder”. Ved hjælp af kortvarig passiv benløft eller Trendelenburg positionering øges preload med omkring 300 mL og SV respons kan evalueres.(82,83) Disse manøvrer kan være svære at gennemføre under kirurgi og kan give et falsk negativt resultat ved forhøjet intraabdominal tryk.(84) Som alternativ til benløfttesten kan en slutekspiratorisk okklusionstest anvendes hvor der holdes en slutekspiratorisk pause i ca. 15 sekunder (“expiratory hold”). Denne manøvre udløser en stigning i preload og en følgende stigning i slagvolumen (≥5%) vil oftest resultere i en positiv respons på en væskebolus.(85)
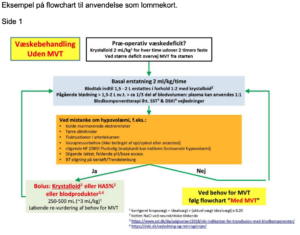
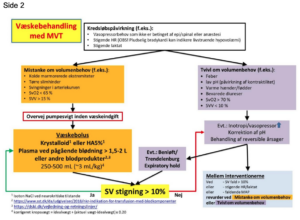
Appendiks C viser et eksempel på et flowchart til væskebehandling, som tilgodeser de her nævnte rekommendationer.
A 2.1. Centralt venøst tryk
Centralt venøst tryk (CVP) har selv ved lave værdier en lav positiv prædiktiv værdi for preloadafhængighed. Ved høje værdier er den negative prædiktive værdi højere, dvs. indikativ for at patienter formentlig ikke er preload-afhængige. Overordnet anses CVP som en dårlig parameter for styring af væskebehandling.(86)
A 2.2. Central venøs saturation
Central venøs iltsaturation (ScvO2) afspejler balancen mellem kroppens ilttilbud (DO2) og iltforbrug (VO2). Normale (70-75%) eller høje værdier udelukker ikke central hypovolæmi, især hos den septiske patient, mens en lav ScvO2 (<65%) er udtryk for et lavt cardiac index.(87) Analog til slagvolumen-styret væskebehandling kan ScvO2-stigningen anvendes til vurdering af patienternes preload-afhængighed.(88) Inden en såkaldt fluid challenge måles ScvO2, derefter indgives en intravenøs væskebolus (typisk 300 mL) indenfor få minutter, hvorefter der bliver foretaget endnu en ScvO2-måling. Denne sekvens gentages, indtil ScvO2-niveauet ikke stiger yderligere, dvs. til et indirekte mål for at toppen af Starlingkurven er nået. Det skal pointeres, at faktorer med potentiel indflydelse på ScvO2, såsom vasopressordosis, respiratorindstillinger, lejring mv., skal holdes konstant mellem målingerne.
A 2.3. Pulmonalarteriekateter/ Swan – Ganz kateter
Ønskes nøjagtige måling af slagvolumen og dermed hjertets minutvolumen og flere centrale tryk anvendes et pulmonalarteriekateter. CO bestemmes ved termodilution enten kontinuerligt eller ved boli af koldt saltvand. Kateteret måler desuden trykket både i vena cava superior og arteria pulmonalis, samt blandet venøs saturation (SvO2) kontinuerligt. Systemisk vaskulær modstand (SVR) og pulmonal vaskulær modstand (PVR) beregnes fra de målte tryk og CO, mens slagvolumen beregnes ud fra hjertefrekvens og CO. Pulmonalarteriekateter monitorering bruges hovedsagelig til monitorering under større hjerte-lungekirurgi og rutinemæssig anvendelse udenfor disse rammer frarådes grundet potentiale for alvorlige komplikationer.(89–91)
A 2.4. Pulskonturanalyse
Konceptet af pulskonturmetoden til estimering af slagvolumen baseres på, at hjertets slagvolumen afspejles i den systoliske del af trykkurven dvs. fra diastolens afslutning til den dikrote hævning, som svarer til lukningen af aortaklappen. Divideres arealet af dette systoliske trykforløb med aortas modstand fås et mål for slagvolumen. Aortas eftergivelighed og dermed modstand ændrer sig afhængig af trykket, hvorfor måleudstyret benytter sig af et nomogram, hvor både patientens alder, højde, vægt og køn indgår. Nomogrammet er baseret på postmortem målinger af aortas eftergivelighed. De absolutte værdier er behæftet med stor usikkerhed, idet patientens ”sande” aortaimpedans ikke måles. Flere apparater som benytter sig af en eller anden form for pulskonturanalyse, tillader kalibrering af værdierne ved termodilution eller anden form for indikatorfortyndingsmetode (f.eks. PICCO, EV1000, LiDCO). Et nylig publiceret narrativ oversigtsartikel giver et godt overblik over de mest udbredte apparater og deres forskelle.(92)
Ændringer i estimatet for slagvolumen på væskeindgift eller benløft/Trendelenburg, slagvolumenvariation (SVV) og pulstrykvariation (PPV) kan anvendes for vurdering af patientens preload-afhængighed. Pragmatisk kan siges at der ved synlige respirationssynkrone svingninger i arteriekurven (PPV > 12%) hos den ventilerede liggende patient (tidalvolumen 8 mL/kg) sandsynligvis foreligger en preload-afhængighed og dermed ofte indikation for volumenindgift.(57,58) Baggrunden er at de ændringer i preload som induceres via overtryksventilation medfører større ændringer i slagvolumen på den ascenderende stejle del af Starling kurven fremfor den flade del af Starling kurven. Fejlkilder ved estimering af slagvolumenændringer fra arteriekurven kan opstå pga. dæmpning, knæk af arteriekateter og lejringsbetingede påvirkning af arteriekurven.
Flere systemer viser god overensstemmelse i forhold til pulmonalarteriekateter målinger.(93,94)
A 2.5. Intraoperativ transøsophageal ekkokradiografi
Intraoperativ transøsophageal ekkokradiografi (TEE) kan være indiceret under høj risiko kirurgi feks. hos en patient med moderat til svær hjertekarsygdom, hvor der forventes betydelige væskeskift og/eller blodtab. Intraoperativ overvågning med TEE tillader kontinuerlig monitorering af volumenstatus og ventrikulær funktion. Ændringer i størrelsen af venstre ventrikel kan tjene som en dynamisk parameter for vurdering af væskerespons. Derudover estimeres global systolisk og diastolisk ventrikulær funktion, klapstruktur og funktion.(95)
A 2.6. CardioQ – transøsophageal Doppler
Cardiac output (CO) kan estimeres ved brug af en Doppler probe (CardioQ) placeret i den distale esofagus. Der måles blodstrømmens hastighed i aorta decendens og CO estimeres ved at multiplicere flowhastigheden med tværsnitsarealet af aorta. Tværsnitsarealet estimeres fra nomogrammer baseret på alder, køn, vægt og højde. Anvendelse af øsofagus Doppler har flere begrænsninger og valide målinger er meget afhængige af korrekt placering og er meget operatør afhængig. Trods de omtalte begrænsninger viser flere studier reduktion i komplikations rater og indlæggelsestid ved brug af øsofagus Doppler til individualiseret MVT.(96,97)
A 2.7. Non-invasiv kontinuerlig blodtryksmåling
Non-invasiv og kontinuerlig monitorering af blodtrykket er muligt ved hjælp af photoplethysmografisk teknik. Apparatet består af en lille pneumatisk manchet som anbringes omkring pegefingeren.(98,99) På hver side af manchetten sidder en infrarød lyskilde hhv. sensor til måling af blodvolumen i fingeren. Det tryk som kræves for at holde blodvolumen under manchetten konstant, svarer til det arterielle blodtryk i fingerarterierne. Ved løbende justering af manchettrykket til netop dette trykniveau kan blodtrykket måles kontinuerligt. Apparatet er blevet valideret både klinisk og bland andet under idrætsfysiologiske forsøg.
Måling af photoplethysmografisk CO er baseret på de ovenfor beskrevne principper for pulskonturanalyse.(99) Metoden er afhængig af normal perfusion af fingrene, hvilken kan være kompromitteret af mange årsager.
A 2.8. Perfusionsindex
Det perifere perfusionsindeks (PPI) opnås kontinuert og non-invasivt fra photoplethysmografi / pulsoxymetri. Ikke alle pulsoxymetre viser PPI, men alle måler det, idet perfusionsindekset er en integreret del af pulsoxymetri. PPI er et simpelt forholdstal mellem den pulsatile og ikke-pulsatile absorption af det udsendte lys.(100,101)
I vågen tilstand er sympatikus-tonus den dominerende faktor for PPI, hvor høj sympatikustonus medfører lavere perfusionsindeks og f.eks. sympatikusblokade (som ved perifer nerveblokade) medfører stigende perfusionsindeks. Således kan et lavt PPI hos den vågne patient være udtryk for hypovolæmi, med kompensatorisk sympatikus aktivering.(102,103) Andre årsager kan fx være angst eller smerte.
Under generel anæstesi er den basale sympatikus tonus reduceret, hvorfor PPI normalt er højere end i vågen tilstand. Der er kun lavet få studier med samtidig måling af SV/CO og PPI under anæstesi/sedation. Disse tyder på en sammenhæng mellem ændringer i SV/CO og ændringer i PPI.(104,105) Samtidigt er det vist, at lavt PPI (<0.5%) er forbundet med dårligt outcome ved højrisiko-kirurgi.(106)
PPI har således gennem sin tilgængelighed og muligheden for med høj tidsopløsning at få avanceret indblik i cirkulationen en plads i monitoreringstilbuddet. Dog kræves en erfaring med tolkning pga. komplekst sammenspil mellem ændringer i hæmodynamik og sympatikustonus på signalet, samt flere mulige fejlkilder (typisk relateret til fingerklemmens placering).
A 2.9. Impedansbaserede metoder
Disse metoder indebærer anvendelsen af en lille elektrisk strøm som sendes gennem elektroder placeret på halsen og siderne af brystet. Ved bioelektrisk impedansanalyse måles modstanden mellem disse elektroder som er forårsaget af den elektriske ledningsevne af de forskellige typer biologisk væv som fedt og muskler, samt vand og elektrolytindholdet intra- og ekstracellulært. Den pulsatile blodstrøm forårsager tilsvarende ændringer i modstanden mellem elektroderne, og CO beregnes fra impedanskurven.(107)
A 2.10. Nær infrarød spektroskopi
Ændringer i vævets blodforsyning kan bestemmes kontinuerligt og non-invasivt ved hjælp af nær infrarød spektroskopi (NIRS). NIRS-apparatet kan ud fra ændringer i lysabsorption bestemme koncentrationsændringer af oxy- hhv. deoxyhæmoglobin i det underliggende væv. For overvågning af uni- eller bilateral cerebral oxygenering klistres én eller to optoder på panden. Værdien er domineret af signalet fra det venøse blod, men afspejler også arterielle flowændringer. NIRS-målinger er også følsomme overfor ændringer i systemisk oxygenering, og er under betydelig indflydelse (~30%) fra hudgennemblødningen. Dette har især betydning under brug af vasopressorstoffer, f.eks. noradrenalin, hvor et fald i NIRS signalet ikke afspejler et fald i cerebral flow men derimod hudgennemblødning.(108) NIRS signalet betragtes som en måler af balancen mellem oxygen-tilbud og -forbrug i vævet, hvor udgangspunktet er værdien, som opnås hos den ubedøvede, vågne og relevante patient.(109)
Uanset begrænsningerne har behandlingsalgoritmer som stiler på bevarelsen af de præanæstesiologiske cerebrale NIRS-værdier vist sig værdifuld under anæstesi til hjertekirurgi.(110,111)
Appendiks B. Fremtidige perspektiver: endothelfunktion
Igennem de senere år er der kommet et stigende fokus på interaktionen mellem væsketype, det infunderende væskevolumen og endothelet. Infusion af intravenøs væske kan være forbundet med skade på endothelet, medførende øget vaskulær permeabilitet. Dette kan forårsage udfiltrering til det interstitielle rum, resulterende i ødem og øget kirurgisk morbiditet.(112,113)
Basis for dette er skade på den endotheliale glycocalyx som er et negativt ladet beskyttende lag bestående af proteoglykaner, glykoproteiner og glycolipider.(112–114) Laget er placeret på den luminale overflade af endothelet.
Intakt glycocalyx er ikke en statisk struktur. Det er kendt at en lang række fysiologiske og patologiske forhold giver anledning til negativ påvirkning af glycocalyx, og dermed utæthed af endothelet.
Hypervolæmi fører til afgift af ANP (atrial natriuretisk peptid) fra atriet. ANP forårsager direkte tab/ødelæggelse af glycocalyx med øget microvaskulær permeabilitet, øget netfiltration og tab af kolloider til det interstitielle rum.(115,116)
Forskellige sygdomme (fx. diabetes mellitus, sepsis, traume) kan også ødelægge glycocalyx og udfordre tilgangen til væskesubstitution.
Profylaktiske tiltag i forhold til at opretholde glycocalyx funktion perioperativt er at tilstræbe normovolæmi, undgå hypervolæmi, undgå vand- og saltoverskud samt reduktion af det kirurgiske stress respons.(112) Endvidere skal undgås hyperglykæmi som også bidrager til glycocalyx dysfunktion.
Metoderne til opretholdelse af normovolæmi er omtalt i denne væskevejledning.
En særlig udfordring er at identificere patienter med manifest præoperativ glycocalyx skade og optimere behandlingen så yderligere skade og effekter heraf undgås (ødemdannelse, svækket mikroperfusion m.v.). Som hjælpemiddel til at identificere patienter med glycocalyx skade, kan den relative plasmavolumeneffekt af en tilført væskebolus benyttes. Effekten estimeres ved hjælp af måling af hæmatokrit før og efter en væskebolus.(117,118)
Forskellige infusionsvæsker har varierende effekter i forhold til at bevare og opbygge glycocalyx. Albumin er fysiologisk bundet til glycocalyx, hvor det beskytter mod afstødning og bidrager til opretholdelse af den vaskulære integritet og normal kapillær permeabilitet.(119) Plasma har lignende beskyttende effekt, og muligvis også reparerende effekt på ødelagt glycocalyx. Der er dog brug for mere viden om virkningsmekanismer, klinisk kontekst og applikationer før præcise anbefalinger kan gives om genopbygning af glycocalyx.(119,120)
Appendiks C. Eksempel på flowchart
Indholdsfortegenelse
