Indledning
Vejledningen er udarbejdet og revideret på baggrund af litteraturstudier og i overensstemmelse med nyere, nationale og internationale guidelines. Definitioner og behandlingsprincipper svarer i hovedtræk til følgende guidelines: DSOG Hypertension og præeklampsi (1) ACOG Hypertension in Pregnancy 2013(2), NICE Clinical Guideline 2010 (opdateret 2015), hypertension in pregnancy: diagnosis and management, (3) CEMACH 2011, (4) samt SOGC Clinical practice guideline No307 2014. (5)
Definition af begreber
Der findes en række hypertensive tilstande hos gravide. Disse kan være kombineret med proteinuri. Desuden findes en række tilstande, som anses for at indgå i samme sygdomskompleks, f.eks. HELLP-syndrom, men hvor der ikke nødvendigvis forekommer hypertension. Isolerede ødemer anses ikke for at være en del af sygdomskomplekset.
Essentiel hypertension
Hypertension tidligt i graviditeten (< uge 20) eller forud for graviditeten.
Gestationel hypertension
Hypertension uden proteinuri optrædende efter 20. uge hos en forud rask gravid.
Præeklampsi
Defineret ved:
Hypertension:
– ≥ 140 mmHg systolisk og/eller ≥ 90 mmHg diastolisk ved to lejligheder med mindst 4 timers mellemrum efter 20. uge hos en kvinde med tidligere normalt blodtryk.
– Ved blodtryk ≥ 160 mmHg systolisk og/eller ≥ 110 mmHg diastolisk kan hypertension bekræftes indenfor et kortere interval (min) for at facilitere rettidig og relevant anti-hypertensiv behandling.
MED proteinuri:
– Døgnudskillelse (protein) ≥ 300 mg. (Normalområde < 30 mg/døgn)
– Spoturin, albuminudskillelse ≥ 200 mg/L (Normalområde < 20 mg/L)
– Spoturin, albumin/creatinin ratio ≥ 300 mg/g (Normalområde < 30 mg/g).
– Spoturi, protein/creatinin ratio ≥ 30 mg/mmol (Normalområde < 3 mg/mmol)
– Steril midtstråle urinstix ≥ +1 for protein.
UDEN proteinuri: Nytilkommen hypertension med én af følgende nytilkomne tilstande
– Thrombocytopeni: Mindre end 100 x 109 /l.
– Renal insufficiens: Serum kreatinin konc. større end 100 µmol/L eller en fordobling af serum kreatinin konc. i forhold til normalområdet for gestations alderen, når der ikke er tilstedeværelse af anden nyresygdom
– Nedsat lever funktion: Forhøjede blod konc. af lever transaminaser til det dobbelte af normal konc.
– Lungeødem
– Cerebrale- eller visuelle symptomer: Alm. let hovedpine alene er ikke nok. Såfremt hovedpine betragtes som cerebralt symptom, bør der være tale om svær hovedpine (ofte frontal) og man bør gøre en indsats for at udelukke forekomst af spændings-hovedpine. Der skal være tale om fx ændret eller sløret sensorium som ”osteklokke”-fornemmelse, eller at ”man er ved siden af sig selv” eller fokale neurologiske udfald, absencer, synkope, hyperrefleksi, fokale eller generaliserede kramper eller synsforstyrrelser som flimmerskotomer og nedsat syn.
– Utero-placental dysfunktion: IUGR sv.t en UL-estimeret vægt mindre end 15 % dvs mindre end 10 percentilen
– HELLP: Hemolysis, Elevated Liverenzymes, Low Platelets (se under HELLP)
Præeklampsi “overbygget” på kronisk essentiel hypertension: Proteinuri og blodtryksstigning hos en kvinde med bestående hypertension
Svær præeklampsi:
BT ≥ 160 mmHg systolisk og/eller ≥ 110 mmHg diastolisk og/eller forekomst af subjektive symptomer og abnorme laboratoriefund som følge af organpåvirkning:
– CNS: Hovedpine, synsforstyrrelser, kramper (eklampsi)
– Kredsløb: Dyspnoe, trykken for brystet (lungestase, lungeødem)
– Lever: Smerter i epigastriet, opkastninger
Påvirket paraklinik:
– Lever: Udtalt forhøjede leverenzymer (ASAT/ALAT > 70 U/L), s-bilirubin forhøjet –
– Nyrer: Oliguri < 400 ml/24 timer, svær proteinuri > 3 g/24 timer, S-Urat > 45 mmol/L, S-Kreatinin > 110 µmol/L
– Koagulation: Trombocytter < 100 x 109 /L, dissemineret intravaskulær koagulation (APTT >1,5 x udgangsværdien, AT < 70), hæmolyse, (LDH >600 U/L og/eller haptoglobin <0,3 g/l = <3 µmol/l).
– HELLP: Hemolysis, Elevated Liverenzymes (ALAT/ASAT > 100 U/L ), Low Platelets (<100×109 /L). (se under HELLP)
En biokemisk parameter, der isoleret fremkommer patologisk og ikke ledsages af andre symptomer eller tegn på svær præeklampsi, skal vurderes med varsomhed, og ikke nødvendigvis føre til eksempelvis akut forløsning
Eklampsi:
Kramper og/eller koma uden anden kendt årsag under graviditet, fødsel eller indenfor 4 uger post-partum hos patienter med tegn eller symptomer på præeklampsi (6)
Ad. Hypertension
– BT ≥ 140 mm Hg systolisk og/eller 90 mm Hg diastolisk. Før målingerne bør kvinden have været i hvile i 5 min. Der måles mindst to blodtryk ved værdier ≥ 140/90 mm Hg. Gennemsnittet af de to sidste målinger anvendes. Hvis blodtrykkene afviger mere end 5 mmHg fra hinanden foretages flere målinger.
Ad. Protein
– Døgnurinopsamling kun på speciel indikationved mistanke om tilgrundliggende nyrelidelse
– Spor skyldes forurening og IKKE proteinuri og giver ikke anledning til udredning eller behandling
– Proteinuri før uge 20 kan skyldes kronisk nyrelidelse og bør udredes.
– Ved manifestproteinuri udgør albumin ca 60 % af totalprotein
– Døgnudskillelsen af protein angivet i mg opnås ved at gange ratio med 10, da kreatininudskillelsen/døgner ca 10 mmol/døgn og konstant. Således svarer en protein/kreatinin ratio på 30 mg/mmol til døgn proteinudskillelse på ca 300 mg.
– Albumin angivet i mikromol kan omregnes til gram ved at dividere med 15.
Antihypertensiv behandling
Rekommandation
Ante- og intra-partum antihypertensiv behandling
– Behandlingen afhænger af graden af hypertension, uanset om det er kronisk hypertension, gestationel hypertension eller præeklampsi
– For kvinden i aktiv fødsel, kan den medicinske antihypertensive behandling med fordel suppleres med epidural analgesi
– Peroral antihypertensiv behandling fortrækkes for at undgå pludselig, drastisk blodtryksfald
Behandlingsmål
– Standse blodtryksstigning og foretage en langsom reduktion i blodtrykket til systolisk BT<150 og diastolisk BT mellem (80)90-100 (B/C)
Skema for antihypertensiv behandling:
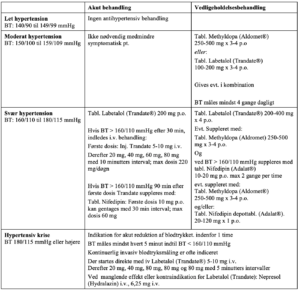
Methyldopa (Aldromet): Hæmmer den normale produktion af noradrenalin, men først og fremmest decarboxyleres methyldopa til methylnoradrenalin, der er en potent central α-receptoragonist. Herved nedsættes den sympatiske tonus væsentligt. Virkningen er væsentligst central. Der kan først forventes effekt af Methyldopa efter ca. et døgn.
Labetolol (Trandate): Adrenergt α- og β-receptorblokerende middel uden egenstimulerende (“intrinsic”) sympatomimetisk virkning. Er ikke β1-selektivt, hvorfor det har en vis bronkokonstriktorisk virkning.
Nifedipin (Adelat): Calciumantagonist (gruppe II) med overvejende kardilatation af perifere og koronare arterier og vener. Hjertets ledningssystem og muskelcellerne i såvel hjerte som blodkar er følsomme for ændringer i den intracellulære calciumkoncentration. Hæmning af calciuminfluks udløser således både nedsat hjertemuskelkontraktion og blodtryksreduktion på grund af nedsat perifer modstand.
Hydralazin (Nepresol): Væsentligst en direkte hæmmende virkning på arteriolemuskulaturens tonus. Den præcise mekanisme for denne vasodiltation er ukendt.
I sjældne tilfælde anvendes
- I.V. Infusion Labetalol (Trandate®): Ufortyndet Labetalol (Trandate®) 5 mg/ml i 50 ml sprøjte. Start med 4 ml/time. Infusionshastigheden fordobles med 30 min interval til ønsket effekt eller til max max. 32 ml/time (160 mg/time)
- Hydralazin (Nepresol®): 5-6,25 mg i.v. Hydralazin (Nepresol®) kan gentages med 20-30 minutters intervaller op til max dosis 32 mg
Ved terapisvigt af ovenstående kan anvendes:
- I.V. Infusion Natriumnitroprussid (Nipride®): Nedsætter perifer modstand og det venøse tilbageløb, reducere herved både preload og afterload. Kræver invasiv BT monitorering. Initial infusionshastighed 0,15 µg/kg/min. Følsomheden for nitroprussid er øget hos patienter med præ-eklampsi. Paradoksalt fald i maternel HR ses ofte (reduceret sinoaortic baroreceptor følsomhed). Pludselig maternel hypotension er set ved doser så lave som 0,3 µg/kg/min
Antidot
- Inj. Efedrin 5-10 mg i.v. p.n. ved utilsigtet for kraftigt blodtryksfald med påvirket hjertefrekvens hos foster
Postpartum antihypertensiv behandling
Opvågnings- og Intensivafsnit:
- BT bør post-partum ikke overstige 150/100 mmHg (B)
- Mål: systolisk BT < 150 diastolisk BT 80-90 mmHg
Inden for de første 6-12 timer post-partum kan det være indiceret at supplere med :
- Labetalol (Trandate®) 20-200 mg i.v. (B)
- og/eller Hydralazin (Nepresol®) 6,25 mg i.v. (B)
- Captopril, som er kontraindiceret under graviditeten, kan anvendes efter fødslen, også til ammende. (B)
Den perorale antihypertensive behandling skal fortsætte efter fødslen:
Følgende antihypertensiva kan anvendes postpartum: Labetalol, nifedipine, captopril.
- Tabl. Labetalol (Trandate®). Dosis: 100-300 mg x 2-4 p.o. (B)
- Tabl. Nifedipin depottabl. (Adalat®). Dosis: 20-120 mg x 1 p.o. (B)
- Tabl. Captopril. Dosis: 25 mg x 1-2 p.o. (B)
Barselsafsnittet: Der henvises til DSOGs guideline om præeklampsi
Baggrund
Definitioner
Definitionerne er i overensstemmelse med DSOG (1)
Antihypertensiv behandling
Der er konsensus om at undlade behandling af gravide ved BT <150/100 mmHg, idet studier har vist en mulig risiko for væksthæmning og ingen bedring af maternel outcome. (3,7)
Der er derimod konsensus om at behandle moderat hypertension. Ifølge guidelines fra NICE (2010) (revideret 2015 uden ændringer i rekommandationer) og CEMACH (2011) er der indikation for akut antihypertensiv behandling ved BT ≥ 150 mmHg systolisk og /eller diastolisk BT ≥ 100 mmHg. (3,4)
Cerebral hæmorrhagi er den hyppigste årsag til maternel død ved præeklampsi og eklampsi (8). Der er i de seneste år kommet fokus på relationen mellem det systoliske blodtryk og risikoen for intracerebral katastrofe. I et studium fra 2005 undersøgte man sammenhængen mellem blodtryk og intracerebral hæmorrhagi hos kvinder med præeklampsi. Af de kvinder, der fik hæmorrhagi, havde 100 % systolisk blodtryk > 155 mmHg, mens kun 12,5 % havde diastolisk blodtryk > 110 mmHg. (9)
Udover at forårsage cerebrale skader udgør svært forhøjet blodtryk en risiko for nyre-og leversvigt, retinaforandringer og lungestase, og for barnet risiko for nedsat placentaperfusion og placentaløsning. (10)
Præeklampsi er en indikation for epidural analgesi ved vaginal fødsel, med mindre der er kontraindikationer. Epidural analgesi bedrer den maternelle hæmodynamiske kontrol, og den føto-placentale gennemblødning. Derudover undgås risikoen for anæstesiologiske komplikationer ved generel anæstesi, idet sectio kan foretages i top-up af epiduralen. (11)
Svær hypertension indicerer derfor behandling og indlæggelse. Behandlingen bør tilstræbe en gradvis reduktion af blodtrykket, idet et drastisk blodtryksfald kan medføre en nedsat perfusion af cerebrum, nyrer og det uteroplacentare kredsløb. (1) Derfor fortrækkes oral antihypertensiv behandling. Maternel hypotension udgør en særlig risiko hos kvinder med svær præeklampsi p.g.a. nedsat intravaskulært volumen. (12)
Valg af medikamentel behandling:
Ifølge det seneste Cochrane review (Duley) er der ikke evidens for at fremhæve et antihypertensivum frem for et andet til akut behandling af svær hypertension under graviditet. (12) Fireogtyve studier (3573 kvinder) indgik i review’et, der omfattede i alt15 forskellige sammenligninger af et antihypertensivum med et andet. Der blev ikke fundet evident forskel mellem de undersøgte behandlinger. På grund af bivirkninger eller andre ulemper fraråder forfatterne følgende antihypertensiva: magnesium sulfat (skønt dette er indiceret som profylakse mod eklampsi), højdosis diazoxid, ketanserin, nimodipine og chlorpromazin. En anden metaanalyse har sammenlignet effekten af hydralazin med de øvrige, hyppigst anvendte antihypertensiva til akut behandling af svær hypertension. (13) Af 21 randomiserede studier sammenlignede 8 hydralazin med nifedipin og 5 med labetalol. Resultaterne tyder på en mere effektiv blodtryksreduktion efter hydralazin sammenlignet med labetalol, og en større effekt af nifedipin sammenlignet med hydralazin, men forskellene var ikke signifikante. Hydralazin var forbundet med flere tilfælde af maternel hypotension (13 studier), sectio (14 studier), abruptio placenta (5 studier), oliguri (3 studier), påvirket FHR (12 studier) og lave Apgar scores ved 1 minut (3 studier). Sammenlignet med labetalol var hydralazin forbundet med flere maternelle bivirkninger (12 studier) men med mindre neonatal bradycardi. På trods af den utilstrækkelige styrke af data er konklusionen af metaanalysen, at der ikke synes at være grundlag for at bibeholde hydralazin som first-line behandling af svær hypertension.
Labetalol
Labetalol, en α-β-adrenerg blokker, har mange steder erstattet hydralazin som førstevalg i behandlingen af svær hypertension ved præeklampsi. Labetalol kan administreres både i.v. og peroralt. Labetalol har færre maternelle bivirkninger end hydralazin. Endvidere kan labetalol reducere det intracerebrale perfusionstryk uden samtidig at medføre overperfusion af cerebrum, hvilket kan ses ved andre vasodilatorer. (14) (evidens 1b). Der er beskrevet tilfælde af forbigående neonatal bradycardi i forbindelse med i.v. Labetalol. (15-17)
Nifedipin
Nifedipin er i flere studier vist at være mere effektivt end henholdsvis methyldopa og hydralazin til blodtrykskontrol, og nifedipin øger tillige urinproduktionen såvel præ- som postpartum. (18) (evidens 1b). Endvidere bevirker nifedipin, sammenlignet med methyldopa, en signifikant øgning af det uteroplacentare blood flow og en øget føtal vækst efter flere ugers behandling. (19)
I en randomiseret, dobbeltblind undersøgelse af nifedipine og labetalol blev de to præparater fundet ligeværdige med hensyn til blodtrykskontrol, men nifedipin bevirkede samtidig en signifikant øgning af cardiac index og et fald i den perifere modstand, hvilket ikke sås efter labetalol. (20) (evidens 1b). Øgning af cardiac output og oxygentransport kan mindske organskader hos kritisk syge patienter.
Hydralazin
Hydralazin er ikke længere registreret i DK, men kan anvendes på licens.
Konklusion
Ved metaanalyser er der ikke fundet nogen sikker forskel i effekten af de antihypertensiva, der hyppigst anvendes til behandling af svær hypertension: labetalol, nifedipin og hydralazin. De er alle effektive til blodtrykskontrol, men flere undersøgelser tyder på en mere gunstig effekt af nifedipin på nyrefunktion/urinproduktion, cardiac output og placentakredsløb, og en mere gunstig effekt af labetalol på det cerebrale perfusionstryk. Af disse grunde anbefales såvel nifedipin og labetalol som førstevalgs præparater ved behandling af svær hypertension/præeklampsi.
Monitorering af patienter med svær præeklampsi/eklampsi
Rekommandation
Ante partum monitorering:
Omfanget og hyppigheden af monitoreringen afgøres af de initiale observationer og det kliniske forløb.
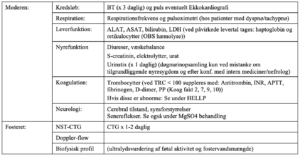
Peri partum monitorering:

Invasiv blodtryksmonitorering bør overvejes ved ustabil hypertension, akut hypertensiv krise, når NIBP-måling er vanskelig (obesitas), samt ved behov for hyppig blodprøvetagning (HELLP).
Brug af centralt venekateter (CVK) eller pulmonalarteriekateter er almindeligvis ikke indiceret. (21) Ekkokardiografi kan være af værdi. (22)
Post partum monitorering:
Fortsat tæt monitorering som ante- og peri-partum, indtil der er tegn på forbedring af kliniske og biokemiske parametre
Baggrund
Formålet med ante-partum monitorering er at observere eventuel progression af tilstanden for at kunne forebygge maternelle komplikationer og for at sikre den føtale trivsel. (3) Undersøgelser har vist, at indføring af standardiserede overvågningsprogrammer for gravide med præeklampsi kan nedsætte maternel morbiditet og mortalitet signifikant pga øget behandlingsintensitet med antihypertensiva, corticosteroider og magnesium. Tiden for indlæggelse til forløsning øgedes samtidig med tendens til forbedret neonatal outcome, der dog ikke var signifikant (23) (Evidens 1b).
Observation af patienter
Der er i de senere år udviklet et scoringssystem, Early Warning Scores (EWS); som kan afsløre udviklingen af livstruende symptomer hos risikopatienter uanset om patienten ligger på stamafdeling eller afdeling med højere monitoreringskapacitet. Scoringsystemet sikrer, at et defineret score udløser handling f.eks lægetilkald, som kan tilpasses den enkelte institution. (24,25) I England har nogle institutioner modificeret scoringssystemet til obstetriske patienter, MEOWS, Modified Early Obstetric Warning Scoring system, for tidligt at kunne diagnosticere livstruende tilstande hos den obstetriske patient og handle rettidigt herpå. (26,27)
Nedenstående observationsskema er et eksempel på early warning scores for den præeklamptiske patient. Kontinuerlige observationer afslører, når enkelte parametre hos patientens forværres, således at terapi kan rettes mod enkelte symptomer, og dermed kan hindre, at patienten når en livstruende tilstand. Eksempelvis O2 –tilskud ved faldende saturation, antihypertensiv behandling ved stigende BT etc.
Early warning scores bør foregå på alle afdelinger og medføre hurtig medicinsk indsats og vurdering af, om patienten kan forblive på stamafdeling eller kræver overflytning til intensiv behandling.
I henhold til observationer rekommanderes at sygeplejerske/jordemoder tilkalder læge hvis patienten scorer en værdi der ligger i det røde område eller 2 i det gule område, se nedenstående skema.
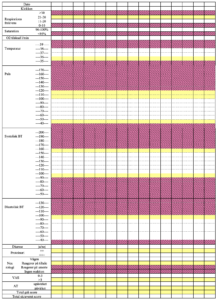
Obstetrisk Early Warning Score – observationsskema (modificeret fra Aberdeen Maternity Hospital)
Læge kontaktes ved 1 kryds i rødt (skraveret) område eller 2 krydser i gult (gråt) område
Væskebehandling
Rekommandation
Ante partum væskebehandling:
- Den totale væskeindgift bør begrænses til 80 ml/time eller 1ml/kg/time
- Væskerestriktion tilrådes for at reducere risiko for overhydrering, bla. lungeødem
- Timediureser bør måles, og der bør lægges blærekateter, når der gives i.v. væske
Peri partum væskebehandling:
- Der tilstræbes 0-balance
- Der gives højst 1000 ml krystalloid
- Blødning > 700 ml bør overvejes erstattet med blodprodukter
- Se i øvrigt under afsnit ”HELLP” og afsnit ”Anæstesi til sectio”
Post partum væskebehandling:
- Tilstræb negativ væskebalance på > 1000 ml/ 24 timer.
- Basalt væskebehov (inklusive peroral og medicin-infusionsvæske) som ante partum: 80 ml/time eller 1 ml/kg/time
- Ved behov for oxytocindrop bør koncentreret opløsning anvendes
- Oliguri er hyppigt forekommende umiddelbart postpartum. Ved oliguri skal hypovolæmi så vidt muligt udelukkes.
- Rutinemæssig brug af furosemid ved oliguri kan ikke anbefales
- Ved urinproduktion < 40 ml/time over 6-8 konsekutive timer eller ved anuri i 2 konsekutive timer kan: Furosemid 5-80 mg i.v. overvejes
- Væskerestriktion skal fortsætte til diuresen er kommet i gang og er sufficient
Baggrund
Generelt er der ikke evidens for effekt af plasma volumen ekspansion for kvinder med præeklampsi. (28) (evidens 1a) eller for effekt af plasma volumen ekspansion for hverken kvinder eller deres børn. (29) (evidens 1a).
Maternel plasma volumen ekspansion havde ingen effekt på den perinatal 1 års overlevelse. (30) (evidens1a) I opgørelser fra UK igennem 20 år har lungeødem været årsag til maternel mortalitet hos kvinder med præeklampsi (31), (evidens IV). I disse opgørelser har aggressiv væskeindgift været hovedårsagen til lungeødem. Rekommandationer om væskerestriktion har siden medført et fald i den maternelle morbiditet og mortalitet som følge af lungeødem ved præeklampsi (32) (evidens IV). (33,34) (evidens II b), (9) (evidens IV). Oliguri er hyppig ved svær præeklampsi. Brun et al (35) fandt i studie at halvdelen af patienter med svær præeklampsi og oliguri responderede på passiv benløft som udtryk for hypovolæmi.
Man er således blevet opmærksom på at patienter med præeklampsi er heterogen gruppe i relation til hydreringsstatus. Hos euvolæme patienter skal væskerestriktion fortsætte, indtil diuresen kommer i gang og er sufficient. Der er ikke evidens for at tilstræbe en timediurese for at forebygge nyresvigt, da nyresvigt sjældent optræder uden samtidig forekomst af HELLP, blødning eller sepsis. (33, 36) Væskebalancen skal derfor nøje observeres, og der skal tilstræbes en negativ balance. (37)
Såkaldt preload før anlæggelse af epidural eller spinal blokade til gravide kvinder er ineffektivt og anbefales derfor ikke (38) (evidens I b). Ved uacceptabelt blodtryksfald anbefales dog vasopressor samt væske i begrænset mængde. (32)
Der findes ingen evidens for hvilken type væske, man bør anvende til præeklampsi patienter. Både albumin og syntetiske kolloider har været diskuteret bredt i litteraturen. (39,40) Hydroxyethyl-stivelser (Voluven®) er kontraindiceret ved kritisk sygdom og/eller nyresvigt, herunder også præeklampsi. (41)
Individualiseret monitorering i form af ekkocardiografi, lungeultralyd og måling af cardiac output kan overvejes ved svær præeklampsi. (42-44)
Forløsning
– Gravide med essentiel hypertension og stabilt blodtryk (< 150/100 mmHg) kan som regel afvente termin, men bør ikke gå over termin grundet risiko for PE-udvikling.
– Gravide med gestationel hypertension og let til moderat præeklampsi overvejes igangsat omkring 37(-38). uge forudsat stabilt blodtryk (< 150/100 mmHg)
– Svær præeklampsi indicerer oftest, og efter uge 32 + 0 altid, forløsning snarest muligt (døgn), når patienten er stabiliseret og under dække af antihypertensiv behandling (se ovenfor). Før GA 34 + 0 bør den gravide om muligt være dækket ind med celeston før forløsningen.
– Hvis BT efter behandling er < 110 mmHg diastolisk og < 160 mmHg systolisk, og der ikke er andre tegn på svær præeklampsi er forløsning ikke umiddelbart indiceret.
– Eklampsi/HELLP indicerer som regel forløsning snarest muligt efter stabilisering (indenfor timer)
– Epidural analgesi anbefales (cave: koagulopati). Koagulationstal taget indenfor 3 timer bør foreligge inden epidural/spinal anlæggelse, der kræver trombocytter > 80 x 109/L. (se under Anæstesi til sectio)
Postpartum håndtering ved svær præeklampsi
– Risiko for postpartum blødning er øget 2-3 gange, derfor anbefales koncenteret Syntocinondrop post partum ved svær præeklampsi.
– Methergin er kontraindiceret
– NSAID bør undlades ved svær præeklampsi, forhøjet creatinin og lave trombocytter
– Varigheden af profylaktisk Magnesium behandling vurderes individuelt, men fortsætter typisk i timerne efter forløsningen og ofte i 24 timer i alt. (se under MgSO4 krampeprofylakse ved præ-eklampsi)
– Peroral antihypertensiv behandling skal fortsætte efter fødslen.
– Overvej tromboseprofylakse (LMWH) til patienten er fuldt mobiliseret (typisk 6 dage eller mere), med mindre der er pågående blødnings risiko/trombocytter <60
– Fjernelse af epiduralkaterter tidligst 12 timer efter sidste LMWH-injektion. Første LMWHinjektion gives tidligst 4 timer efter fjernelse af epiduralkateteret forudsat trombocytter er > 60.
HELLP
Definitioner:
HELLP:
En speciel form af svær præ-eklampsi med en triade bestående af H = ”hemolysis” defineret som mikroangiopatisk hæmolytisk anæmi , EL = leverpåvirkning med ”elevated liver” enzymer, og LP = lavt pladetal =”low platelets”. De fleste, men ikke alle, har samtidig gestationel hypertension og/eller proteinuri. (45,46) Patofysiologien er ikke helt afklaret. (1)
H = Hæmolyse
- Hæmolyse (Haptoglobin < 0,3 g/l = 3 µmol/L, LDH > 600 U/L, bilirubin > 24 µmol/L)
- S-Haptoglobin referenceområdet varierer afhængig af analysemetode)
EL = Forhøjede leverenzymer
- S-ASAT eller S-ALAT > 100 U/L
LP = Thrombocytopeni
- B-trombocytter < 100 x 109 /L
- Class 1 HELLP: trombocytter < 50 x 109 /L (46)
- Class 2 HELLP: trombocytter 50-100 x 109 /L (46)
Partiel HELLP:
– Svær præ-eklampsi plus en eller to af ovenstående variable i triaden. (45,47)
Kliniske tegn:
De kliniske tegn kan være til stede flere timer før laboratorieværdierne ændrer sig.
– Smerter og/eller ømhed i epigastriet eller under højre cuvertur
– Kvalme og/ eller opkastning
– Almen sygdomsfølelse, influenzalignende symptomer
– Hovedpine Synsforstyrrelser
– Trombocytopene blødninger
– Hypertension
– Proteinuri
Behandling ved HELLP syndrom
– Vurdering af sværhedsgrad med henblik på afslutning af graviditeten
– Antihypertensiv behandling (se afsnit om antihypertensiv behandling).
– Væske restriktion som til præeklampsi (se side 14)
– Magnesiumsulfat (se under Eklampsi)
– Kortikosteroider
- Kortikosteroider (Dexamethasone) er ikke rutinemæssigt indiceret til behandling af HELLP. (A)
- Kortikosteroider kan overvejes ved svær HELLP. Initial dosering – Dexamethason 10 mg x 2 i.v. (D)
- Korticosterioder er indiceret ved exacerbation af lupus erythematosus disseminatus og lupus nefrit ikke kan udelukkes
– Trombocyttransfusion
- Profylaktisk trombocyttransfusion er ikke indiceret ved thrombocyttal over 50 x 109 /L (C)
- Trombocyttransfusion bør overvejes ved trombocyttal under 50 x 109
- /L i tilfælde hvor der er tegn på koagulopati eller hurtigt faldende trombocytal (D)
- Profylaktisk thrombocyttransfusion er indiceret ved trombotyttal under 20 X 109 /L umiddelbart før kejsersnit (D)
- Profylaktisk trombocyttransfusion bør kraftigt overvejes ved trombocyttal < 20 x 109
- umiddelbart før vaginalforløsning (D)
- Om muligt, bør trombocyttranfusion udføres vejledt af TEG/ROTEM
- Trombocyttransfusion er kontraindiceret ved TTP medmindre, der er livstruende blødning (50).
– Plasmapherese
- Der er utilstrækkelig evidens for at rekommandere plasmapherese ved HELLP
- Plasmapherese kan overvejes ved refraktær HELLP
- Plasmapherese er indiceret når TTP og Catastropic Antiphospolipid Syndrome (CAPS) ikke kan udelukkes.
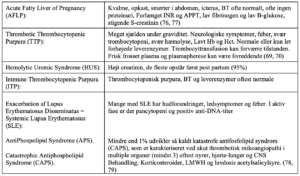
Differentialdiagnoser:
– Acute fatty liver of pregnancy (AFLP)
– Thrombotic thrombocytopenic purpura (TTP)
– Hemolytic uremic syndrome (HUS)
– Immune thrombocytopenic purpura (ITP)
– Exacerbation af systemisk lupus erythematosus (SLE)
– Antiphospolipid syndrome (APS)
– Cholecystitis
– Ulcus
– Hepatitis
– Pancreatitis
Baggrund
Prevalæns
0,5-0,9 af alle graviditeter og 10-20 % ved svær præeklampsi (46), 2/3 af tilfældene opstår ante-partum, 1/3 opstår postpartum. (48)
Definition og diagnose
HELLP er et syndrom med hæmolyse, eleverede leverenzymer og trombocytopeni. (49) Der er imidlertid ingen international konsensus om de eksakte diagnostiske kriterier (se under klassifikation). (45, 50) Hyppigst anvendes LDH > 600 U/l (eller Bilirubin > 1,2 mg/dl ~ > 20 µmol/l), schistocytter i blodudstrygning, ASAT > 100 U/l og thrombocytter < 100 x 109 /l som kriterier for diagnosen. (47, 51) S-haptoglobin under reference områdets nedre grænse er en sensitiv markør for hæmolyse. (52,53)
Patofysiologi
Tilstanden karakteriseres af endothelcelleskade i leveren, thrombocytaktivering, thrombocytaggregation og forbrug, periportal nekrose, fokal parenkymatøs nekrose, fokale blødninger, større intrahepatiske eller subkapsulære hæmatomer og endelig leverruptur med blødningsshock (45,50).
Klassifikation:
Tennesee klassifikationen: Inddeling i komplet og partiel HELLP. Komplet HELLP: alle tre kriterier (hæmolyse, forhøjede leverenzymer og trombocytopeni) opfyldt. Partiel HELLP: en eller to af ovenstående kriterier. (47)
Mississippi klassifikationen: Inddeling i 3 sværhedsgrader efter trombocytnadir: Class I: < 50 x 109/L, Class II: 50-100 x 109 /L og Class III: 100-150 x 109 /L (54).
Graden af trombocytopeni er korreleret til øget incidens af maternel mortalitet og morbiditet. (54-56) Thrombocyttal og enzymkoncentrationer er dog ikke uafhængige risikofaktorer. Lav gestationsalder, ascites, abruptio placenta, præeklampsi i tidligere graviditet, forekomst og grad af kliniske symptomer så som hovedpine, synsforstyrrelser epigastrielle smerter og kvalme/opkastning er betydende risikofaktorer for alvorlige komplikationer. (57-59)
Klinik
Kliniske symptomer er smerter under højre kurvatur eller i epigastriet, ofte ledsaget af kvalme og opkastninger efter et par dage med almen utilpashed. Hos 15% af patienterne er der ikke hypertension eller signifikant proteinuri. Differential-diagnostisk kan dette give vanskeligheder, da tilstanden kan blive fejltolket som gastroenterologisk lidelse eller galdevejslidelse. Det kliniske forløb er uforudsigeligt, og kan udvikle sig hurtigt med faldende trombocytter og stigende levertal, eller tilstanden kan holde sig nogenlunde stabil.
Dokumentationen herfor er generelt dårlig med evidens niveau III og IV.
Hos gravide med hypertension, hvor man mistænker præeklampsi, men hvor der ikke er mistanke om blødning, kan man som screening nøjes med trombocytter og LDH (60) (evidens III).
Behandling
Behandlingsanvisninger findes i 3 oversigtsartikler. (45,46,50)
Kortikosteroider
Et Cochrane review fra 2010 konkluderer, at der endnu er der utilstrækkelig evidens for at rutinemæssig administration af kortikosteroider til patienter med HELLP forbedrer klinisk vigtige outcome variable. Administration af kortikosteroider kan være indiceret i kliniske situationer, hvor en øgning af thrombocyttallet vurderes at være klinisk fordelagtig. (evidens I) (61)
NICE kliniske guideline fra 2015 rekommanderer ligeledes, at dexamethason ikke skal anvendes til behandling af HELLP. (evidens I) (3) Anvendelse af kortikosteroider ved HELLP er kontroversiel. Rutinemæssig behandling med kortikosteroider anbefales og anvendes fortsat af nogle. (46) Der foreligger ingen dosis-response studier. Dexamethason (Fortecortin®) 10 mg + 10 mg + 5 mg + 5 mg intravenøst med 12 timers interval er anvendt i flere studier (62-65). Nogle anvender en højere dosering ved specielt svær HELLP. (50)
Trombocyttransfusion
Grænsen for profylaktisk trombocyttransfusion til patienter med malign hæmatologisk lidelse er 10 x 109 /L. (66) British Committee for Standards in Haematology anbefaler at trombycyttallet ved akut blødning holdes over 50 x 109/l, men angiver ingen grænse for profylaktisk trombocyttransfusion ved abdominal kirurgi. (48) Hos patienter med HELLP er der i forbindelse med fødsel og kejsersnit øget risiko for post-partum blødning ved trombocyttal < 40 x 109/l. (67)Der findes ingen prospektive randomiserede studier over effekten af profylaktisk trombocyttransfusion forud for kejsersnit eller vaginal forløsning. Trombocyttransfusion anbefales før kejsersnit ved trombocytter < 20.000 x 109 /L og bør stærkt overvejes før vaginal forløsning ved trombocytter < 20.000 x 109/L. (4) I en retrospektiv undersøgelse omfattende 132 patienter med klasse 1 HELLP og 160 patienter med klasse 2 HELLP fandt Roberts et al. ingen effekt af profylaktisk trombocyttransfysion til HELLP patienter med trombocyttal < 40 x 109/l. (67) I en anden opgørelse over 46 Class 1 HELLP patienter, hvor 20 patienter fik profylaktisk trombocyttransfusion før kejsersnit eller vaginal forløsning observeredes hurtigere recovery i gruppen, der ikke fik trombocyttransfusion. (68)
Plasmaferese
Der er utilstrækkelig evidens for at rekommandere plasmapherese ved HELLP. (3)Plasmapherese er indiceret, når TTP ikke kan udelukkes, (69, 70) og kan overvejes ved refraktær HELLP (71, 72) og ved Catastrophic Antiphospholipid Syndrome (CAPS). (73)
Differentialdiagnoser
En række medicinske tilstande har et symptom-sammenfald med HELLP og svær præeklampsi. Endvidere kan de samme tilstande kompliceres med overbygget HELLP/Præeklampsi. (74, 75)
Forlængelse af graviditeten
Ved HELLP er der ikke dokumentation for, at forlængelse af graviditeten ud over 48 timer, forbedrer barnets prognose. (50) I enkelte tilfælde er der observeret spontan remission af sygdommen. (80)
Morbiditet og mortalitet
Svær morbiditet ses med en frekvens på helt op til 45 %, specielt når HELLP opstår postpartum (11) (evidens III). De hyppigste komplikationer er DIC (21 %) og placenta løsning (16%). Den alvorligste komplikation er leverruptur (1 %), hvor både den maternelle og føtale mortalitet er > 50 %. Eklampsi er ofte associeret med HELLP syndrom. Tilstanden kan forværres efter forløsningen og topper ofte 24-48 timer efter forløsningen. (81) Tilstanden debuterer post-partum i 15-25 % af tilfældene.
Eklampsi
Rekommandation
Definition
- Universielle kramper under graviditet, fødsel eller indenfor 4 uger post-partum hos patienter uden anden kendt årsag. (6)
Behandling
- ABC (Airway, Breathing, Circulation) (6,81) (C)
- Tilkald hjælp.
- Hindre at patienten kommer til skade o Lejring i venstre sideleje. o Fri luftvej, ilt, vurder vejrtrækning, evt. tungeholder, evt. sugning i oropharynx.
- Bliv hos patienten, beskyt mod traumer.
- Etabler i.v. adgang.
- Bolus og vedligehold: intravenøs MgSO4 (se MgSO4 krampeprofylakse ved præ-eklampsi skema nedenfor) (3) (A)
- Hvis anfaldet ikke kan brydes med MgSO4, intuberes patienten efter anæstesiindledning som angivet under generel anæstesi til sectio. (C)
- Antihypertensiv behandling ved BT> 150/100 mmHg. Mål Systolisk BT < 150, Diastolisk BT 80-100 mmHg (3) (C)
- Væskerestriktion: Total væsketilførsel (peroral + intravenøs) begrænses til max 80 ml/time eller 1 ml/kg/time. (82) (C)
- Laktatacidose efter generaliserede krampeanfald er selvlimiterende og kræver normalt ikke behandling med natriumbikarbonat med mindre forløsning er nært forestående. (83) (C)
Monitorering – udredning
- Kontinuerlig pulsoximetri (SpO2), CTG, BT, timediurese.
- Kontroller syrebase status. Blodtype og forlig, Hb, thrombocytter, INR, Protrombin tid (Koagulationsfaktor 2,7,10), APTT, S-Na, S-K, S-Creatinin, S-LDH, S-ALAT. Gentag efter 6 timer.
- Cerebral CT/MR-scanning er indiceret ved debut > 48 timer post-partum, ved fokalneurologiske udfald, vedvarende bevidsthedspåvirkning, Glascow coma scale score <8, eller ved atypisk præsentation. (6,84,85)
- Den urolige, hvileløse patient (”restless eclamptic”) som er uden neurologiske udfald, ikke hypoksisk eller hypokapnisk er ikke i behov af videre billeddiagnostisk udredning, men bør mistænkes for cerebralt ødem.
Differentialdiagnoser
- Cerebral
- epilepsi
- blødning
- tumor
- aneurysme
- A-V malformation
- angiom
- arteriel emboli eller thrombose
- venøs thrombose
- vasculitis
- hypoxisk iskæmisk encephalopati eller posterior leukoencephalopati
- hypertensiv encephalopati
- Hypoglykæmi
- Hyponatriæmi
- TTP
- Antiphospholipid syndrome
Forløsning efter eklamptisk anfald
- Forløsning: Først når moderen er stabil.
- Umiddelbart efter det eklamptiske anfald vil der ofte være føtal bradykardi. Dette er normalt ikke indikation for umiddelbar forløsning ved kejsersnit. (2,86) Vedvarende føtal bradykardi eller sene decellerationer ud over 10-15 min efter krampeanfaldet kan være tegn på abruptio og intrauterin asfyksi og indicere akut forløsning. (6) (C)
- Ved præmaturitet kan man afvente Celeston virkning (hvis tilstanden er stabil)
- Vaginal forløsning er ikke kontraindiceret
- Kontinuerlig CTG overvågning
- Epidural analgesi (OBS koagulopati; se under Anæstesi til sectio)
- Sectio i spinal anæstesi (OBS koagulopati; se under Anæstesi til sectio)
MgSO4 krampeprofylakse ved præ-eklampsi
- MgSO4 er førstevalgs præparat til krampeprofylakse. (A).
- Diazepam eller phenytoin bør ikke anvendes. (A)
Indikation
MgSO4 bør anvendes ved svær gestationel hypertension eller svær præeklampsi når fødsel kan forventes indenfor 24 timer. (3)
Magnesium gives ved:
- HELLP
- Svær præeklampsi med ukontrollabelt BT og/eller cerebralia og/eller hyperrefleksi
- Eklampsi
Kontraindikation
- Absolut kontraindiceret ved myastenia gravis, myastent syndrom og ved levercoma med nyresvigt
- Relativt kontraindiceret ved nyreinsufficiens (S-Creatinin > 300 µmol/l eller anuri). Kontinuerlig dialyse sidestilles med normal nyrefunktion
- Mb. Cordis, specielt AV-blok
Dispenseringsform
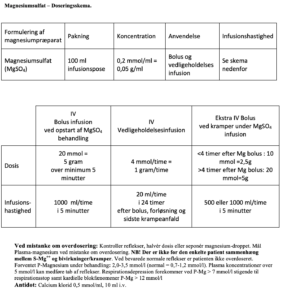
Til I.V. administration anvendes færdigblandet infusionsopløsning i 100 ml poser (C)
- Koncentration: Magnesiumsulfat 0,2 mmol/ml ≈ 0,05 g/ml 100 ml indeholder: 20 mmol Magnesium = 4,93 g Magnesiumsulfatheptahydrat
Dosering (samme til både eklampsi og til profylaktisk behandling)
- Bolus
- MgSO4 20 mmol = 5 g i.v. over minimum 5 min (100 ml= infusionshastighed 1000 ml/time)
- Bivirkninger: Ca 1/3 får: Flushing, svedtendens, kvalme, fornemmelse af ’en tung dyne bliver placeret over en’
- Vedligeholdelse
- Kontinuerlig i.v. MgSO4 infusion 4 mmol/time = 1 g/time (20 ml/time af den færdigblandede infusionsopløsning i 100 ml bags) i 24 timer efter administration af bolus, forløsning eller sidste krampeanfald
- Infusionshastigheden halveres ved sløve patellarreflekser, respirationsfrekvens < 16/minut eller oliguri, <100 ml/4 timer
- Infusionen stoppes ved bortfald af patellarreflekser, eller ved respirationsinsufficiens, SpO2 < 92%. Når patellarreflekserne atter er til stede og respirationen sufficient, fortsættes med halveret infusionshastighed
Monitorering (hver 2. time)
- Timediurese (>25 ml/t)
- Respirationsfrekvens (hver time)
- Patellar- eller biceps reflekser kontrolleres hver 2 time. Ved bevarede senereflekser forekommer overdosering ikke.
- S-Mg++ måles ved mistanke om overdosering eller hvis reflekser og respiration ikke kan vurderes p.g.a. spinal/epidural anæstesi eller respiratorbehandling. Der tilstræbes serum koncentration på 2 – 3,5 mmol/l (normal = 0,7 – 1,2 mmol/l)
Antidot
- Calciumklorid (0,5 mmol/l) 5-10 ml i.v. eller Calcium Sandoz (0,22 mmol/ml) 10-20 ml i.v. Dette ophæver også den krampehæmmende effekt
Baggrund
Krampeprofylakse:
Magnesiumsulfat MgSO4 er førstehåndspræparat til behandling af patienter med eklampsi (87-90) (evidens 1).
Magnesiumsulfat reducerer risikoen for eklampsi hos patienter med præeklampsi. Magnesiumsulfat MgSO4 er førstehåndspræparat til krampeprofylakse hos patienter med præeklampsi (91,92). (evidens 1b).
NNT for at hindre et eklamptisk anfald hos patienter med svær præeklampsi er 63 (95% CI 38-181). NNT for at hindre et eklamptisk anfald hos patienter med let til moderat præeklampsi er 109 (95% CI 72-225) (92). MAGPIE undersøgelsen omfattede 10.141 patienter fra 33 lande. Mere end halvdelen af patienterne kom fra lande, hvor den perinatale mortalitet er over dobbelt så stor som i Danmark. Der indgik kun 1.560 patienter fra lande med en perinatal mortalitet, der er sammenlignelig med den danske. Spørgsmålet er derfor, i hvilken udstrækning resultaterne fra MAGPIE er repræsentative for danske patienter. Som helhed fandtes der ingen signifikant profylaktisk effekt af magnesium i lande med en lav perinatal mortalitet. Dette kan dog skyldes, at flere patienter med truende præeklampsi i netop disse lande blev ekskluderet fra MAGPIE, idet krampeprofylakse med magnesiumsulfat allerede var en etableret behandling til patienter med truende eklampsi.
Der er enighed om, at patienter, der har haft et eklamptisk anfald, skal behandles med magnesiumsulfat. Der er imidlertid ingen konsensus om indikationen for magnesiumsulfat til præeklampsi-patienter, der ikke har haft kramper. Da den største risikoreduktion ses hos patienter, som både opfylder kriterierne for præeklampsi og truende eklampsi, (92) bør krampeprofylakse med magnesiumsulfat som minimum administreres til denne gruppe patienter.
Magnesiumprofylakse anbefales til alle med svær præ-eklampsi/eklampsi, men ikke rutinemæssig profylakse til patienter med let-moderat præeklampsi Det optimale starttidspunkt for MgSO4 til patienter med præ-eklampsi er ikke fastlagt. (93).
MgSO4 administration og dosering:
Magnesiumsulfat kan administreres enten intravenøst eller intramuskulært.
Doseringen for det intravenøse regimen i eklampsi multicenterstudiet ”the Collaborative Eclampsia Trial fra 1995” (90) var 4-5 g MgSO4 i.v. over 5 min. efterfulgt af 1 g/time i 24 timer medens det for det intramuskulære regimen var 4 g i.v. over 5 min. plus 5 g i.m. i hver glutealmuskel efterfulgt af 5 g i.m hver 4. time
Doseringen for det intravenøse regimen i præ-eklampsi multicenterstudiet ”the MAGPIE Collaborative Trial Group fra 2002” (94) var 4 g MgSO4 iv over 10-15 min. efterfulgt af 1 g/time i 24 timer medens det for det intramuskulære regimen var 4 g i.v. over 5 min. plus 5 g i.m. i hver glutealmuskel efterfulgt af 5 g i.m hver 4. time.
I begge studier blev tilbagevendende kramper behandlet med MgSO4 2-4 g i.v. over 5 min.
Doseringen er arbitrært valgt og det intravenøse regimen stammer fra Zuspan et al. (95) medens det intramuskulære regimen stammer fra Pritchard et al. (96) Der er ikke evidens for at en højere dosering, i.e. 2 g/time, som anbefalet af BM Sibai (97), er mere effektiv.
NICE clinical guideline 107 (3) anbefaler det intravenøse regimen som anvendtes i ”the Collaborative Eclampsia Trial fra 1995” (90): MgSO4 i.v. bolus 4 g over 5 min efterfulgt af MgSO4 infusion 1 g/time i 24 timer. Kramper under MgSO4 infusion behandles med ekstra MgSO4 i.v. bolus 2-4 g over 5 min.
Den optimale varighed af magnesiumsulfatprofylakse er ikke undersøgt. Anbefalingen at fortsætte med magnesiumsulfat infusion i 24 timer efter fødslen er derfor rent arbitrær. Mindre studie har undersøgt 24 og mod 12 timer, med 60 kvinder med svær præeklampsi i hver gruppe. Ingen fik eklamptisk anfald (98).
I et observationelt studie med 503 patienter er følgende kriterier blevet anvendt til at seponere infusion før 24 timer post-partum: Fravær af persisterende hovedpine, fravær af synsforstyrrelser, fravær af epigastrielle smerter, mere en halvdelen af post-partum blodtryksmålinger < 150/110 mmHg, ingen indikation for ekstra blodtryksmedicin indenfor de sidste 2 timer (indikation: systolisk BT ≥ 160 mmHg eller diastolisk BT ≥ 110 mmHg), og spontan diurese > 100 ml/time i ≥ 2 timer post-partum. Infusionen blev genstartet, hvis blodtrykket steg til > 160/110 mmHg med samtidig forekomst af hovedpine eller synsforstyrrelser. Infusionen blev genstartet hos 7,6% af patienterne. Ingen fik kramper (99). I en randomiseret undersøgelse med inklusion af 98 patienter, hvor man sammenlignede 24 timers infusion med seponering af infusionen ved spontane diureser > 100 ml/time i over 2 konsekutive timer, fandtes der ingen forskel i kliniske eller laboratoriemæssige parametre (100). Ingen af studierne havde dog tilstrækkelig styrke til at afgøre om tidligere seponering end 24 timer post-partum øgede forekomsten af kramper.
Der er rapporteret flere utilsigtede hændelser med fejlblanding af infusionsopløsning og med frit indløb af MgSO4 fra 500 ml bags. (101,102) Anvendelse af færdigblandede infusionsopløsninger i 100 ml bags mindsker sandsynligheden for såvel fejldispensering som fejladministration.
Til i.v. administration anvendes færdigblandet infusionsopløsning i 100 ml bags.
Koncentration: Magnesiumsulfat 0,2 mmol/ml ≈ 0,05 g/ml
100 ml indeholder: 20 mmol Magnesium = 4,93 g Magnesiumsulfatheptahydrat
MgSO4 virkningsmekanisme:
Ætiologien til eklampsi og magnesiumsulfats virkningsmekanisme er fortsat uklar. Teoretisk kan magnesiumsulfat virke anticonvulsivt via cerebral vasodilatation, NMDA-receptor blokade og reduceret Ca2+-induceret celleskade ved iskæmi (103-107).
Frisætningen af von Willebrand faktor er øget ved HELLP og samtidig ses en formentlig konsumptionsbetinget reduktion af ADAM-TS13 aktiviteten. (ADAM-TS13 enzymet spalter ULVWF) (108) Magnesium hæmmer trombocytaggregationen, mindsker frigørelsen af Ultra Large von Willebrand Faktor (ULVWF) og øger effekten af ADAM-TS13. (109) Magnesiumsulfatinfusion vil således teoretisk have en gavnlig effekt på trombocytopenien, iskæmien og trombosetendensen ved HELLP. Dette er dog endnu ikke undersøgt i randomiserede studier, men omvendt er der et teoretisk grundlag for at forsætte magnesiuminfusion indtil trombocyttallet er sikkert stigende.
MgSO4 interaktion:
MgSO4 har en meget kraftig potenserende virkning på non-depolariserende muskel-relaksantia. (110,111) Ved anvendelse af non-depolariserende muskel-relaksantia bør den neuromuskulære transmission monitoreres. Der er risiko for recurarisering ved injektion af MgSO4 efter fuld recovery/revertering af non-depolariserende neuromuskulær blokade (112). Der er ingen potenserende effekt på suxamethonium blok, hvor MgSO4 tværtimod har en antagonistisk effekt (113).
MgSO4 bivirkninger:
- Kvalme, opkastning, varmefølelse, flushing, kortvarigt blodtryksfald (114)
- Virker afslappende på uterus (tocolytisk) (115)
- Hæmmer de kompensatoriske mekanismer ved blødningsforårsaget hypovolæmi (116)
- Passerer placentabarrieren. Reduceret variationsbredde på CTG (117). Udskilles langsomt hos den nyfødte
- Symptomatisk hypocalcæmi (118)
- Respirationsdepression (92)
- Lungeødem (119)
MgSO4 komplikationer ved overdosering:
- Somnolens, dobbeltsyn, utydelig tale (114)
- Respirationsdepression (114,120)
- Neuromuskulært blok (110,112,113,121)
- Kardiale arythmier, ledningsforstyrrelser, hjertestop (120,122)
MgSO4 kinetik:
Cirka 40% af plasmamagnesium er proteinbundet. Magnesium passerer hurtigt blod-hjernebarrieren med ekvillibrering indenfor 2-3 timer. (123)
Magnesium reabsorberes i de renale tubuli ved aktiv transport med et transportmaksimum lige over den normale plasmakoncentration på 1,1 mmol/l. Som konsekvens heraf er der ved normal diurese en hurtig udskillelse af overskydende magnesium. Eliminationshalveringstiden ved normal nyrefunktion af henholdsvis total magnesium og ioniseret magnesium er 707 ± 160 minutter vs. 313 ± 29 minutter. (124)
MgSO4 monitorering:
Der findes ingen konsensus vedr. monitoreringsniveau under behandling med magnesium.
The Royal College of Obstetricians and Gynaecologists anbefaler regelmæssig kontrol af diurese, maternelle reflekser, respirationsfrekvens og iltmætning, men angiver intet om hyppigheden af ovennævnte kontroller. (82)
Yorkshire gruppen foreskriver kontinuerlig pulsoximetri, timediurese, respirationsfrekvens hver time og dybe senereflekser. (125).von Dadelszen et al foreskriver ligeledes kontinuerlig pulsoximetri, timediurese, respirationsfrekvens hver time, dybe senereflekser hver 4. time og Glasgow coma score hver 4. Time. (6)
Patienterne i MAGPIE studiet blev monitoreret med timediurese og dybe senereflekser og respirationsfrekvens hver 30 minut. Måling af S-Mg2+ var ikke påkrævet i MAGPIE studiet. (92)
Normal total S-Mg2+ er 0,75-1,0 mmol. Terapeutisk total S-Mg2+ angives oftest som 2-3,5 mmol/l. (126) Der er imidlertid ingen videnskabelige undersøgelser, som har sammenholdt magnesiumkoncentration med risikoen for eklampsi, og der er således ingen dokumentation for den angivne terapeutiske koncentration. Ioniseret magnesium, som er den aktive form, udgør kun ca. halvdelen af total-magnesium i serum. Der er dårlig korrelation mellem ioniseret magnesium og total magnesium i det terapeutiske område. (124)
Pritchard angiver, at patellarreflekserne forsvinder ved total S-Mg2+ > 4-5 mmol/l, respirationsdepression optræder ved S-Mg2+ > 5,5 mmol/l og at respirationsstop forekommer ved S-Mg2+ > 6,5 mmol/l. (127)
Forløsning:
Umiddelbart efter det eklamptiske anfald vil der ofte være fosterbradykardi. Dette er normalt ikke indikation for umiddelbar forløsning ved kejsersnit. (1,86) Et eklamptisk anfald udelukker ikke senere vaginal forløsning under krampeprofylakse med MgSO4. (127) Forløsning indenfor 2-4 timer efter krampeanfaldet anbefales, idet morbiditet og mortalitet øges ved længere forløsningsinterval. (81)
Anæstesi til sectio
Rekommandation
Før anæstesi
- Det tilstræbes hvis muligt at stabilisere patientens tilstand inden indledning af anæstesi
- Et overordnet behandlingsmål er blodtryk <150/100mmHg
- Ved eklampsi skal magnesiuminfusion være opstartet
- Ved svær præ-eklamsi bør opstart af magnsesiuminfusion overvejes. Se afsnit om Magnesiuminfusion
- Luftveje og intubationsforhold skal vurderes, specielt med henblik på hæmatom i tungen og ødem i ansigt, tunge, uvula, pharynx og larynx
- Ved svær præ-eklampsi bør der foreligge blodprøvesvar på Hb, elektrolytter, koagulationsstal, samt BAC/BAS test
Anæstesivalg til sectio – Se DASAIM rekommandation: Anæstesi til kejsersnit, 2014
- Regional anæstesi bør anvendes, medmindre der er kontraindikationer
- Spinal anæstesi er en hurtig og sikker anæstesimetode ved præ-eklampsi
- Spinal anæstesi eller kombineret spinal-epidural anæstesi (CSE) er førstevalg til patienter, der ikke i forvejen har et epiduralkateter
- Epidural anæstesi anvendes, når patienten har en velfungerende epidural analgesi
- Generel anæstesi kan vælges ved grad 1 sectio, manglende/utilstrækkeligt anslag af regional anæstesi, påvirket bevidsthedsniveau, eller når der er kontraindikationer mod regional anæstesi
Kontraindikationer mod regional anæstesi
• Ukorrigeret hypovolæmi • Påvirket koagulation • Anbefalede grænseværdier for anlæggelse af spinal og epiduralkateter:
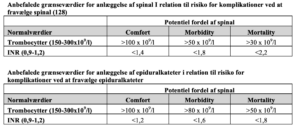
- Ved ustabile tilstande bør blodprøverne (trombocytterne) ikke være over 3 timer gamle (C)
Generel anæstesi:
- Der bør vælges mindre trakealtube end normalt for størrelse og vægt (B)
- Hjælp og utensilier for håndtering af vanskelig intubation skal være til stede (C)
- Perioperativ blodtryksstigning, øger risikoen for cerebral blødning, cerebralt ødem og lungeødem, og skal så vidt muligt undgås (C)
- For at modvirke blodtryksstigning ved intubation gives Rapifen® (Alfentanil) 15-30 µg/kg i.v. (1-2 mg til 70 kg patient) eller Ultiva® (Remifentanil 1 µg/kg) umiddelbart før anæstesiindledningen. Alternativt gives Rapifen® (Alfentanil) 7,5-15 µg/kg i.v. efterfulgt af magnesiumsulfat 30 mg/kg givet i.v. over 1 minut (A)
- Pædiater/jordemoder informeres om, at der er givet opioid før barnets fødsel
- Under pågående magnesiuminfusion skal non-depolariserende blokkere gives i reduceret dosis (75% af sædvanlig dosis) og under neuromuskulær monitorering, idet magnesium potenterer effekten af alle nondepolariserende neuromuskulære blokkere (B)
- God analgesi skal sikres inden vækning
Væskestatus og blodtab:
- Peroperativt tilstræbes 0-balance, mens der postoperativt sigtes mod et væsketræk, se afsnit om væskebehandling
- Der gives højst 1000 ml krystalloid peroperativt. Ved blødning > 700ml overvejes blodprodukter se afsnit om væskebehandling
Blodtryksregulering:
- Målet under anæstesien er uændret BT eller et mindre fald
- Hypotension: Ved middelblodtryk (MAP) < 100 mmHg eller fald i MAP på > 20 % korrigeres med metaoxedrin eller efedrin i reducerede dosis
- Ved blodtryksstigning trods adækvat anæstesi kan der gives Trandate® (Labetalol) i.v. 10 mg ad gangen, se afsnit om hypertension (B)
Uterotonika:
- Syntocinon® skal gives langsomt (max 1 IE/minut) idet hurtig indgift kan give massivt blodtryksfald (A)
- Methergin® er kontraindiceret ved præ-eklampsi (A)
- Cytotec® og Prostinfenen® kan anvendes i sædvanlige doser og på sædvanlige indikationer(A)
Blødning:
- Ved trombocyttal < 20 x 109 /L gives trombocytkoncentrat umiddelbart før/ under operationen (C)
- Ved vedvarende blødning stiles mod trombocyttal på > 50 x 109 /L (C)
- Ud over dette anbefales kontrol af koagulationsstaus med TEG/ROTEM ved øget blødningstendens
Postpartum:
- Epiduralkateteret må som hovedregel først fjernes når kriterierne herfor er opfyldt (normal koagulation)
Baggrund
Anæstesivalg:
Spinalanæstesi anses som førstevalg hos patienter som ikke i forvejen har et epiduralkateter. (129-136) Blodtryksfald og/eller behov for vasopressor ved spinalanæstesi til kejsersnit er langt mindre udtalt hos patienter med præ-eklampsi end hos raske gravide. (129,130,137,138)
Koagulationsforstyrrelser:
Vedrørende indikationer og kontraindikationer for regional anæstesi og analgesi hos patienter i antikoagulationsbehandling eller med koagulationsforstyrrelser henvises til SSAI´s rekommandation: Neuraxial blockade in the anticoagulated patient. (128) I denne rekommandation har man søgt at vurdere risikoen for intraspinal blødning overfor risikoen ved generel anæstesi. Der skelnes således i mellem om analgesi/anæstesi er indiceret alene til smertelindring, f.eks. postoperativt eller til fødsel (indikation: comfort), eller som et (skønnet) livreddende alternativ til general anæstesi, f.eks ved anæstesi hos en patient med høj risiko for vanskelig intubation (indikation: mortalitet) (evidens IV)
Regional anæstesi til sectio:
Spinal anæstesi er den foretrukne anæstesi til sectio. I de seneste år er der udgivet flere retrospektive undersøgelser, der sammenligner spinal anæstesi med epidural anæstesi, samt enkelte randomiserede studier der alle viser, at spinal er en hurtig og sikker anæstesimetode også ved præeklampsi (135,136,139) (evidens 1b). Flere undersøgelser viser, at spinal anæstesi sjældnere forårsager hypotension hos kvinder med svær præeklampsi end hos raske gravide (129,130,136,138) (evidens 1b).
Regional anæstesi ved eklampsi:
Der findes få studier vedrørende regional anæstesi til patienter med eklampsi. I et retrospektivt studie af 533 kvinder med eklampsi blev 66 (12,4 %) beskrevet som stabile, vågne og koopererende i magnesiumsulfat og antihypertensiv behandling, og med normal FHR. Syvogtredive fik epidural anæstesi, 2 spinal og 27 generel anæstesi. Der var ingen forskel i det maternelle eller neonatale outcome imellem de forskellige anæstesiteknikker (140,141) (evidens III).
Kombineret spinal/epidural (CSE) anæstesi:
Kombinationen af en mindre initiel dosis lokalanæstesi/analgesi givet spinalt, og epidural kateteret anlagt til escape med mulighed for at supplere anæstesien. Teknikken har mest været anvendt til fødselsanalgesi, hvor der opnås hurtig smertelindring. Metoden har været kritiseret for, at epiduralkateteret ikke kan testes initialt, hvilket kan være et problem, hvis det skal anvendes til sectio. Der er dog beskrevet flere studier, hvor CSE er anvendt med god effekt hos kvinder med præeklampsi (132, 142) (evidens IIb).
Epidural anæstesi: Brugen af adrenalin i epiduralkateteret har været diskuteret og der er undersøgelser, der viser fald i den uteroplacentare gennemblødning ved anvendelse af bupivacain med adrenalin hos kvinder med præ-eklampsi. Der foreligger kasuistiske meddelelser om hypertensive kriser hos kvinder med præ-eklampsi med korrekt placeret epiduralkateter (143-145).
Generel Anæstesi: Generel anæstesi er hos alle gravide forbundet med en større maternel risiko end regional anæstsi (146). Et studie fra 2010 viser, at generel anæstesi til præeklampsi patienten er forbundet med en højere risiko for cerebrale infarkter end ved anvendelse af regional anæstesi. (147) Der kan dog være indikation for at vælge generel anæstesi: koagulations forstyrrelser, grad 1 sectio, manglende anslag af regional anæstesi, mistanke om forhøjet intrakranielt tryk m.m. Generel anæstesi til patienter med præ-eklampsi og eklampsi er forbundet med specielle risici: De øvre luftveje er generelt mere snævre (148), og ødem i ansigt, tunge, uvula, pharynx og larynx og hæmatom i tungen kan udvikles/forværres over kort tid og vanskeliggøre laryngoskopi og intubation og i værste fald lede til obstruktion og være årsag til mislykket intubation (149-153). Udover den vanlige vurdering af intubationsforhold er det derfor vigtigt at være opmærksom på tegn til ødem i de øvre luftveje (ændret/grødet stemme, hæshed, stridor) og vælge en tyndere tube og have utensilier og hjælp på stuen til at håndtere en vanskelig luftvej (148,154). I svære tilfælde bør vågen fiberoptisk intubation overvejes. Eftersom larynxødem kan opstå per-operativt anbefales det at inspicere larynx, alternativt at sikre sig, at der er luftpassage forbi tuben inden extubation (150,155). I forbindelse med in- og extubation og operationsstart er der risiko for alvorlig stigning i det arterielle systemblodtryk, det pulmonale blodtryk og venstre ventrikels tilløbstryk (wedge trykket) med deraf følgende risiko for cerebral hæmorrhagi og lungeødem (156-159). Såfremt der tages forholdsregler til at håndtere anæstesien korrekt og hypertensionen er kontrolleret farmakologisk, kan der ikke i mindre kontrollerede studier registreres forskel i maternelt “outcome” under henholdsvis generel og regional anæstesi. (135, 160).
Opioider: Fentanyl (161,162), Alfentanil (162-164) og Remifentanil (165,166), er velegnede til at dæmpe blodtryksstigningen ved intubation, men kan forårsage respirationsdepression hos det nyfødte barn (evidens IIa). Det er dog hensynet til moderen som har første prioritet, og den nyfødtes respirationsdepression kan behandles, forudsat at pædiater/jordemoder er orienteret.
Forbehandling med Labetalol (167), Nitroglycerin (168), Nifedipin (169) og Magnesiumsulfat (163,164,170) dæmper alle blodtryksstigningen ved intubation. Der er beskrevet gavnlig effekt af magnesiumsulfat på blodtrykket under intubation, såvel med og uden Alfentanil (164) (evidens IV).
For at modvirke blodtryksstigning og at der hostes på grund af tuben er det vigtigt at sikre god analgesi inden anæstesien afsluttes.
Magnesiumsulfat påvirker den neuromuskulære funktion og interagerer derfor med alle non-depolariserende relaxantia. Infusion af Magnesiumsulfat 60 mg/kg over 15 minutter reducerer ED50 og ED90 for Vecuronium med 25 % og forlænger virkningsvarigheden med over 50 % (110,111,121).
Uterotonika
Syntocinon® (Oxytocin) sænker den systemiske vaskulære modstand og kan forårsage betydelige blodtryksfald og myokardiel iskæmi (171-174). Selv en lille bolus-dosis på 1 IE kan forårsage blodtryksfald. Normalt rekommanderes max 1 IE per minut, men hos præeklampsi patienten, den hypovolæme eller hjertesyge patient bør dosis og administrationshastighed sænkes yderligere (175,176) (evidens IIa). Oxytocin har også en antidiuretisk effekt, som ved længere tids infusion øges risikoen for væskeretention og lungeødem (177,178). (evidens IV) Methergin® (Methylergometrin) anses for kontraindiceret ved præ-eklampsi (82) Methergin virker karkontraherende og kan forårsage/forværre arteriel spasme (179). Risikoen er øget for post-partum blodtryksstigning (180), koronar vasospasme (181) og cerebral vasospasme (182). Kasuistisk findes rapporter om eklampsi og meget kraftig blodtryksstigning efter Methergin. (183-185). Cytotec® (Misoprostol) anvendes til igangsætning hos patienter med svær præeklampsi (186-188) Hos patienter med hypertension har misoprostol en let antihypertensive effect (189). Der er ikke rapporteret specielle bivirkninger ved anvendelse af Prostinfenem® (Carboprost, PGF2-alfa analog) hos patienter med præ-eklampsi (190).
Epidural analgesi til vaginal forløsning
Rekommendation
Tidlig anlæggelse af epiduralkateter anbefales, såfremt der ikke er kontraindikationer.
For kontraindikationer mod regional anæstesi, se disse under afsnit om Anæstesi til sectio
En væsentlig fordel ved epidural analgesi er muligheden for etablering af anæstesi til kejsersnit
Epiduralkateteret må som hovedregel først fjernes når kriterierne herfor er opfyldt (normal koagulation)
Baggrund
Det fremføres ofte, at epidural fødselsanalgesi er indiceret til patienter med præ-eklampsi for at, bedre placentagennemblødningen og sikre et mere stabilt blodtryk, samt at kunne ‘toppes-up’ ved behov for sectio.
Enkelte ukontrolerede studier viser forbedret intervilløst blood flow efter etablering af epidural analgesi (191,192). Anlæggelse af epidural til vaginal forløsning bør vælges som analgetisk tilbud og ikke som primær del af antihypertensiv terapi.
Epidural analgesi medfører den bedste smertelindring sammenlignet med non-epidural analgesi (193) Der er to randomiserede kontrolerede studier (RCT), hvor epidural analgesi er sammenlignet med IV-PCA opioid analgesi til patienter med præ-eklampsi. (194-196) Epidural analgesi medfører bedre smertelindring, større behov for efedrin til moderen og mindre behov for naloxon til den nyfødte. Herudover er der ikke fundet klinisk signifikante forskelle. Behovet for ekstra antihypertensiv behandling under fødslen ændres ikke signifikant. I Lucas et al´s studie fra 2001 med 372 patienter randomiseret til epidural og 366 patienter randomiseret til IV-PCA var der 1 patient i epiduralgruppen mod 4 patienter i IV-PCA gruppen som havde behov for ekstra blodtryksmedicin under fødslen. (195)
Postoperativ smertebehandling
Rekommandation
- Anlæggelse af epiduralkateter overvejes i alle tilfælde, hvor koagulationstallene tillader dette, også selvom der vælges spinal anæstesi til selve operationen
- Postoperativt epidural analgesi med infusion af bupivacain 0,06-0,08 % (eller ropivacain 0.1 %) tilsat sufentanil 0.5µg/ml eller fentanyl 2µg/ml, f.eks. 6-8 ml/h +/- PCEA
- Hos patienter uden epiduralkateter : Opioid intrathecalt, parenteralt eller peroralt som til raske sectiopatienter, jvf DASAIM Rekommandation: Anæstesi til kejsersnit 2014
- Paracetamol 1 g x 4 eller paracetamol retard 2 g x 2 i 1.-3. postoperative døgn, medmindre der er meget svær leverpåvirkning
- NSAID behandling kan overvejes, når tilstanden er stabil og koagulationen normaliseret
- Vedrørende behandling af postoperativ kvalme og opkastning: Som til raske sectiopatienter, Se DASAIM Rekommandation: Anæstesi til kejsersnit 2014
Baggrund
Som nævnt i anæstesiafsnittet har epiduralblokaden hos patienter med præeklampsi en gunstig sympatikus-hæmmende effekt med en reduktion af den perifere modstand og en øgning af organperfusionen til følge. Dette kan formentlig medvirke til at stabilisere blodtrykket og øge urinproduktionen. Der findes dog ingen dokumentation for at epidural analgesi mindsker behovet for antihypertensiva postoperativt efter sectio.
Epidural smertebehandling med kombination af lokalanæstesi og et opioid er en mere effektiv behandling for operationssmerter, herunder kejsersnit, end både intravenøs patient-kontrolleret opioid analgesi (PCA) og intrathecal Morfin (196-201) (evidens 1a+b). Af de syntetiske opioider til epidural administration er kun Sufentanil registreret i Danmark, men også Fentanyl kan anvendes med ligeså god effekt som sufentanil. Potensen af Fentanyl er 1/5 af Sufentanil. (202) Epidural analgesi efter sectio anvendes sjældent hos raske kvinder, uanset om sectio er foretaget i epidural anæstesi via et fødeepiduralkateter. Hos patienter med svær præeklampsi vil der ofte være kontraindikation imod epiduralkateter pga påvirket koagulation.
Den postoperative smertebehandling bør så vidt muligt være multimodal, jvf den postoperative smertebehandling efter sectio hos raske kvinder: Anæstesi til kejsersnit DASAIM. Epiduralblokaden eller opioidbehandlingen bør derfor suppleres med Paracetamol, med mindre der er meget svær leverpåvirkning. I de første 12-24 timer efter operationen er det tilrådeligt at undlade behandling med NSAID præparater, da status vedrørende koagulation og nyrefunktion ofte er uafklaret på dette tidspunkt. Når koagulationstallene er normaliserede og tilstanden er stabil, kan NSAID behandling tilføjes og epiduralkateteret eventuelt seponeres.
Intensiv overvågning
- Videnskabelig dokumentation for kriterier for intensiv overvågning/ behandling er ikke tilgængelig, og intensiv overvågning/ behandling skal forstås som en aktivitet, og ikke som et geografisk sted
- Overvågningen bør, uanset hvor patienten befinder sig, følge principperne som skematiseret under Monitorering i Obstetric Early Warning Score
- Patienter med sværere grader af præeklampsi bør som udgangspunkt altid behandles på en obstetrisk specialafdeling
- Om patienten kan forblive på obstetrisk afdeling eller skal overflyttes til et intensiv terapi afsnit (ITA) afhænger først og fremmest af
- erfaringen med behandling og monitorering af denne patientkategori på den obstetriske afdeling (se ovenfor om monitorering og væsketerapi)
- om patienten har respiratoriske problemer, f.eks. begyndende lungeødem eller respirationsinsufficiens, hvor overflyttelse til ITA med mulighed for respiratorbehandling kan være nødvendig.
Afhængig af erfaring og ressourcer tillige om
-
- koagulationsparametrene forværres, herunder tegn på DIC
- patienten ikke responderer tilfredsstillende på den antikonvulsive behandling
- patienten er svært dys- eller overhydreret
- patienten ikke responderer tilfredsstillende på blodtryksbehandlingen
- patienter har oligo- eller anuri
- Selvom forløsning er den kausale behandling, kan overgang til intensiv overvågning/ behandling meget vel være indiceret efter fødsel eller kejsersnit
Appendix
Referencer
1. DSOG Præeklampsi og hypertension; www.dsog.dk 2017 https://static1.squarespace.com/static/5467abcce4b056d7259 4db79/t/5912086cebbd1a468e39bc00/1494354034555/Pr%C 3%A6eklampsi+guideline+2017.pdf
2. ACOG. http://www.acog.org/Resources-AndPublications/Task-Force-and-Work-GroupReports/Hypertension-in-Pregnancy Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Obstet Gynecol. 2013 Nov; 122(5):1122-31.
3. NICE Clinical Guideline. Hypertension in pregnancy: the management of hypertensive disorders during pregnancy. National Collaborating Centre for Women’s and Children’s Health 2010; Update 2015
4. Cantwell R et al. Saving Mothers’ Lives: Reviewing maternal deaths to make motherhood safer: 2006-2008. The Eighth Report of the Confidential Enquiries into Maternal Deaths in the United Kingdom. BJOG 2011: 118 Suppl 1: 1- 203.
5. Magee LA et al. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy. J Obstet Gynaecol Can 2014: 36(5): 416-438.
6. Sibai BM. Diagnosis, prevention, and management of eclampsia. Obstet Gynecol 2005: 105: 402-410.
7. von Dadelszen P et al. Evidence-based management for preeclampsia. Front Biosci 2007: 12: 2876-2889.
8. Lewis G. e. The Confidential Enquiry into Maternal and Child Health (CEMACH). Saving Mothers’ Lives: reviewing maternal deaths to make motherhood safer – 2003-2005. The Seventh Report on Confidential Enquiries into Maternal Deaths in the United Kingdom. London: CEMACH 2007, Chiltern Court, 188 Baker Street, London, NW1 5SD.
9. Martin J-NJ et al. Stroke and severe preeclampsia and eclampsia: a paradigm shift focusing on systolic blood pressure. Obstet Gynecol 2005: 105: 246-254.
10. Redman CW et al. Management of pre-eclampsia. Lancet 1993: 341: 1451-1454.
11. Lambert G, Acta Anaesth Belg.2014, 65, 137-149
12. Duley L et al. Drugs for treatment of very high blood pressure during pregnancy.Cochrane Database Syst Rev. 2013 Jul 31;(7) 35
13. Magee LA et al. Hydralazine for treatment of severe hypertension in pregnancy: meta-analysis. BMJ 2003: 327: 955-960.
14. Belfort MA et al. Labetalol decreases cerebral perfusion pressure without negatively affecting cerebral blood flow in hypertensive gravidas. Hypertens Pregnancy 2002: 21: 185- 197.
15. Magee LA et al. Fortnightly review: management of hypertension in pregnancy. BMJ 1999: 318: 1332-1336.
16. Olsen KS et al. Hemodynamic collapse following labetalol administration in preeclampsia. Acta Obstet Gynecol Scand 1992: 71: 151-152.
17. Olsen KS et al. Fetal death following labetalol administration in pre-eclampsia. Acta Obstet Gynecol Scand 1992: 71: 145-147.
18. Aali BS et al. Nifedipine or hydralazine as a first-line agent to control hypertension in severe preeclampsia. Acta Obstet Gynecol Scand 2002: 81: 25-30.
19. Borghi C et al. The treatment of hypertension in pregnancy. J Hypertens 2002: 20 Suppl. 2: S52-S56.
20. Scardo JA et al. A randomized, double-blind, hemodynamic evaluation of nifedipine and labetalol in preeclamptic hypertensive emergencies. Am J Obstet Gynecol 1999: 181: 862-866.
21. Rucklidge MW et al. Central venous pressure monitoring in severe preeclampsia: a survey of UK practice. Int J Obstet Anesth 2011: 20: 274
22. Young P et al. Haemodynamic, invasive and echocardiographic monitoring in the hypertensive parturient. Best Pract Res Clin Obstet Gynaecol 2001: 15: 605-622.
23. Menzies J et al. Instituting surveillance guidelines and adverse outcomes in preeclampsia. Obstet Gynecol 2007: 110: 121-127.
24. Gardner-Thorpe J et al. The value of Modified Early Warning Score (MEWS) in surgical in-patients: a prospective observational study. Ann R Coll Surg Engl 2006: 88: 571-575.
25. Rees JE. Early Warning Scores (http://www.nda.ox.ac.uk/wfsa/html/u17/u1710_01.htm). Update in Anaesthesia 2003: 30-33.
26. Lewis G. (ed). The confidential enquiry into maternal and child health (CEMACH). Saving mothers’ lives: reviewing maternal deaths to make motherhood safer – 2003-2005. The seventh report on confidential enguiries into maternal deaths in the United Kingdom. London: CEMACH 2007, Chiltern Court, 188 Baker Street, London, NW1 5SD.
27. Singh S et al. A validation study of the CEMACH recommended modified early obstetric warning system (MEOWS)*. Anaesthesia 2012: 67: 12-18.
28. Duley L et al. Plasma volume expansion for treatment of women with pre-eclampsia. Cochrane Database Syst Rev 2000: CD001805-
29. Ganzevoort W et al. A randomised controlled trial comparing two temporising management strategies, one with and one without plasma volume expansion, for severe and early onset pre-eclampsia. BJOG 2005: 112: 1358-1368.
30. Rep A et al. One-year infant outcome in women with earlyonset hypertensive disorders of pregnancy. BJOG 2008: 115: 290-298.
31. Lewis G, Drife J. Why Mothers die. The sixth report. Report on Confidential Enquiries into Maternal Deaths in the United Kingdom 2000-2002. RCOG 2004
32. Mushambi MC et al. Recent developments in the pathophysiology and management of pre-eclampsia. Br J Anaesth 1996: 76: 133-148.
33. Pertuiset N et al. Acute renal failure in pregnancy. Baillieres Clin Obstet Gynaecol 1987: 1: 873-890.
34. Walker JJ. Pre-eclampsia. Lancet 2000: 356: 1260-1265.
35. Brun C, Sieleskiewicz L, Textoris J et al. Intensiv Care Med 2013; 39: 593-600
36. Keiseb J, Hypertens Pregnancy 2002; 21(3):225-234.
37. Van Bogaert LJ. Feto-maternal outcome in preeclampsia/eclampsia with and without multisystem organ failure managed by strict input/output fluid regimen. East Afr Med J 1996: 73: 720-723.
38. Husaini SW et al. Volume preload: lack of effect in the prevention of spinal-induced hypotension at caesarean section. Int J Obstet Anesth 1998: 7: 76-81.
39. Human albumin administration in critically ill patients: systematic review of randomised controlled trials. Cochrane Injuries Group Albumin Reviewers. BMJ 1998: 317: 235- 240.
40. Salmon JB et al. Pharmacology and physiology of colloids Blood Rev 1993: 7: 114-120
41. Haase N, Perner A. Colloid Solutions in the perioperative setting. BMJ 2015: Mar 27: 350
42. Langesæter, E et al Editorial Anesthesiology 2008; 108, s 771-772
43. Dennis AT. Transthoracic echocardiography in women with preeclampsia. Curr Opin Anaest 2015 Jun; 28 (3): 254-260
44. Zieleskiewicz L. et al. Lung ultrasound-guided managemant of acute breathlessness during pregnancy. Anaesthesia 2013, 68; 97-101
45. Sibai BM. Diagnosis, controversies, and management of the syndrome of hemolysis, elevated liver enzymes, and low platelet count. Obstet Gynecol 2004: 103: 981-991.
46. Martin JN et al. Standardized Mississippi Protocol Treatment of 190 Patients with HELLP Syndrome: Slowing Disease Progression and Preventing New Major Maternal Morbidity. Hypertens Pregnancy 2011:
47. Audibert F et al. Clinical utility of strict diagnostic criteria for the HELLP (hemolysis, elevated liver enzymes, and low platelets) syndrome. Am J Obstet Gynecol 1996: 175: 460- 464.
48. Sibai BM et al. Maternal morbidity and mortality in 442 pregnancies with hemolysis, elevated liver enzymes, and low platelets (HELLP syndrome). Am J Obstet Gynecol 1993: 169: 1000-1006.
49. Weinstein L. Syndrome of hemolysis, elevated liver enzymes, and low platelet count: a severe consequence of hypertension in pregnancy. Am J Obstet Gynecol 1982: 142: 159-167.
50. O’brien JM et al. Controversies with the diagnosis and management of HELLP syndrome. Clin Obstet Gynecol 2005: 48: 460-477.
51. Sibai BM. The HELLP syndrome (hemolysis, elevated liver enzymes, and low platelets): much ado about nothing? Am J Obstet Gynecol 1990: 162: 311-316.
52. Wilke G et al. Haptoglobin as a sensitive marker of hemolysis in HELLP-syndrome. Int J Gynaecol Obstet 1992: 39: 29-34.
53. Schrocksnadel H et al. Hemolysis in hypertensive disorders of pregnancy. Gynecol Obstet Invest 1992: 34: 211-216.
54. Martin J-NJ et al. The spectrum of severe preeclampsia: comparative analysis by HELLP (hemolysis, elevated liver enzyme levels, and low platelet count) syndrome classification. Am J Obstet Gynecol 1999: 180: 1373-1384.
55. Isler CM et al. Maternal mortality associated with HELLP (hemolysis, elevated liver enzymes, and low platelets) syndrome. Am J Obstet Gynecol 1999: 181: 924-928.
56. Terrone DA et al. Cardiopulmonary morbidity as a complication of severe preeclampsia HELLP syndrome. J Perinatol 2000: 20: 78-81.
57. Woods JB et al. Ascites: a portent of cardiopulmonary complications in the preeclamptic patient with the syndrome of hemolysis, elevated liver enzymes, and low platelets. Obstet Gynecol 1992: 80: 87-91.
58. Haddad B et al. Risk factors for adverse maternal outcomes among women with HELLP (hemolysis, elevated liver enzymes, and low platelet count) syndrome. Am J Obstet Gynecol 2000: 183: 444-448.
59. Cavkaytar S et al. Are clinical symptoms more predictive than laboratory parameters for adverse maternal outcome in HELLP syndrome? Acta Obstet Gynecol Scand 2007: 86: 648-651.
60. Barron WM et al. Reducing unnecessary coagulation testing in hypertensive disorders of pregnancy. Obstet Gynecol 1999: 94: 364-370.
61. Woudstra DM et al. Corticosteroids for HELLP (hemolysis, elevated liver enzymes, low platelets) syndrome in pregnancy. Cochrane Database Syst Rev 2010: CD008148-
62. Magann EF et al. Postpartum corticosteroids: accelerated recovery from the syndrome of hemolysis, elevated liver enzymes, and low platelets (HELLP). Am J Obstet Gynecol 1994: 171: 1154-1158.
63. Magann EF et al. Antepartum corticosteroids: disease stabilization in patients with the syndrome of hemolysis, elevated liver enzymes, and low platelets (HELLP). Am J Obstet Gynecol 1994: 171: 1148-1153.
64. Yalcin OT et al. Effects of postpartum corticosteroids in patients with HELLP syndrome. Int J Gynaecol Obstet 1998: 61: 141-148.
65. Fonseca JE et al. Dexamethasone treatment does not improve the outcome of women with HELLP syndrome: a double-blind, placebo-controlled, randomized clinical trial. Am J Obstet Gynecol 2005: 193: 1591-1598.
66. Stanworth SJ et al. Platelet transfusion prophylaxis for patients with haematological malignancies: where to now? Br J Haematol 2005: 131: 588-595.
67. Roberts WE et al. The intrapartum platelet count in patients with HELLP (hemolysis, elevated liver enzymes, and low platelets) syndrome: is it predictive of later hemorrhagic complications? Am J Obstet Gynecol 1994: 171: 799-804.
68. Vigil De Gracia P. Addition of platelet transfusions to corticosteroids does not increase the recovery of severe HELLP syndrome. Eur J Obstet Gynecol Reprod Biol 2006: 128: 194-198.
69. Cosmai EM et al. Thrombocytopenic purpura and cardiomyopathy in pregnancy reversed by combined plasma exchange and infusion. Eur J Haematol 2002: 68: 239-242.
70. Gerth J et al. Pregnancy-associated thrombotic thrombocytopenic purpura. Thromb Haemost 2009: 101: 248-251.
71. Eser B et al. The role of plasma exchange in HELLP syndrome. Clin Appl Thromb Hemost 2005: 11: 211-217.
72. Martin J-NJ et al. Postpartum plasma exchange for atypical preeclampsia-eclampsia as HELLP (hemolysis, elevated liver enzymes, and low platelets) syndrome. Am J Obstet Gynecol 1995: 172: 1107-1125.
73. Vora SK et al. Catastrophic antiphospholipid syndrome. J Intensive Care Med 2006: 21: 144-159.
74. Sibai BM. Imitators of severe preeclampsia. Obstet Gynecol 2007: 109: 956-966.
75. Onyangunga OA et al. Managing pregnancy with HIV, HELLP syndrome and low platelets. Best Pract Res Clin Obstet Gynaecol 2011: 26(1): 133-147
76. Rajasri AG et al. Acute fatty liver of pregnancy (AFLP)–an overview. J Obstet Gynaecol 2007: 27: 237-240.
77. Mjahed K et al. Acute fatty liver of pregnancy. Arch Gynecol Obstet 2006: 274: 349-353.
78. Clark EA et al. Do antiphospholipid antibodies cause preeclampsia and HELLP syndrome? Curr Rheumatol Rep 2007: 9: 219-225.
79. Gomez Puerta JA et al. Catastrophic antiphospholipid syndrome during pregnancy and puerperium: maternal and fetal characteristics of 15 cases. Ann Rheum Dis 2007: 66: 740-746.
80. van Pampus MG et al. Maternal and perinatal outcome after expectant management of the HELLP syndrome compared with pre-eclampsia without HELLP syndrome. Eur J Obstet Gynecol Reprod Biol 1998: 76: 31-36.
81. Moodley J et al. A review of the management of eclampsia: practical issues. Hypertens Pregnancy 2006: 25: 47-62.
82. RCOG. The management of severe preeclampsia/eclampsia. Royal College of Obstetricians and Gynecologists Guideline no.10A. London: RCOG 2010
83. Lipka K et al. Lactic acidosis following convulsions. Acta Anaesthesiol Scand 2003: 47: 616-618.
84. Lubarsky SL et al. Late postpartum eclampsia revisited. Obstet Gynecol 1994: 83: 502-505.
85. Richards AM et al. Active management of the unconscious eclamptic patient. Br J Obstet Gynaecol 1986: 93: 554-562.
86. Paul RH et al. Changes in fetal heart rate-uterine contraction patterns associated with eclampsia. Am J Obstet Gynecol 1978: 130: 165-169.
87. Duley L et al. Magnesium sulphate versus lytic cocktail for eclampsia. Cochrane Database Syst Rev 2010: CD002960-
88. Duley L et al. Magnesium sulphate versus phenytoin for eclampsia. Cochrane Database Syst Rev 2010: CD000128-
89. Duley L et al. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database Syst Rev 2010: CD000127-
90. The Eclampsia Trial Collaborative Group. Which anticonvulsant for women with eclampsia? Evidence from the Collaborative Eclampsia Trial. Lancet 1995: 345: 1455- 1463.
91. Duley L et al. Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev 2010: CD000025-
92. Altman D, Carroli G, Duley L et al. The Magpie Trial Collaborative Group. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet 2002: 359: 1877-1890.
93. Sibai BM. Magnesium sulfate prophylaxis in preeclampsia: Lessons learned from recent trials. Am J Obstet Gynecol 2004: 190: 1520-1526.
94. Altman D et al. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet 2002: 359: 1877-1890.
95. Zuspan FP. Problems encountered in the treatment of pregnancy-induced hypertension. A point of view. Am J Obstet Gynecol 1978: 131: 591-597.
96. Pritchard JA. The use of magnesium sulfate in preeclampsiaeclampsia. J Reprod Med 1979: 23: 107-114.
97. Sibai BM. Seeking the best use of magnesium sulfate in preeclampsia-eclampsia. Contemporary OB/GYN 1986: 29: 155-165.
98. Maia SB, Katz L, Neto CN et al. International journal of Gynaecology and Obstetrics 2014; 126(3): 260-4
99. Isler CM et al. Postpartum seizure prophylaxis: using maternal clinical parameters to guide therapy. Obstet Gynecol 2003: 101: 66-69.
100. Fontenot MT et al. A prospective randomized trial of magnesium sulfate in severe preeclampsia: use of diuresis as a clinical parameter to determine the duration of postpartum therapy. Am J Obstet Gynecol 2005: 192: 1788-1793.
101. Morisaki H et al. Hypermagnesemia-induced cardiopulmonary arrest before induction of anesthesia for emergency cesarean section. J Clin Anesth 2000: 12: 224- 226.
102. Sundhedsstyrelsen. Temarapport 2007: Risikomedicin. 1- 43. 2007.
103. Naidu S et al. Randomised study assessing the effect of phenytoin and magnesium sulphate on maternal cerebral circulation in eclampsia using transcranial Doppler ultrasound. Br J Obstet Gynaecol 1996: 103: 111-116.
104. Belfort MA et al. Effect of magnesium sulfate on maternal brain blood flow in preeclampsia: A randomized, placebocontrolled study. Am J Obstet Gynecol 1992: 167: 661-666.
105. Goldman RS et al. Therapeutic use of magnesium sulfate in selected cases of cerebral ischemia and seizure. N Engl J Med 1988: 319: 1224-1225.
106. Sadeh M. Action of magnesium sulfate in the treatment of preeclampsia-eclampsia. Stroke 1989: 20: 1273-1275.
107. Hatab MR et al. The effect of magnesium sulfate on large cerebral artery blood flow in preeclampsia. J Matern Fetal Neonatal Med 2005: 17: 187-192.
108. Molvarec A et al. Increased plasma von Willebrand factor antigen levels but normal von Willebrand factor cleaving protease (ADAMTS13) activity in preeclampsia. Thromb Haemost 2009: 101: 305-311.
109. Dong JF et al. Magnesium maintains endothelial integrity, up-regulates proteolysis of ultra-large von Willebrand factor, and reduces platelet aggregation under flow conditions. Thromb Haemost 2008: 99: 586-593.
110. Fuchs Buder T et al. Interaction of magnesium sulphate with vecuronium-induced neuromuscular block. Br J Anaesth 1995: 74: 405-409.
111. Yoshida A et al. Prolonged relaxant effects of vecuronium in patients with deliberate hypermagnesemia: time for caution in cesarean section. J Anesth 2006: 20: 33-35.
112. Fuchs Buder T et al. Magnesium sulphate enhances residual neuromuscular block induced by vecuronium. Br J Anaesth 1996: 76: 565-566.
113. Tsai SK et al. Neuromuscular interactions between suxamethonium and magnesium sulphate in the cat. Br J Anaesth 1994: 72: 674-678.
114. Sibai BM. Magnesium sulfate is the ideal anticonvulsant in preeclampsia-eclampsia. Am J Obstet Gynecol 1990: 162: 1141-1145.
115. Terrone DA et al. A prospective, randomized, controlled trial of high and low maintenance doses of magnesium sulfate for acute tocolysis. Am J Obstet Gynecol 2000: 182: 1477-1482.
116. Reynolds JD et al. Magnesium sulfate adversely affects fetal lamb survival and blocks fetal cerebral blood flow response during maternal hemorrhage. Anesth Analg 1996: 83: 493- 499.
117. Hiett AK et al. Effect of magnesium on fetal heart rate variability using computer analysis. Am J Perinatol 1995: 12: 259-261.
118. Koontz SL et al. Symptomatic hypocalcemia after tocolytic therapy with magnesium sulfate and nifedipine. Am J Obstet Gynecol 2004: 190: 1773-1776.
119. Samol JM et al. Magnesium sulfate tocolysis and pulmonary edema: the drug or the vehicle? Am J Obstet Gynecol 2005: 192: 1430-1432.
120. McCubbin JM et al. Cardiopulmonary arrest due to acute maternal hypermagnesaemia. Lancet 1981: 1: 1058.
121. Fuchs-Buder T et al. Antagonism of vecuronium-induced neuromuscular block in patients pretreated with magnesium sulphate: dose-effect relationship of neostigmine. Br J Anaesth 1999: 82: 61-65.
122. Richards A et al. Cardiopulmonary arrest after the administration of magnesium sulphate. S Afr Med J 1985: 67: 145.
123. Lu JF et al. Magnesium sulfate in eclampsia and preeclampsia: pharmacokinetic principles. Clin Pharmacokinet 2000: 38: 305-314.
124. Taber EB et al. Pharmacokinetics of ionized versus total magnesium in subjects with preterm labor and preeclampsia. Am J Obstet Gynecol 2002: 186: 1017-1021.
125. Tuffnell D. J. et al. Yorkshire Regional severe pre-eclampsia guideline March 2005.
126. James MFM. Magnesium in obstetric anesthesia. Int J Obstet Anesth 1998: 115-123.
127. Pritchard JA et al. The Parkland Memorial Hospital protocol for treatment of eclampsia: evaluation of 245 cases. Am J Obstet Gynecol 1984: 148: 951-963.
128. Breivik H et al. Nordic guidelines for neuraxial blocks in disturbed haemostasis from the Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesthesiol Scand 2010: 54: 16-41.
129. Aya AG et al. Patients with severe preeclampsia experience less hypotension during spinal anesthesia for elective cesarean delivery than healthy parturients: a prospective cohort comparison. Anesth Analg 2003: 97: 867-872.
130. Aya AG et al. Spinal anesthesia-induced hypotension: a risk comparison between patients with severe preeclampsia and healthy women undergoing preterm cesarean delivery. Anesth Analg 2005: 101: 869-875.
131. Hood DD et al. Spinal versus epidural anesthesia for cesarean section in severely preeclamptic patients: a retrospective survey. Anesthesiology 1999: 90: 1276-1282.
132. Ramanathan J et al. Combined spinal and epidural anesthesia with low doses of intrathecal bupivacaine in women with severe preeclampsia: a preliminary report. Reg Anesth Pain Med 2001: 26: 46-51.
133. Santos AC et al. Spinal anesthesia for cesarean delivery in severely preeclamptic women: don’t throw out the baby with the bathwater! Anesth Analg 2005: 101: 859-861.
134. Visalyaputra S et al. Spinal versus epidural anesthesia for cesarean delivery in severe preeclampsia: a prospective randomized, multicenter study. Anesth Analg 2005: 101: 862-868.
135. Wallace DH et al. Randomized comparison of general and regional anesthesia for cesarean delivery in pregnancies complicated by severe preeclampsia. Obstet Gynecol 1995: 86: 193-199.
136. Sharwood-Smith G et al. Regional anaesthesia for caesarean section in severe preeclampsia: spinal anaesthesia is the preferred choice. Int J Obstet Anesth 1999: 8: 85-89.
137. Assali NS et al. Studies on autonomic blockade. I. Comparison between the effects of tetraethylammonium chloride (TEAC) and high selective spinal anesthesia on blood pressure of normal and toxemic pregnancy. J Clin Invest 1950: 29: 1354-1366.
138. Clark VA et al. Ephedrine requirements are reduced during spinal anaesthesia for caesarean section in preeclampsia. Int J Obstet Anesth 2005: 14: 9-13.
139. Chiu CL et al. Retrospective review of spinal versus epidural anaesthesia for caesarean section in preeclamptic patients. Int J Obstet Anesth 2003: 12: 23-27.
140. Moodley J et al. Epidural compared with general anaesthesia for caesarean delivery in conscious women with eclampsia. BJOG 2001: 108: 378-382.
141. Okafor UV et al. Maternal and fetal outcome of anaesthesia for caesarean delivery in preeclampsia/eclampsia in Enugu, Nigeria: a retrospective observational study. Int J Obstet Anesth 2005: 14: 108-113.
142. Van de Velde M et al. Low-dose combined spinal-epidural anaesthesia vs. conventional epidural anaesthesia for Caesarean section in pre-eclampsia: a retrospective analysis. Eur J Anaesthesiol 2004: 21: 454-459.
143. Alahuhta S et al. Uteroplacental and fetal circulation during extradural bupivacaine-adrenaline and bupivacaine for caesarean section in hypertensive pregnancies with chronic fetal asphyxia. Br J Anaesth 1993: 71: 348-353.
144. Dror A et al. Maternal hemodynamic responses to epinephrine-containing local anesthetics in mild preeclampsia. Reg Anesth 1988: 13: 107-111.
145. Hadzic A et al. Hypertensive crisis after a successful placement of an epidural anesthetic in a hypertensive parturient. Case report. Reg Anesth 1995: 20: 156-158.
146. Why Mothers die. Report on Confidential Enquiries into Maternal Deaths in the United Kingdom 1997-1999. RCOG 2001:
147. Huang CJ et al. Differential impacts of modes of anaesthesia on the risk of stroke among preeclamptic women who undergo Caesarean delivery: a population-based study. Br J Anaesth 2010: 105: 818-826.
148. Izci B et al. The upper airway in pregnancy and preeclampsia. Am J Respir Crit Care Med 2003: 167: 137-140.
149. Brimacombe J. Acute pharyngolaryngeal oedema and preeclamptic toxaemia. Anaesth Intensive Care 1992: 20: 97-98.
150. Rocke DA et al. Rapidly progressive laryngeal oedema associated with pregnancy-aggravated hypertension. Anaesthesia 1992: 47: 141-143.
151. Hein HA. Cardiorespiratory arrest with laryngeal oedema in pregnancy-induced hypertension. Can Anaesth Soc J 1984: 31: 210-212.
152. Nafiu OO et al. Anaesthetic dilemma: spinal anaesthesia in an eclamptic patient with mild thrombotyopenia and an “impossible” airway. Int J Obstet Anesth 2003: 13: 110-113.
153. Perlow JH et al. Severe preeclampsia presenting as dysphonia secondary to uvular edema. A case report. J Reprod Med 1990: 35: 1059-1062.
154. Munnur U et al. Airway problems in pregnancy. Crit Care Med 2005: 33: S259-S268.
155. Potgieter PD et al. “Cuff” test for safe extubation following laryngeal edema. Crit Care Med 1988: 16: 818-
156. Connell H et al. General anaesthesia in mothers with severe pre-eclampsia/eclampsia. Br J Anaesth 1987: 59: 1375-1380.
157. Hodgkinson R et al. Systemic and pulmonary blood pressure during caesarean section in parturients with gestational hypertension. Can Anaesth Soc J 1980: 27: 389-394.
158. Fox EJ et al. Complications related to the pressor response to endotracheal intubation. Anesthesiology 1977: 47: 524-525.
159. Cunningham FG. Severe preeclampsia and eclampsia: systolic hypertension is also important. Obstet Gynecol 2005: 105: 237-238.
160. Dyer RA et al. Prospective, randomized trial comparing general with spinal anesthesia for cesarean delivery in preeclamptic patients with a nonreassuring fetal heart trace. Anesthesiology 2003: 99: 561-569.
161. Lawes EG et al. Fentanyl-droperidol supplementation of rapid sequence induction in the presence of severe pregnancy-induced and pregnancy-aggravated hypertension. Br J Anaesth 1987: 59: 1381-1391.
162. Rout CC et al. Effects of alfentanil and fentanyl on induction of anaesthesia in patients with severe pregnancy-induced hypertension. Br J Anaesth 1990: 65: 468-474.
163. Allen RW et al. Attenuation of the pressor response to tracheal intubation in hypertensive proteinuric pregnant patients by lignocaine, alfentanil and magnesium sulphate. Br J Anaesth 1991: 66: 216-223.
164. Ashton WB et al. Attenuation of the pressor response to tracheal intubation by magnesium sulphate with and without alfentanil in hypertensive proteinuric patients undergoing caesarean section. Br J Anaesth 1991: 67: 741-747.
165. Ngan Kee WD et al. Maternal and neonatal effects of remifentanil at induction of general anesthesia for cesarean delivery: a randomized, double-blind, controlled trial. Anesthesiology 2006: 104: 14-20.
166. Palacio FJ et al. Remifentanil bolus for cesarean section in high-risk patients: study of 12 cases. Rev Esp Anestesiol Reanim 2008: 55: 86-89.
167. Ramanathan J et al. The use of labetalol for attenuation of the hypertensive response to endotracheal intubation in preeclampsia. Am J Obstet Gynecol 1988: 159: 650-654.
168. Hood DD et al. The use of nitroglycerin in preventing the hypertensive response to tracheal intubation in severe preeclampsia. Anesthesiology 1985: 63: 329-332.
169. Kumar N et al. Nifedipine attenuates the hypertensive response to tracheal intubation in pregnancy-induced hypertension. Can J Anaesth 1993: 40: 329-333.
170. James MF et al. Intravenous magnesium sulfate inhibits catecholamine release associated with tracheal intubation. Anesth Analg 1989: 68: 772-776.
171. Langesaeter E et al. Hemodynamic effects of oxytocin during cesarean delivery. Int J Gynaecol Obstet 2006: 95: 46-47.
172. Svanstrom MC et al. Signs of myocardial ischaemia after injection of oxytocin: a randomized double-blind comparison of oxytocin and methylergometrine during Caesarean section. Br J Anaesth 2008: 100: 683-689.
173. Thomas JS et al. Haemodynamic effects of oxytocin given as i.v. bolus or infusion on women undergoing Caesarean section. Br J Anaesth 2007: 98: 116-119.
174. Thomas TA et al. Maternal deaths from anaesthesia. An extract from Why mothers die 1997-1999, the Confidential Enquiries into Maternal Deaths in the United Kingdom. Br J Anaesth 2002: 89: 499-508.
175. Langesaeter E. Is it more informative to focus on cardiac output than blood pressure during spinal anesthesia for cesarean delivery in women with severe preeclampsia? Anesthesiology 2008: 108: 771-772.
176. Langesaeter E et al. Haemodynamic effects of oxytocin in women with severe preeclampsia. Int J Obstet Anesth 2011: 20: 26-29.
177. Shahin J et al. Pulmonary edema possibly developing secondary to the intravenous administration of oxytocin. Vet Hum Toxicol 1991: 33: 587-588.
178. Ghai B et al. Acute pulmonary oedema following oxytocin administration: a life threatening complication. J Indian Med Assoc 2006: 104: 261-262.
179. de Groot AN et al. Ergot alkaloids. Current status and review of clinical pharmacology and therapeutic use compared with other oxytocics in obstetrics and gynaecology. Drugs 1998: 56: 523-535.
180. McDonald SJ et al. Randomised controlled trial of oxytocin alone versus oxytocin and ergometrine in active management of third stage of labour. BMJ 1993: 307: 1167-1171.
181. Tsui BC et al. Cardiac arrest and myocardial infarction induced by postpartum intravenous ergonovine administration. Anesthesiology 2001: 94: 363-364.
182. Sekimoto E et al. Delayed vasospasm in late postpartum cerebral angiopathy after withdrawal of methylergometrine. Cerebrovasc Dis 2002: 13: 288-289.
183. Browning DJ. Serious side effects of ergometrine and its use in routine obstetric practice. Med J Aust 1974: 1: 957-959.
184. Ng SY et al. Ergometrine administration for post-partum haemorrhage in an undiagnosed pre-eclamptic. Anaesth Intensive Care 2008: 36: 113-115.
185. Dua JA. Postpartum eclampsia associated with ergometrine maleate administration. Br J Obstet Gyn 1994: 101: 72-73.
186. Berkley E et al. Success rates with low dose misoprostol before induction of labor for nulliparas with severe preeclampsia at various gestational ages. J Matern Fetal Neonatal Med 2007: 20: 825-831.
187. Del Valle GO et al. Use of misoprostol (prostaglandin E1 methyl analogue) to expedite delivery in severe preeclampsia remote from term. J Matern Fetal Med 1996: 5: 39-40.
188. Nahar S et al. Utility of misoprostol for labor induction in severe pre-eclampsia and eclampsia. J Obstet Gynaecol Res 2004: 30: 349-353.
189. Kailasam MT et al. Effects of an oral prostaglandin E1 agonist on blood pressure and its determinants in essential hypertension. J Hum Hypertens 1994: 8: 515-520.
190. Oleen MA et al. Controlling refractory atonic postpartum hemorrhage with Hemabate sterile solution. Am J Obstet Gynecol 1990: 162: 205-208.
191. Jouppila P et al. Lumbar epidural analgesia to improve intervillous blood flow during labor in severe preeclampsia. Obstet Gynecol 1982: 59: 158-161.
192. Jouppila R et al. Placental blood flow and epidural analgesia during labour in hypertensive pregnancies. J Perinat Med 1981: 9 Suppl 1: 164-165.
193. Epidural versus non-epidural or no analgesia in labour. Anim-Somuah M1, Smyth RM, Jones L. Cochrane Database Syst Rev. 2011 Dec 7;(12)
194. Head BB et al. A randomized trial of intrapartum analgesia in women with severe preeclampsia. Obstet Gynecol 2002: 99: 452-457.
195. Lucas MJ et al. A randomized trial of labor analgesia in women with pregnancy-induced hypertension. Am J Obstet Gynecol 2001: 185: 970-975.
196. Patel P et al. Labor epidural analgesia in pre-eclampsia: a prospective study. J Obstet Gynaecol Res 2005: 31: 291-295.
197. Cohen S et al. Bupivacaine 0.01% and/or epinephrine 0.5 microg/ml improve epidural fentanyl analgesia after cesarean section. Anesthesiology 1998: 89: 1354-1361.
198. Cooper DW et al. Patient-controlled analgesia: epidural fentanyl and i.v. morphine compared after caesarean section. Br J Anaesth 1999: 82: 366-370.
199. Tsui SL et al. Epidural infusion of bupivacaine 0.0625% plus fentanyl 3.3 micrograms/ml provides better postoperative analgesia than patient-controlled analgesia with intravenous morphine after gynaecological laparotomy. Anaesth Intensive Care 1997: 25: 476-481.
200. Vercauteren M et al. Cost-effectiveness of analgesia after Caesarean section. A comparison of intrathecal morphine and epidural PCA. Acta Anaest Scand 2002: 46: 85-89.
201. Wu CL et al. Efficacy of postoperative patient-controlled and continuous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis. Anesthesiology 2005: 103: 1079-1088.
202. Grass JA et al. A randomized, double-blind, dose-response comparison of epidural fentanyl versus sufentanil analgesia after cesarean section. Anesth Analg 1997: 85: 365-371
203. M Eccles, J Mason. How to develop cost-conscious Guidelines. Health Technology Assessment 2001; 5: 16: 8- 14
Indholdsfortegenelse
