NATIONAL BEHANDLINGSVEJLEDNING FOR KRITISK SYGE BØRN
Nogle rekommendationer for intensiv behandling af børn i Danmark
Udarbejdet af arbejdsgruppe under DASAIM og DSIT.
Godkendt af DASAIM/DSIT på Intensiv Symposium: 23/1-2014
Gyldig fra: 21/7-2014
Revision senest: Juli 2018
Korrespondance
Marcela Carlsson
Overlæge, EDIC
Anæstesiologisk – Intensiv Afdeling V
Odense Universitetshospital
5000 Odense C
Email: marcela.carlsson@rsyd.dk
Arbejdsgruppen
Lasse Høgh Andersen
Afdelingslæge Intensiv
Afsnit 4131 Rigshospitalet
Inge-Lise Jarnvig
Overlæge Intensiv
Afsnit 4131 Rigshospitalet
Mads Astvad
Afdelingslæge Anæstesiologisk-Intensiv
Afdeling V Odense Universitetshospital
Søren Kjærsgaard Specialansvarlig
Overlæge, Ph.D. Anæstesiologisk
Afdeling Nord Aalborg Universitetshospital
Marcela Carlsson
Overlæge, EDIC Anæstesiologisk-Intensiv
Afdeling V Odense Universitetshospital
Kaare Engell Lundstrøm
Overlæge Pædiatrisk Klinik
Rigshospitalet
Rolf Dall
Overlæge
Anæstesiologisk-Intensiv Afdeling Aarhus Universitetshospital Skejby
Pernille Opstrup
1.reservelæge
Anæstesiologisk Afdeling Hvidovre hospital
Jakob Gjedsted
Afdelingslæge
Anæstesiologisk-Intensiv Afdeling Aarhus Universitetshospital Skejby
Ole Pedersen
Overlæge Anæstesiologisk-Intensiv
Afdeling V Odense Universitetshospital
Niels Risør Hammer
Afdelingslæge, Ph.D. Neuroanæstesiologisk
Afdeling 2093/3042 Rigshospitalet
Birgitte M.B. Schousboe
Overlæge Neuroanæstesiologisk
Afdeling 2093/3042 Rigshospitalet
FORMÅL OG BAGGRUND
Denne behandlingsvejledning (BV) er udarbejdet af en arbejdsgruppe under DASAIM/DSIT, nedsat i januar 2012 i forbindelse med det årlige Intensiv Symposium på Hindsgavl. Formålet med vejledningen er at forbedre og ensarte behandling af kritisk syge børn i Danmark.
Arbejdet med BV er foregået fra januar 2012 til december 2013 – litteratursøgning er afsluttet i november 2013.
Formand for arbejdsgruppen: Marcela Carlsson.
Redaktører og koordinatorer: Marcela Carlsson og Mads Astvad.
BV bliver efter godkendelse på Hindsgavl præsenteret for afdelingsledelser ved de 5 universitets-afdelinger i Danmark, som varetager intensiv terapi af børn, og Dansk Pædiatrisk Selskab.
I de skandinaviske lande varetages intensiv behandling af kritisk syge voksne traditionelt af speciallæger i anæstesiologi. Indenfor børneområdet foregår neonatologisk intensiv behandling næsten udelukkende i pædiatrisk regi. Der er et relativt begrænset behov for intensiv terapi af andre børn end neonatale i Danmark. Kritisk syge børn med varierende kliniske problemstillinger (respirationsinsufficiens, kredsløbssvigt, kramper, traumer, herunder neurotraumer) behandles som regel på en voksenintensiv afdeling, eller i nær tilknytning hertil.
Intensiv terapi til alle børn <2 år, samt til ældre børn med tilstande, hvor der kan forudses længere behandlingstid på intensiv afdeling (> 72 timer) er ifølge Sundhedsstyrelsens “Specialevejledning for anæstesiologi” 1 fra d. 21. juni 2013 en højtspecialiseret funktion, tildelt Rigshospitalet, Odense Universitetshospital, AUH Skejby, AUH Århus sygehus (til traumer og neurokirurgi) og AUH Ålborg. Funktionen omfatter ikke neonatologi, som er beskrevet i specialevejledning for pædiatri.
Behandlingen af kritisk syge børn er en krævende opgave, da patientgruppen er præget af særlige behov. Behandlingsbehov varierer en del og afhænger af sværhedsgraden, antal af organsvigt samt den udløsende/bagvedliggende sygdom. Børneintensiv terapi er en teamopgave med involvering af mange specialer, herunder avanceret børnekirurgi.
Denne BV er primært rettet til afdelinger, som ikke varetager børneintensiv terapi. For at afgrænse behandlingsvejledningens omfang har arbejdsgruppen fokuseret på følgende emner, som omhandler ofte livstruende tilstande og sygdomme:
- Stabilisering, visitation og transport
- Kapitel med generelle overvejelser
- Selvstændigt støttedokument til at guide stabilisering, visitation og transport i den akutte situation • Luftvejshåndtering, herunder vanskelig intubation
- Behandling af astma, bronchiolitis og pseudocroup
- Respiratorbehandling – afsnittet fokuserer primært på lungeprotektiv ventilation og generelle behandlingsprincipper under initial stabilisering og transport af kritisk syge børn. Specifikke anbefalinger samt avanceret behandling af svær hypoksi nævnes, men uddybes ikke, da de ligger udenfor vejledningens omfang.
- Behandling af cirkulatorisk svigt – afsnittet omhandler primært behandling af septisk shock. Andre tilstande medførende cirkulatorisk svigt nævnes, men ligger udenfor vejledningens omfang
- Sedation og analgesi på intensiv afdeling
- Krampebehandling
- På sygehuse uden pædiatrisk anæstesiologisk funktion
- På sygehuse med pædiatrisk anæstesiologisk funktion
Flere akutte tilstande som luftvejsfremmedlegemer, meningitis og traumer, herunder neurotraumer er ikke berørt i denne BV.
Ernæringsvejledning til kritisk syge børn er udskilt som selvstændig behandlingsvejledning i sit eget dokument og er rettet mod afdelinger, der varetager intensiv terapi af børn.
Anbefalingerne ved de enkelte kapitler vil være generelle anbefalinger, der bør bruges til alle kritisk syge børn.
Det er arbejdsgruppens opfattelse, at de generelle anbefalinger vil kunne tilbydes på alle landets intensivafdelinger, der lejlighedsvis modtager kritisk syge børn og skal varetage initial stabilisering og ofte livredende behandling af barnet. De mere specielle behandlingsprincipper vil kunne tilbydes kritisk syge børn på de større eller mere specialiserede afdelinger, afhængig af afdelingens kompetencer.
De enkelte kapitlers forfattere står som hovedansvarlige for indholdet. Arbejdsgruppen står dog som samlet garant for indholdet i hele anbefalingen.
– Arbejdsgruppen
FORKORTELSER
AB = Antibiotika
ABCDE = Airway, Breathing, Circulation, Disability, Environment
ACCEPT = Assess, Control, Communicate, Evaluate; Prepare & Pack, Transport
ALI = Acute Lung Injury AMK = Akut Medicinsk Koordinationscenter
APA = Association of Paediatric Anaesthetists
ARDS = Acute Respiratory Distress Syndrome
AVPU = Alert, Voice, Pain, Unresponsive
BT = Blodtryk
BS = Blodsukker
BV= Behandlingsvejledning
CC= Closing capacity
CNS = Centralnervesystem
CO = Cardiac Output
COPD = Chronic Obstructive Pulmonary Disease
CPAP = Continuous Positive Airway Pressure
CPP= Cerebral Perfusion Pressure
CT = Computertomografi (engelsk: computer tomography)
CVK = Centralvenøst Kateter
CVP = Central Venous Pressure
DAS = Difficult Airway Society
DOPES = Displacement, Obstruction, Pneumothorax, Equipment failure, Stomach
ECMO = Extracorporeal Membrane Oxygenation E
EG = Elektroencephalografi
EPAP = Expiratory Positive Airway Pressure
EPLS = European Pediatric Life Support
FATE = Focused Assessed Transthoracic Echocardiography
FiO2 = Fraction of inspired Oxygen
FRC = Functional Residual Capacity
FV = Fødselsvægt GA = Gestationsalder (engelsk: Gestational Age)
GBS = Gruppe B Streptokok
GCS = Glasgow Coma Scale
HFOV = High Frequency Oscillatory Ventilation
Hb: Hæmoglobin
ICP = Intracranial Pressure
ID= Intern Diameter
I:E ratio = Inspiratory:Expiratory ratio
ILMA = Intubationslarynxmaske (engelsk: Intubating Laryngeal Mask Airway)
i.m. = Intramuskulær
iNO = Inhaleret nitrogenoxid
i.o. = intraossøs IPAP = Inspiratory Positive Airway Pressure
IPPV = Intermittent Positive Pressure Ventilation
ISBAR = Introduktion, Situation, Baggrund, Analyse, Råd (engelsk: Identify, Situation, Background, Assesment, Recommendation)
ITA = Intensiv Terapi Afsnit
i.v.= Intravenøs
KAD = Kateter à demeure
KIM-KIT = Kan Ikke Maskeventilere – Kan Ikke Tube (=intubere)
LOS-ICU = Length of Stay in Intensive Care Unit
LRM = Lung Recruitment Manouvre
LPV= Lung Protective Ventilation
MAP = Mean Arterial Pressure
mM = millimolær, millimol/L
mmol = millimol
MRSA = MultiResistent Staphylococcus Aureus
NEC = Necrotizing EnteroColitis
NDMR = Non-Depolarizing Muscle Relaxant
NMB = Neuromuskulære Blokkere
NNT = Number Needed to Treat
PaO2 = Partial pressure of oxygen in arterial blood
PaCO2 = Partial pressure of oxygen in arterial blood
PC = Pressure Control (ventilation)
PEEP = Positive End Expiratory Pressure
PGI2 = Syntetisk prostacyclin epoprostenol (Flolan ®)
PICU = Paediatric Intensive Care Unit
PIP = Peak Inspiratory Pressure
p.n.= Pro Necessitate, efter behov
PSV = Pressure Support Ventilation
RCoA = Royal College of Anaesthetists
RCT = Randomized Controlled Trial
RF = Respirationsfrekvens
RSI = Rapid Sequence Induction / Intubation
RQ= Respirationskvotient
SBT = Spontaneous Breathing Trial
SIMV = Synchronized Intermittent Mandatory Ventilation
SIRS = Systemic Inflammatory Response Syndrome
SV= Stroke Volume, slagvolumen
Tinsp = Inspiratory Time
Texp = Expiratory Time
TLC = Total Lung Capacity
TOF = Train of Four
TV= Tidalvolumen (engelsk: Tidal Volume)
VALI = Ventilator Associated Lung Injury
VAP = Ventilator Associated Pneumonia
VC = Volume Control (ventilation)
Sprog, terminologi og layout
Det er forsøgt at efterfølge sproglige anbefalinger fra National Sundheds-IT2 , oprindeligt udviklet under Sundhedsstyrelsen som del af SNOMED-CT standarden3 . I samme reference ses også anbefaling for anvendelse for forkortelser fra Ugeskrift for læger, som er anvendt. Det har været svært at undgå engelske termer og forkortelser, der er meget udbredte. Teksten er sat med calibri. Litteraturreferencer er anført i teksten med superscript og fortløbende nummererede. Fodnoter er anført med bogstavversaler i superscript i alfabetisk rækkefølge. Tabeller og appendices er nummererede “X.Y”, hvor X refererer til kapitlet og Y placering i kapitlet. Appendices er holdt i tilhørende kapitler. Engelske udtryk er kursiveret. Referencelisten er sat med “Nature”-skabelon (som appliceret i programmet Mendeley4 version 1.10.3).
1. STABILISERING OG TRANSPORT
Forfatter: Mads Astvad
Korrespondance: mads@astvad.dk
Resumé
Organisatorisk
- Behandling af kritisk sygt barn er ofte en uvarslet opgave
- Initiel stabilisering og overflytning er klinisk kompliceret og ofte meget ressourcekrævende • Der pågår en centralisering af sygehusbehandling af børn
- Dette truer med at svække forudsætningerne for optimal resuscitering af det kritisk syge barn, der præsenterer sig på akutsygehus, der ikke er børnecenter
- Sundhedsvæsenet har en forpligtelse til at sikre niveauet for initial vurdering, stabilisering og overflytning til specialiseret center
- Der foreslås et delt ansvar mellem henvisende og modtagende afdelinger for i samarbejde fagligt og organisatorisk at forberede sig på opgaven
Klinisk
- Der må forventes speciallæge bedside ved kritisk sygt barn, herunder overflytning
- Klinisk tilgang til kritisk sygt barn følger ABCDE modellen som hos voksne, men med sygdomsspecifikke og aldersspecifikke forskelle i vurdering og behandling
- Familien bør inkluderes i hele behandlingsforløbet i videst muligt omfang
- Forudsætning for vellykket behandling er kompetencer og samarbejde
- Ledelse og procesbevidsthed er væsentlige for succes
Transportmedicinsk
- Transportmiljøet indebærer stor risiko for det kritisk syge barn
- Transportmiljøet udgør en ikke-ubetydelig risiko for sundhedspersonale
- Transport indebærer egne specifikke overvejelser og indikationer
- ACCEPT er navnet på en algoritme for struktureret tilgang til stabilisering forud for transport, for visitation og for overflytning
- Anvendelse af tjeklister ifm. transport reducerer risikoen for utilsigtede hændelser
- Henvisende behandlingsteam kan med fordel søge løbende råd fra modtagende børnecenter
- Hentehold kan bidrage til optimeret behandling og et sikrere miljø under overflytning, men fritager ikke henvisende afdelinger, herunder anæstesiologiske, fra at vedligeholde beredskab i form af materiel og kompetencer til at kunne stabilisere og i nogle tilfælde selv overflytte børn i konsultation med modtagende afdeling
Introduktion
Denne del af den børneintensive behandlingsvejledning omhandler initial stabilisering, visitation til tertiært center og overflytning og henvender sig primært til akutsygehuse uden børneintensiv afdeling. Det er skrevet med øje for de sundhedspersoner, der uventet får opgaven at håndtere det kritisk syge barn.
Det er opdelt i 2 dele:
1. Nærværende kapitel til baggrundsorientering i ‘fredstid’
2. Støttedokument til at facilitere den akutte situation. Det er udskilt i det selvstændige dokument “Stabilisering og overflytning af kritisk sygt barn” på DASAIMs hjemmeside. Det vil herefter blive omtalt som “transportskabelonen”.
Baggrundskapitlet gennemgår over de næste sider kort status for det børneintensive område i Danmark, herunder den pågående udvikling og de udfordringer, det medfører for den initielle behandling. Der gøres overvejelser om ledelse, om visitation, om transportmiljøet og sluttelig om konkrete pædiatriske ABCDE tiltag relevante for transport. Transportskabelonen består i sin nuværende form af:
- Flowchart for transportprocessen efter det såkaldte ACCEPT koncept, se senere
- Tjekliste til anvendelse umiddelbart før afgang intra- og interhospitalt
- Telefonliste med relevante danske numre, herunder til transportudbydere og tertiære centre
Lignende støttedokumenter anvendes udbredt af henteordninger for kritisk syge børn5–13.
Tanken er, at transportskabelonen anvendes i udprint hos både henvisende og modtagende afdeling. Flowchartet kan bidrage til at sikre en struktureret håndtering og forståelse af den kliniske problemstilling samt ledelse og opgavefordeling. Selve visitationen er en kommunikativ udfordring og løses bedre, hvis henvisende og modtagende/rådgivende afdeling strukturerer kommunikationen ud fra skabelonens visitationsafsnit. Transportskabelonen giver desuden anvisninger i forhold til praktisk klargøring til og gennemførsel af transport.
Den inkluderede tjekliste kan gennemløbes på få minutter og tænkes anvendt inden afgang fra afdeling / sygehus / ambulance. Der er evidens for, at tjeklister nedsætter risikoen for utilsigtede hændelser ved transport af kritisk syge14–16. Deres brug anbefales i flere officielle transportguidelines, fx britiske17, men de bør løbende tilpasses i dialog med brugerne18,19.
Der indbydes til samarbejde omkring videreudvikling af visitationsgange og støttedokumenter til fælles bedste. Der forventes fremadrettet yderligere tiltag omkring styrkelse af tidlig stabiliserende behandling og overflytning.
Guidelines kan selvfølgelig ikke erstatte relevant træning og klinisk erfaring, som bør opsøges. Der foreligger dog ikke en plan for, hvordan man nationalt og regionalt sikrer nødvendige, basale kompetencer for læger og sygeplejersker på ‘perifere’ sygehuse efter centralisering, sådan som det kendes fra udlandet20–23, hvor centralisering og henteordninger er fulgt op af for eksempel outreach training, simulationer, teamtræning og fokuserede ophold, typisk udviklet i regionalt samarbejde mellem specialiseret børnecenter og henvisende sygehuse.
Med hensyn til behandling af specifikke tilstande eller organsvigt henvises til de efterfølgende sygdoms- og organspecifikke dele af den nationale behandlingsvejledning og til gældende internationale guidelines for akutte pædiatriske tilstande24,25, som bør være velkendt og jævnligt trænet stof på alle akutsygehuse.
I en given, kompleks situation må beslutningskompetencen og prioriteringen altid ligge hos den behandlingsansvarlige kliniker hos patienten. Der bør imidlertid kunne tilbydes god støtte fra mere specialiseret afdeling i forhold til vurdering og behandling og løbende kontakt i forbindelse med stabilisering og eventuel overflytning tilskyndes.
Børneintensiv behandling i Danmark: Baggrund og trends
Sundhedsstyrelsen har gennem flere år i specialevejledningen for anæstesiologi og intensiv medicin1 lagt op til at samle al intensiv behandling af børn under 10 år på universitetssygehusene i Aalborg, Aarhus , Odense og Rigshospitalet, de såkaldte højt specialiserede funktioner. Dertil kommer afgrænsede opgaver på Hvidovre og Roskilde Sygehus, de såkaldte regionsfunktioner.
Dette afspejler den internationale udvikling og der er mange argumenter herfor. Grundliggende handler det om, at “øvelse gør mester”, både fagligt og organisatorisk. Dette begrænser sig ikke til anæstesi og intensiv medicin, men gælder lige så vel specialer som pædiatri, kirurgi og diagnostisk/terapeutisk radiologi, som alle er af afgørende betydning for det syge barn, og centraliseringen af børneintensiv og børneanæstesi betinges derfor også delvis af en lignende skridtvis centralisering af ydelser og kompetencer i de tilstødende specialer.
I nyere nationale britiske tal har knap 60% af indlæggelserne på børneintensiv afdeling karakter af “unplanned emergencies” 26. Dermed vil kritisk syge børn ofte initialt skulle behandles præhospitalt og på akutsygehuse af personale, der i takt med centraliseringen organisatorisk og fagligt mister fortrolighed med håndtering af børn, ikke mindst i det anæstesiologiske speciale på grund af den samling af elektiv børneanæstesi, der pågår. Der udtrykkes nationalt og internationalt bekymring for, hvordan man imødegår denne problemstilling, herunder sikrer kvalificeret stabilisering af det kritisk syge barn på et ikke-børnecenter og sikker overflytning til tertiært center20.
I specialeplanen står1:
- “Der skal i et tværregionalt samarbejde udfærdiges nationale vejledninger for behandling af kritisk syge børn.”,
- “Vedr. transport af børn til akut behandling på afdelinger med regions- og højt specialiserede funktioner, herunder intensiv medicinsk terapi kræves personale med kompetencer svarende til niveauet på det intensive afsnit”, og
- “Der bør etableres formelle børne-hente-ordninger tilknyttet de specialiserede enheder, som skal samarbejde om og koordinere transporterne af de kritisk syge børn i Danmark”
Aktuelt er organisering af området i Danmark langt fra at opfylde disse krav, og måden, hvorpå målet skal nås, er ikke specificeret.
Afgrænsning i forhold til pædiatri
Området er naturligvis præget af et tæt samarbejde med pædiatrien uanset barnets alder, men specifikt for nyfødte har det pædiatriske speciale eneansvar, jf specialeplanen for pædiatri27. Ligesom der forventes tæt deltagelse fra senior pædiater ved kritisk sygdom hos et ikke-neonatalt barn, hænder det, at anæstesiolog eller intensivist bliver kaldt som assistance til det dårlige nyfødte barn, herunder typisk til luftvejshåndtering og/eller respiratorisk støtte, ikke mindst på akutsygehuse uden højt specialiseret neonatal afdeling med respiratorbehandlede børn. Der er selvfølgeligt behov for et godt samarbejde med anvendelse af de bedste ressourcer baseret på kompetencer uanset speciale, og dette kan veksle betydeligt afhængigt af sted og tidpunkt.
Om den børneintensive population
For at illustrere omfanget og karakteren af den opgave, der skal løses omkring stabilisering og overflyttelse af kritisk syge børn er der søgt på statistik for dette. Nationale statistikker for den børneintensive population er imidlertid fortsat sparsomme. Af årsrapporten fra 2010 fra Dansk Intensiv Database28 fremgår registrering af 1751 indlæggelser på landets intensive afdelinger af børn (defineret som til og med 15 års alder), men tallene er tydeligt præget af indrapporteringsvarians og inkluderer også fx nogle opvågningspatienter. Parametre for udviklingen, sygdomsfordeling, tyngde og outcome mangler fortsat at blive systematisk indrapporteret og tilgængelige, ligesom det ikke er lykkedes at finde statistik for antallet af overflytninger til børneintensiv afdeling fra primære akutsygehuse.
Storbritannien har udviklet en højt valideret epidemiologisk rapportering af den børneintensive kohorte i samarbejde mellem Leicester University og Leeds University under regi af Paediatric Intensive Care Audit Network. Da landet socioøkonomisk er groft sammenligneligt med Danmark er de følgende overordnede træk fra seneste årsrapport26 formentlig dækkende også her (reproduceret med tilladelse).
Incidens
Incidensen af indlæggelse på børneintensiv afdeling er 142.5 per 100.000 leveår i børnepopulationen (<16 år), hvilket omsat til en dansk befolkning af <16 årige på 1.047.189 svarer til 1492 indlæggelser per år29.
Debut
Størstedelen af kritisk sygdom hos børn debuterer som anført uventet:
Alderssammensætning
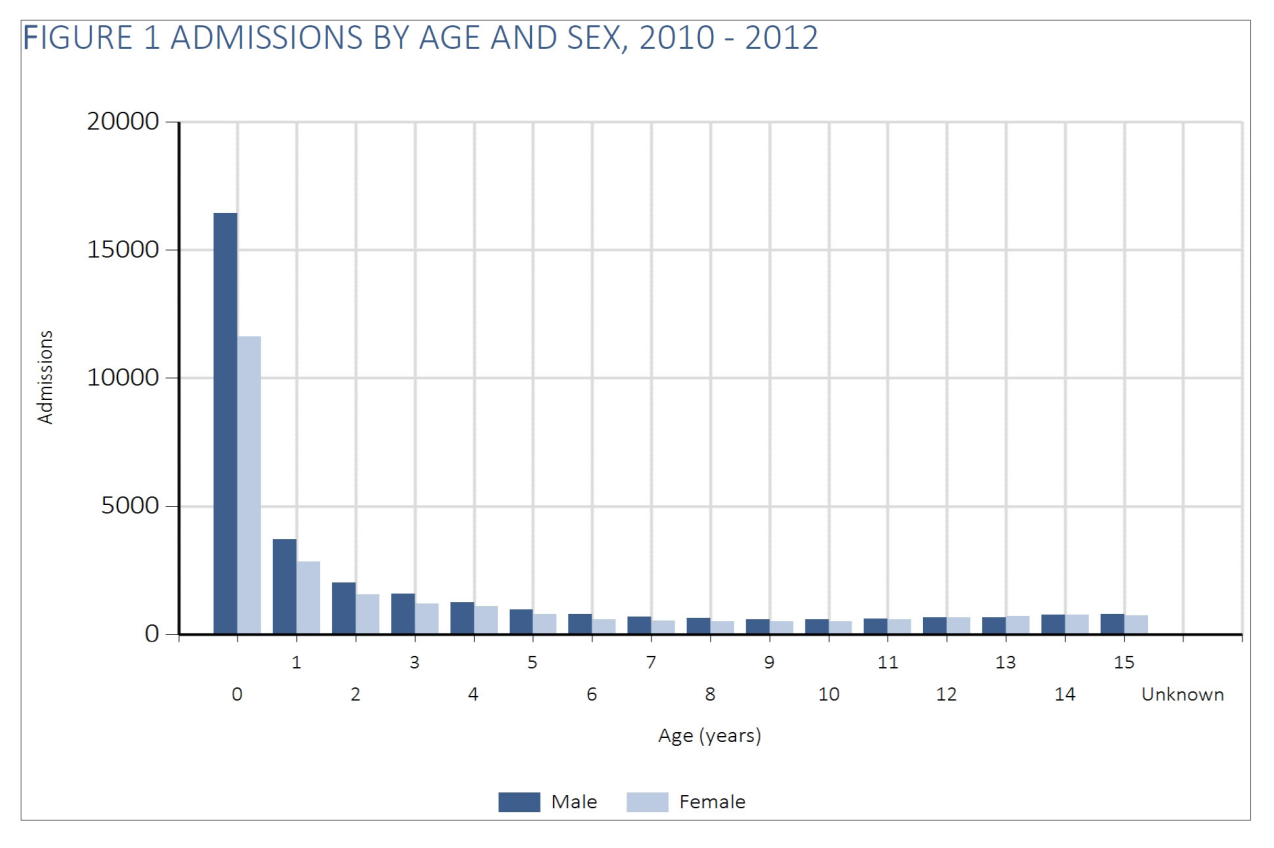
Kritisk syge børn er generelt mindre børn. Næsten halvdelen af børnene er < 1 år gamle (48%):
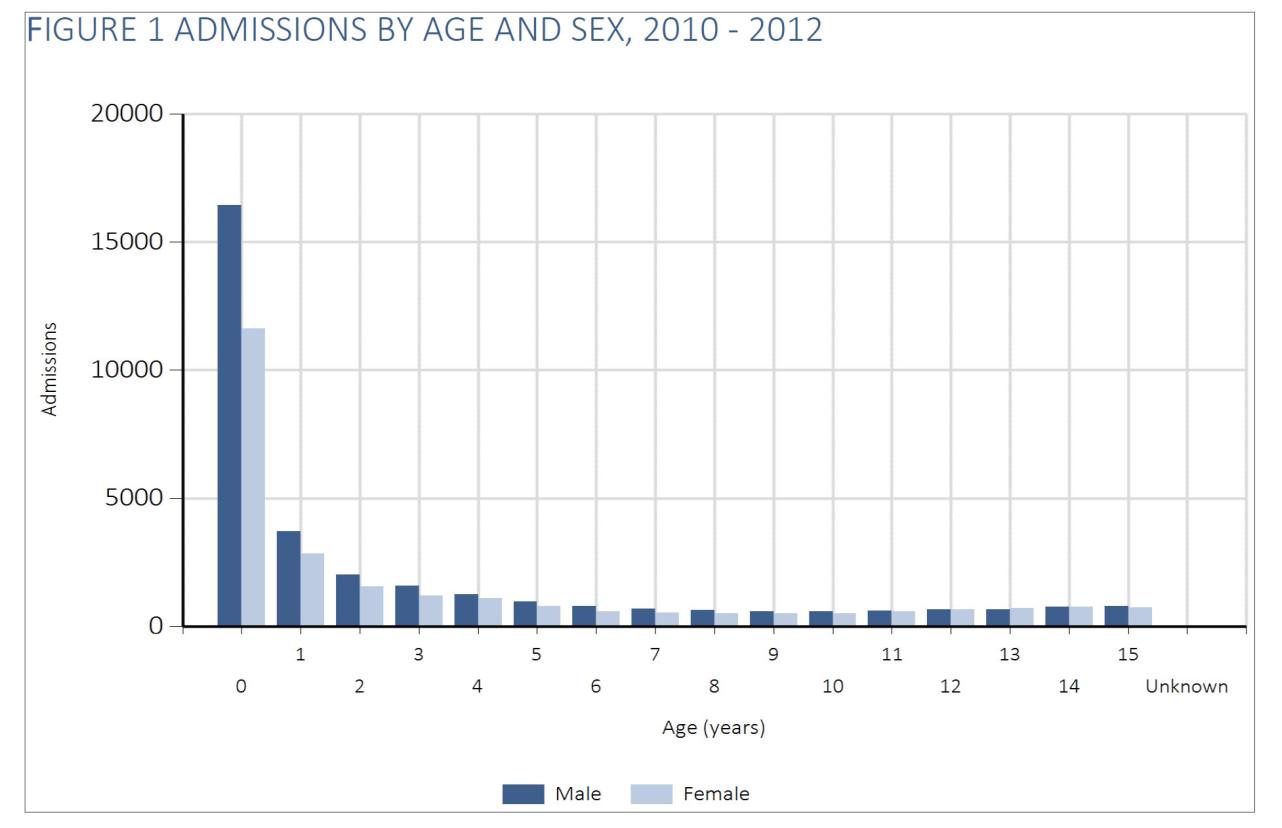
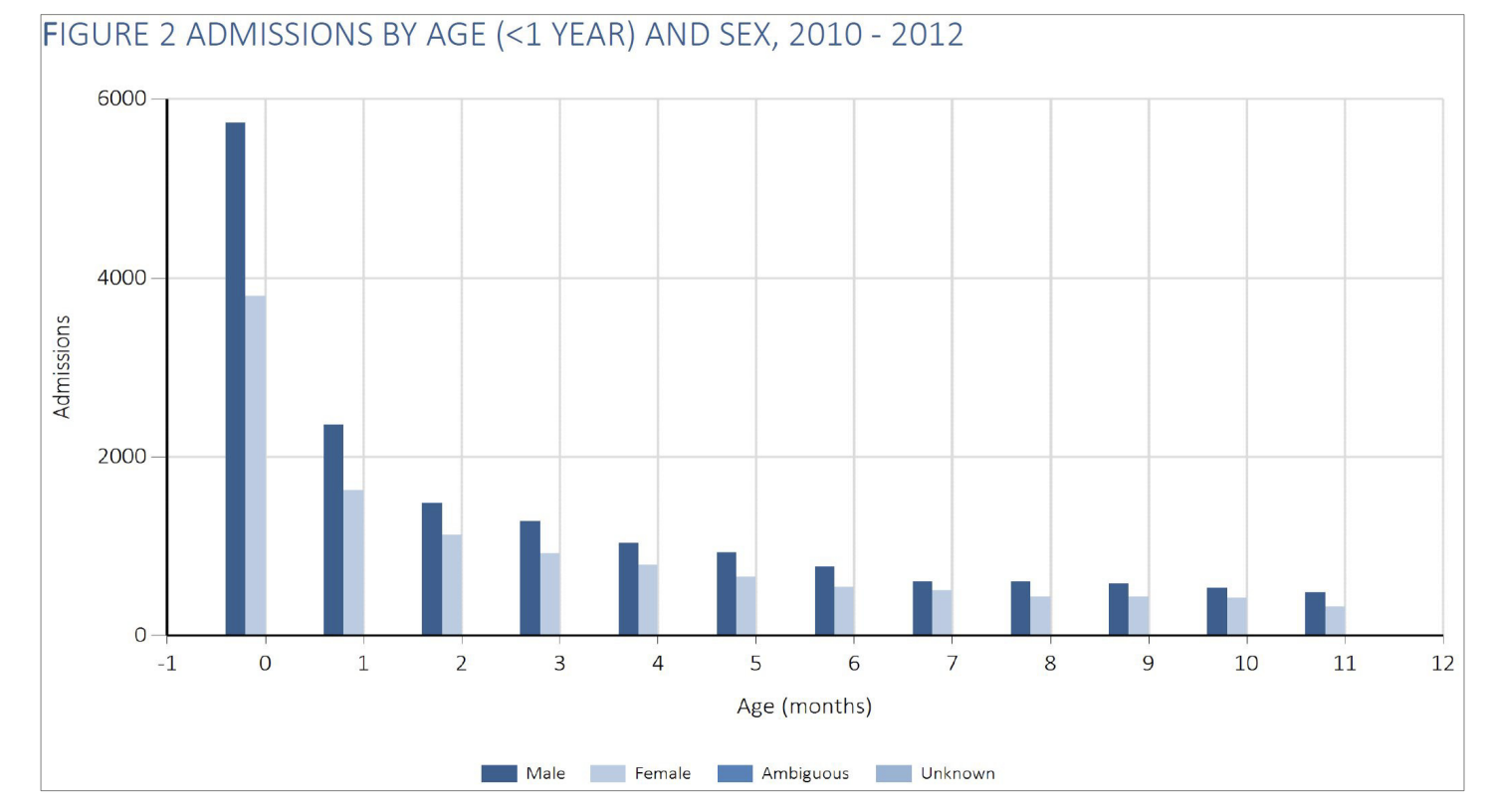
og af de 0-årige er over halvdelen under 3 mdr. gamle:
Alderssammensætning
Kritisk syge børn er generelt mindre børn. Næsten halvdelen af børnene er < 1 år gamle (48%):
Årstidsvariation
Der er en betydelig årstidsvariation:
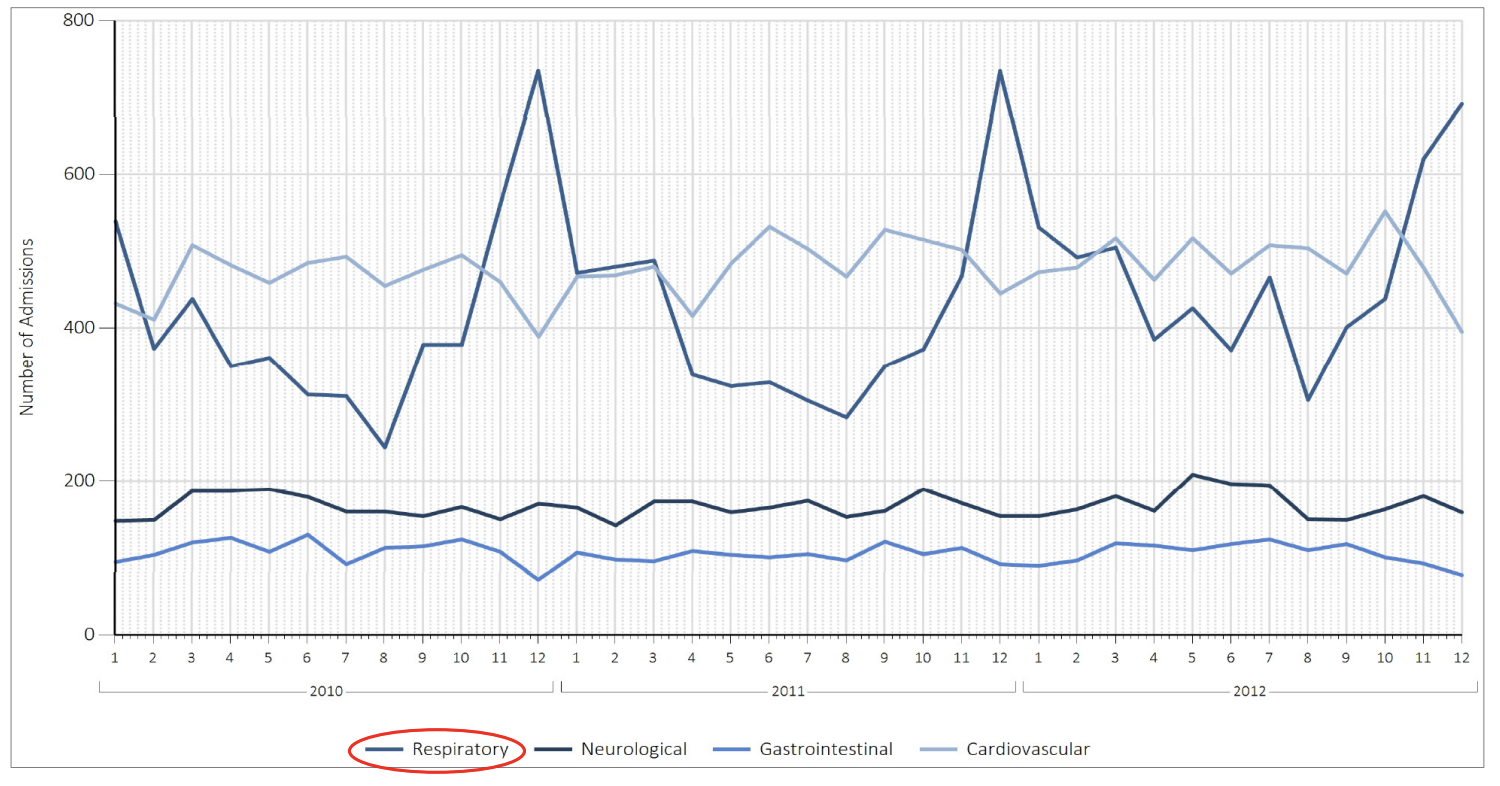
Bemærk, at dette helt overvejende skyldes respiratorisk svigt hos de <1 årige i vinterhalvåret, dvs. bronkiolitterne.
Organsvigt
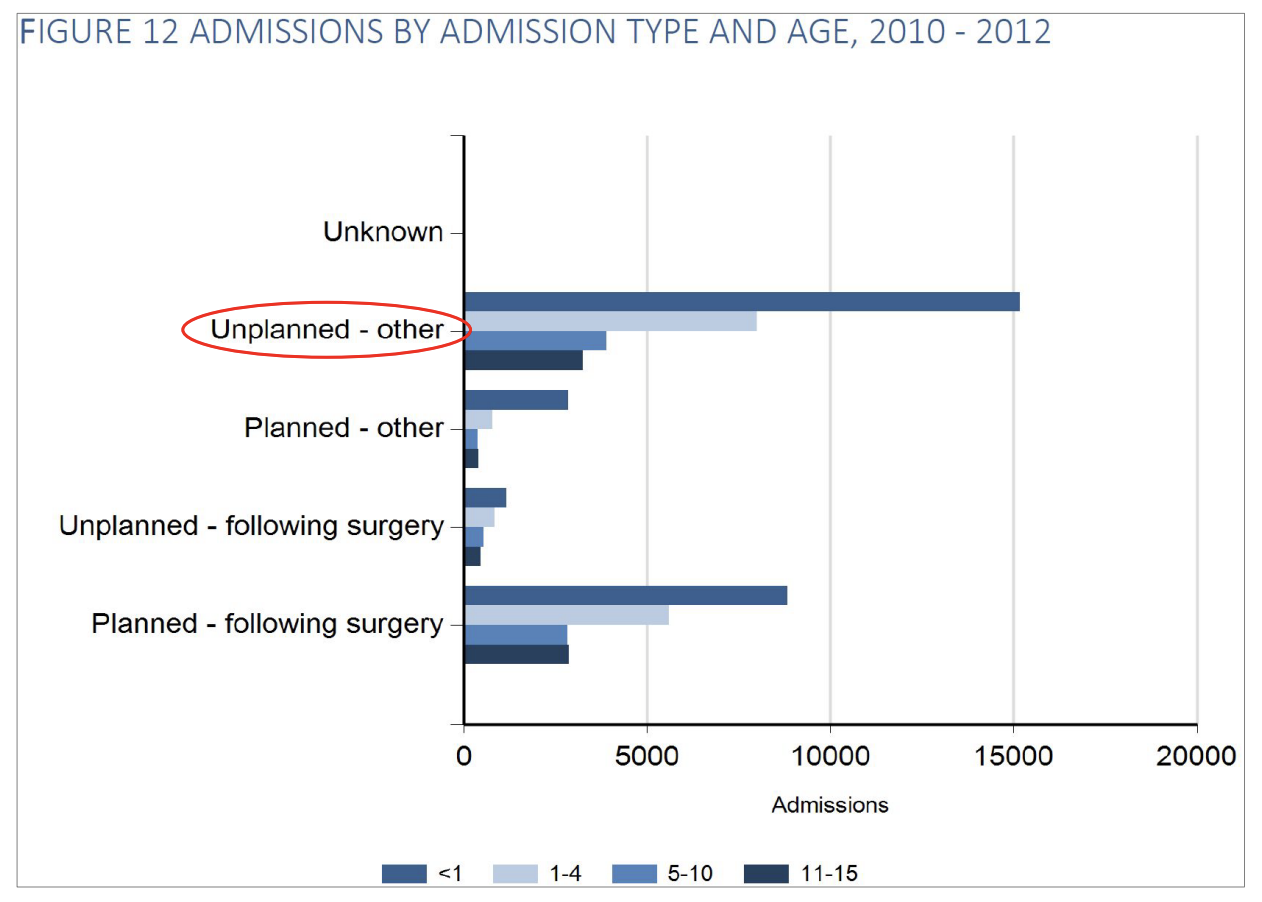
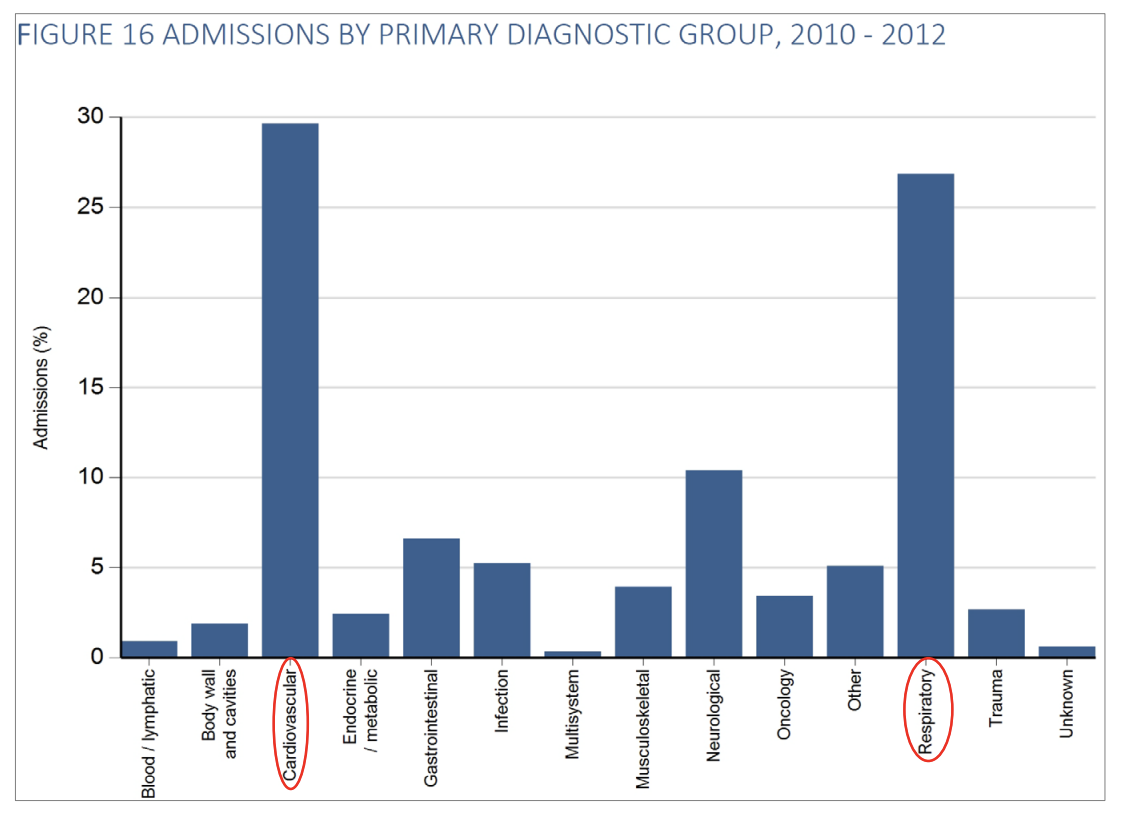
Ved debut er hyppigst registrerede årsag til indlæggelse respiratorisk eller cirkulatorisk svigt med dertil hørende støttebehov, men herudover er billedet varieret.
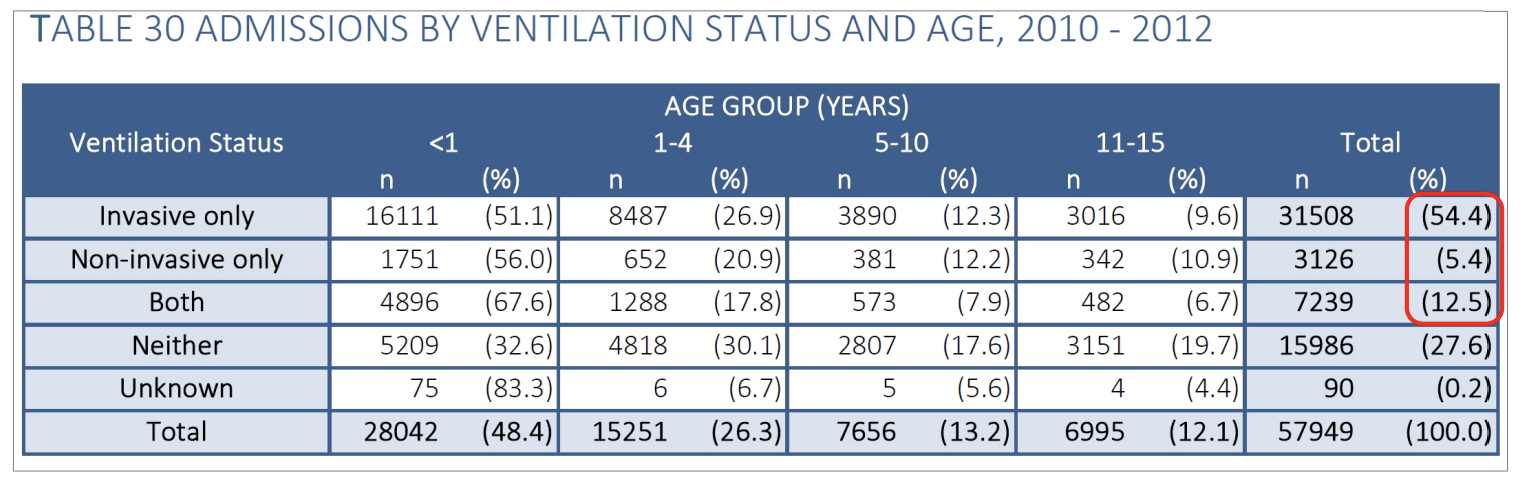
Så mange som 70% af børnene, der overflyttes, bliver ventileret under transporten:
Outcome
Mortaliteten opgjort som ‘in unit mortality’ på børneintensiv er 3,8% for hele gruppen, en anelse højere for børn <1år (4,4%) og uden kønsforskel Dette er markant lavere end i den danske voksenpopulation (30-dages mortaliteten ligger her på 28% for medicinske hhv 20% for akut kirurgiske30).
Henteordninger
Internationalt er transport til de specialiserede enheder i tiltagende grad varetaget af specialiserede børnehenteordninger. I Storbritannien drejer det sig om over 75% af børn overflyttet til børneintensiv26.
Der er stor risiko forbundet med transport af kritisk syge børn. Den internationale litteratur på området beskriver entydigt en høj frekvens af ‘adverse events’, mange af disse klinisk betydende31–34. Der er evidens for bedring af patientfysiologisk parametre og nedbringelse af antallet af hændelser, når specialiserede teams varetager transporten31,35–37 og i hvert fald et enkelt, større studie38 støtter bedring i outcome, men overførsel af sådanne fund til dansk praksis er vanskelig bl.a. qua store organisatoriske forskelle.
Specialiserede transportordninger tilbyder at flytte den børneintensive kompetence ud til barnet i stedet for omvendt39, hvilket dels indebærer mulige fordele stabiliseringen på henvisende afdeling, dels sikrer et transport-setup, der er specialindrettet til opgaven. Selv hos pædiatriske henteordninger rapporteres26 dog en frekvens af ‘critical incidents’ på 13%, hvilket blot understreger vanskelighederne forbundet med opgaven.
En fordel ved henteordninger ligger i muligheden for med volumen og kontinuitet at kunne lære af egne erfaringer og derved kvalitetsudvikle uddannelse, materiel og organisation, men også at kunne medvirke til at udvikle regionalt samarbejde og sikre niveauet hos henvisende afdelinger i forhold til organisation, faciliter, udstyr og træning. De skal således ses i en større regional kontekst.
Som ovenfor anført ønsker Sundhedsstyrelsen formelle henteordninger udviklet. Aktuelt er der følgende hentehold i Danmark, alle udgående fra de 4 universitetscentre:
- Aalborg: Tilbyder at hente børn i alle aldre hele døgnet. Neonatologer bemander det neonatologiske tilbud i dagtiden. Ved større børn og udenfor dagtid uanset alder ligger ansvaret hos børneanæstesiologisk vagthavende.
- Skejby: Neonatalt tilbud for børn med (korrigeret) alder < 3 måneder.
- Odense: Neonatalt tilbud (< 5 kg). Neonatologer bemander i dagtiden på hverdage, herudover bemandes det af anæstesien.
- Rigshospitatet: Hentehold på neonatalklinikken GN, som kan varetage transport af børn op til 1-2 år, evt. i samarbejde med børneanæstesiolog.
Det skal tilføjes, at alle transporter af patienter indlagt på intensiv afdeling i Region Hovedstaden varetages af den præhospitale organisation, som således her kan blive involveret, hvis et barn skal overflyttes efter initial stabilisering på lokal intensiv afdeling.
Som det ses er der et neonatologisk tilbud for hele landet, mens tilbuddet for større børn er mere geografisk bestemt. Der pågår arbejde med at udvide henteordningerne til større børn, men der foreligger ikke en overordnet national tidsplan herfor og det er en større organisatorisk proces. Akutsygehuse kan selv efter etablering af henteordninger risikere at skulle overflytte, for eksempel ved forfald af henteordning eller lejlighedsvis ved barnet med tidskritisk sygdom, som klassisk eksempel barnet med epiduralt hæmatom. Det må derfor tilskyndes, at man udover opgaven om stabilisering forbereder sig på at kunne løse overflytningsopgave for børn i alle størrelser.
Organisatoriske erfaringer fra udlandet
Fra Storbritanien er der publiceret flittigt om erfaringer gjort i forbindelse med centralisering af børneintensiv behandling, som der er gennemført siden midten af 1990’erne40. De har forholdt sig nøjagtig til den samme bekymring for sikring af den initielle behandling af kritisk syge børn under centralisering af det elektive volumen. En arbejdsgruppe under det britiske Department of Health med deltagelse af sygehusspecialer i berøring med børn udgav i 2006 den centrale publikation “The acutely or critically ill or injured child in the district general hospital: A team response”20, hvori det betones:
“In planning for the care of the critically sick child, the emphasis should be on:
- competencies rather than professional labels;
- team working;
- networks of care; and
- the whole pathway, from presentation to paediatric intensive care (PIC)”
Dette fokus på et fælles ansvar mellem interessenter og på hele ‘behandlingskæden’ fra sygdomspræsentation til udskrivelse fra børneintensiv synes at være en central forudsætning for at lykkes med den aktuelle forandringsproces.
Andetsteds beskrives færdigheder, som skal besiddes af alle, der behandler børn. For forskellige niveauer af sundhedsvæseneret placeres følgende forpligtelser/ansvar:
- Individet
- Ajourholde og skærpe færdigheder i behandling af børn o Gøre behandling af det akut kritisk syge barn til første prioritet
- Teamet
- Forpligtelse til at træne som hold, dvs. fx simulationer lokalt mhp. parathed til opgaven
- Organisationen
- Tilvejebringe udstyr og faciliteter nødvendige for effektiv stabilisering
- Levere mulighed for og tid til træning
Specifikt for det anæstesiologiske speciale beskrives nødvendigheden af:
-
- at sikre ikke-børnespecialiserede kollegaer løbende træning i børneanæstesiologiske færdigheder vha. fx korte udvekslinger
- deltagelse i scenarie-baseret træning i egen afdeling
- planlægning til opgaven inden den melder sig inklusiv protokolleret regionalt samarbejde
Efterfølgende har det britiske børneintensive selskab i 2010 opdateret deres standarder for behandling af kritisk syge børn41. Heri beskrives konkret og detaljeret, hvad man bør levere på forskellige niveauer i sundhedsvæsenet, herunder:
- på hospitaler generelt
- på skadestuer
- på børnemodtagelser og -afdelinger
- på anæstesiologiske afdelinger
- på hentehold, og
- på specialiserede børneintensive afdelinger
Der beskrives for hver effektmål til evaluering af opfyldelse af standarderne. Disse organisatoriske dokumenter er meget ambitiøse og der er væsentlig læring at hente i forhold til de organisatoriske udfordringer på området i Danmark.
Det må anbefales, at man regionalt og nationalt sikrer et godt samarbejde mellem alle interessenter, så man i en akut situation organisatorisk og fagligt kan løfte opgaven.
Delelementer i stabilisering og overflytning – ACCEPT konceptet
ACCEPT konceptet
Stabilisering af børn kan være en yderst krævende opgave, herunder fagligt, ressourcemæssigt, organisatorisk og ikke sjældent emotionelt. For det ikke-børnerutinerede team, der uventet får ansvar for dette, er non-technical skills som procesbevidsthed, struktur og ledelse afgørende for et godt outcome. Faglig og organisatorisk parathed hjælper, herunder relevante kompetencer personligt og som team.
Det er gavnligt at have blik for, hvor mange processer, stabilisering og visitation indebærer før transport, herunder:
- ledelse • bedside klinisk – ofte mindst 1 læge og 1-2 sygeplejersker
- medicinklargøring, herunder infusionsblandinger
- udstyrsklargøring
- telefonisk visitation og konsultation med modtagende afdeling. Ofte flere telefonkontakter • journalisering
- kopiering af papirer
- overførsel af radiologi
- bestilling af relevant transportløsning, oftest ambulance
- håndtering af familie
Mange af disse opgaver kan med fordel foregå uafhængigt og parallelt. Der bør identificeres en teamleder som overordnet ansvarlig for at styre fordelingen af opgaver til medlemmer i teamet. I det omtalte britiske policy-paper20 betones, at den ansvarlige kliniker bør gøre det til sin “sole responsibility” at stå for denne opgave. Dette signalerer, at man typisk ikke kan honorere samtidig at løse andre opgaver i afdelingen. Det vil derfor ofte være nødvendigt at indkalde supplerende personale, herunder gerne særligt børneerfarne, eller fx trække på lokale præhospitale kollegaer. Derudover skal det overvejes, hvordan de bedst mulige kompetencer til løsning af opgaven tilvejebringes, hvis de ikke allerede er sufficiente. Det må lokalt overvejes, om man bør protokollere, hvem der kaldes til kritisk sygt barn.
Struktureret håndtering af stabilisering og transport er formentlig mest systematisk beskrevet på de transportmedicinske kurser STaR (Safe Transfer and Retrieval) og det tilhørende specifikt neonatale/pædiatriske PaNSTaR (Paediatric and Neonatal Safe Transfer and Retrieval), begge udviklet under Advanced Life Support Group (www.alsg.org: not for profit charity baseret i Manchester)42.
Gruppen har udviklet et koncept med forkortelsen ACCEPT, der lidt analogt til den kliniske ABCDE identificerer aspekter, der skal overvejes og planlægges i forbindelse med transport, dog ikke nødvendigvis successivt et bogstav af gangen fra A til T. Der er ikke andre koncepter, der forholder sig så specifikt og bredt til transportopgaven, og det er bedste bud på en struktur og et fælles sprog på området.
Bogstaverne står for:
- Assessment (vurdering af situationen med fokus på patientens kliniske hovedproblem)
- Control (etablering af teamledelse og uddelegering af opgaveansvar)
- Communication (herunder med modtagende afdeling / hentehold / transportudbydere)
- Evaluation (Kan og skal barnet flyttes? Hvornår, hvordan og med hvilke kompetencer?)
- Preparation and Packaging (patient, personale og udstyr) and Pre-departure checks
- Transport (plan for selve transporten herunder håndtering af mulige problemer undervejs, overlevering af patienten, og personalets hjemtransport)
For flere detaljer henvises til reference42, manualerne og kurserne. Transportskabelonen anvender denne struktur, men henter også inspiration fra visitations- og behandlingsvejledninger hos internationale dedikerede henteordninger5–13.
Visitation og løbende konsultation
Specifikke tilstande kan give anledning til at overveje specifik destination, fx brandsår, mistanke om kongenit hjertesygdom eller forventet behov for ECMO, men generelt starter visitation mest hensigtsmæssigt i egen region. Ved neonatale patienter rettes henvendelse i det neonatale netværk, og afhentning kan typisk arrangeres, og ved de ikke-neonatale børn rettes typisk henvendelse til modtagende børneintensive afdelings bagvagt.
Der henvises til liste med kontaktoplysninger, som også skitserer børnecentrenes specialfunktioner.
Ved indledende visitation anbefales overlevering efter ISBAR modellen, som er den mest fremherskende og validerede til formålet. Sørg for at sikre, hvem der tales med. Det anbefales at have så megen information som muligt tilgængeligt, herunder patient-ID, vægt, kliniske og parakliniske værdier. Den kliniske status på barnet kan med fordel overleveres struktureret efter ‘assessment’-delen af transportskabelonen, som giver plads til at skrive detaljer. Selve visitationskommunikationen foregår som del af ‘communication’. Vær klar omkring aftaler og skriv disse ned. Det tilskyndes at konferere behandling og status løbende, og behandlingsansvarlige læge bør selv have talt med modtagende bagvagt om behandlingsstrategien og overflytning.
Det er er vigtigt at husk at aftale, hvem der koordinerer orientering og involvering af relevante specialer på modtagende sygehus (kirurgiske, medicinske, anæstesiologisk/intensive og andre), og sikre sig, at der er samtykke til overflytning hos disse.
Visitationsforløbet skal medføre en beslutning om overførsel eller ej, og hvem, der i så fald forestår denne, hvilket er ‘evaluation’-delen i transportskabelonen. Hvis henvisende afdeling påtager sig transporten, er det vigtigt at sikre lavpraktisk information som vej til modtagende afdeling og kontaktnumre begge veje. Orienter om forventet ankomst i god tid.
Rekvirering af ambulance
Der vil som hovedregel kunne leveres almindelig akutambulance. Disse bestilles hos regionens AMK vagtcentral. Bestil typisk som højeste prioritet (kørsel A), men beting dig sufficient mængde ilt. Udregn forventet minutforbrug x forventet transporttid og gang med 2 som sikkerhedsmargin. I særlige tilfælde kan det være fordelagtigt at kunne levere lav FiO2 (fx hos visse neonatale), men der skal forhøres tidligt om atmosfærisk luft, da det ikke er standard og ikke kan tilbydes af alle udbydere.
Rekvirering af helikopter
Indikation diskuteres med modtagende afdeling og (via AMK) evt. med læge på helikopteren ud fra patientens status og behov. Vær realistisk omkring logistikken. Koordinér sted, tidspunkt og forventninger.
Radiologi
Der pågår arbejde med at udvikle centrale servere, så hele landet kan udveksle radiologi uden problemer, men endnu er det sådan, at billeder ikke med sikkerhed kan overføres problemfrit mellem to givne sygehuse. Det kan alternativt forekomme at billederne, men ikke rådata, kan overføres, således at supplerende rekonstruktioner ikke kan foretages på modtagende sygehus.
Det er diagnostisk og behandlingsmæssigt uhensigtsmæssigt ikke at kunne se udført radiologi på modtagende sygehus og strålehygiejnisk uacceptabelt af den grund at skulle gentage allerede udført radiologi, så man bør tidligt sikre sig forholdene i en given overflytningssituation. Radiologi kan generelt udlæses til et elektronisk medie, fx DVD, men erfaringsmæssigt kan dette tage tid og bør derfor forudses tidligt.
Familien
Den pædiatrisk patient er en del af en familie, som i større grad end hos voksne patienter skal inkluderes og inddrages i behandling og pleje.
- Det anbefales kraftigt at lade familien komme tæt på i hele behandlingsforløbet uanset alvorligheden af situationen
- Information bør være åben og ærlig
- Der bør afsættes dedikeret person til at håndtere familien
- Forældre bør tages med på råd omkring de behandlingsvalg, der træffes, omend det i sidste ende er en lægelig beslutning (forudsat at barnet er kritisk sygt)
- Om muligt medbringes en eller flere forældre under transport
- Alternativt må der sikres mulighed for ‘på gensyn’ inden afgang
- Lav klare aftaler med forældre om transportform (de skal ikke følge efter ambulance) og destination
- Kontaktnumre til forældre er vigtige, i fald planen ændres. Forældrene bør derimod ikke ringe direkte til ambulanceteamet, men udstyres med numre på modtagende og henvisende afdelinger
Der henvises til diskussion af emnet andetsteds43–46.
Transportmiljøet
Transportmiljøet er forbundet med helt andre betingelser end hospitalsmiljøet. Der kan være stor variation i graden af kendskab til de praktiske forhold i transportmiljøet blandt andet afgjort af erfaring med præhospitalet eller forsvaret, af antal af gennemførte transporter og af relevante kurser i transportmedicin.
Ambulancetransport
Arbejdsbetingelserne er radikalt anderledes blandt andet på grund af:
- Støj • Vibrationer
- Acceleration/deceleration (op til 7G ved maksimal opbremsning)
- Kulde/varme/træk
- Trange pladsforhold
- Manglende beherskelse af layout og udstyr i ambulancen
- Ukendte samarbejdspartnere, herunder roller og kompetencer
- Manglende adgang til ikke forudset udstyr eller personelkompetencer
Dette medfører en ikke ubetydelig risiko for patient og sundhedsaktører. Velbeskrevne komplikationer inkluderer47–53:
- Nedbrud af ambulance
- Inadækvat O2-mængde eller -leveringssvigt
- Tab af 12V eller 220V-forsyning
- Nedbrud af klimafunktion
- Kollisioner: Høj mortalitet for sundhedspersoner, pårørende og patient
- Opbremsning: Personskade pga flyvende materiel
- Tab af monitorering
- Manglende eller forsinket erkendelse af klinisk ændring eller ændring i monitorværdier
- Manglende registrering af alarmer (monitor, infusionspumper og respirator)
- Tab af i.v./i.a./i.o. adgange
- Displacering af trakealtube
- Afkobling af respiratorslanger
- Afbrydelse eller utæthed af infusionsslanger og (uerkendt) leveringssvigt af sedation, glukose eller inotropi
- Afkøling af patient
- Transportsyge og deraf påvirket ydeevne af behandlende personale
- Påvirkning af kommunikation i teamet og med modtagende afdeling pga støj
Dette medfører en høj risiko for kliniske komplikationer. Problemer er sværere at erkende og erkendte problemer er sværere at løse, da transportmiljøet er uden samme redundans som hospitalsmiljøet, både med hensyn til materiel og personnel og dermed kompetencer. Af disse grunde er et bærende, overordnet princip at sikre den bedst opnåelige stabilisering inden transport på bekostning af den tid, det kræver. Der er undtagelser af mere tidskritisk karakter, hvor patienten uanset forsøg på stabilisering må forventes at forværres, fordi den grundlæggende problemstilling ikke kan håndteres lokalt, fx kirurgisk. Denne afvejning er ikke sort/hvidt, men beror på en dynamisk vurdering. Det afhænger blandt andet af problemstillingen og kompetencerne hos teamet. Der kan med fordel konfereres med modtagende afdeling om disse valg.
Inden transport bør der som princip tænkes frem og klargøres til mulige scenarier. Filosofien er “et stort problem er et lille problem, der ikke blev forudset” og “det, der kan gå galt, vil gå galt”. Procedurer, som kunne blive nødvendige en route, bør udføres inden afgang, og herunder bør ikke mindst semielektiv intubation overvejes.
Ingen kritisk syge børn bør transporteres uden som minimum sufficient luftvej, 2 i.v./i.o. adgange, passende volumenresuscitering, plan for transporten og aftale med modtagende afdeling. En afklaring af relevante behandlingstiltag kan med fordel gøres i samarbejde med modtagende afdeling.
Der bør i videst mulig omfang stabiliseres i en grad, så der ikke behøves interventioner undervejs og sundhedspersonale og evt. pårørende bør af hensyn til sikkerheden være fastspændte under kørslen og sidde i kørselsretningen. Dette gælder også udstyr, som ellers kan konverteres til projektiler ved opbremsning.
Ved behov for intervention bør ambulancen bringes til standsning og patienten stabiliseres inden transporten genoptages.
Der bør generelt køres indenfor almindelige hastighedsgrænser, da der kun spares meget lille mængde tid ved hurtigere transport og en del uheld med fatal udgang for patient og personale har kunnet tilskrives for høj hastighed. Blå blink og sirene bør kun anvendes til at komme igennem stillestående trafik.
Ambulancereddere er et vigtigt aktiv for transportholdet. Deres hjælp kan være uvurderlig i forhold til ambulanceudstyr, logistik og kommunikation, fx til modtagende afdeling eller præhospitalet i øvrigt.
Præhospitalets lægebiler kan endvidere være en partner, der ved uforudsete problemer undervejs kan køre rendez-vous. Herved tilføres speciallæge i anæstesiologi og et basalt udvalg af børneudstyr. Hvis problemer undervejs har udsigt til at kunne afhjælpes på andet sygehus (fx udstyrsproblemer), kan man overveje at køre omkring dette, som bør varskos.
Derudover må man overveje regionalt og lokalt, hvorvidt præhospitalet formaliseret skal involveres som partner omkring transporter interhospitalt.
Konkret omkring ambulanceindretning
Der er aktuelt 4 ambulanceudbydere i Danmark, men dette kan ændre sig for hver udbudsrunde. Aktuelt opererer Falck, Responce, Roskilde Brandvæsen og Københavns Brandvæsen. En ambulance til interhospitaltransport benævnes en ‘akutambulance’, også kendt som “type B” i den europæiske standard, som alle udbyderne opfylder54.
Ilt/luftbesætning
Afgøres blandt andet af vanlige transportafstande. Ved personlig kontakt til udbyderne er følgende oplyst:
- Falck
- Ilt: 2 x 10 liter (4000 liter) og variabelt antal mindre cylindre
- Luft: Kan levere airmix ved forudgående bestilling, skifter i så fald en 10liter ilt ud med 10 liter luft
- Københavns Brandvæsen
- Ilt: 1 x 10 liter (2000 liter) + 3 x 2,5 liters løse flasker (1500 liter)
- Luft:Tilbydes ikke p.t.
- Responce
- Ilt: 2 x 10 liter (2000 liter) og 2 x 2 liter (800 liter)
- Luft: Der er holder til 10liters flaske, som kan medtages fra sygehus. Blandingsaggregat ikke oplyst
- Roskilde Brandvæsen
- Ilt: 2 x 10 liter (2000 liter) og 2 x 2 liter (800 liter)
- Luft: Tilbydes p.t. kun i sengeambulance
Som princip bør man ringe i god tid og forklare, hvad der er behov for, da visse krav, herunder større iltbeholdning eller atmosfærisk luft, kan forlænge responstid for ambulancen.
Andet væsentligt udstyr i akutambulancer:
- Defibrillator
- Sug. Ofte flowdrevet – bemærk dette forbruger ilt
- BS måler
- I.v. adgange i alle størrelser
- Børneseler til liggende børn tilgængelige i alle akutambulancer (typisk PediMate™)
Til gengæld kan der være problemer med fastspænding af udstyr, med regionale forskelle, og mest udtalt, hvis der anvendes mange pumper etc. Luftbåren transport I Danmark indebærer dette i praksis helikopter i form af Præhospitalets lægehelikoptere eller Søværnets redningshelikopter. Disse kan anmodes om assistance til transport, også af kritisk syge børn. Dette kan potentielt bringe patienten hurtigere frem til modtagende afdeling, men skal holdes op imod de mulige problemstillinger, der tilkommer:
- Udfordringerne ift. støj og pladsmangel er markant mere udtalte end i ambulance. Samtale er praktisk umulig uden interkom, og monitorering afhængig af visuelle indikatorer
- Ingen mulighed for at stoppe og løse ting
- Der kræves typisk flere omlastninger af patienten, potentielt sygehus → ambulance → helikopter → ambulance → sygehus. Helipads er tilgængelige på Skejby sygehus og på Rigshospitalet
- Ekstra omlastning medfører risiko for patient. Skift af sundhedspersonale giver tab af kontinuitet.
- Tiltagende højde → faldende partialtryk af alle gasser → tendens mod hypoxæmi.
- Luft ekspanderer ved faldende tryk → ekspansion af luft i CNS, i pneumothorax, i trakealtubens cuff, i tarme (diaphragmahernier mm), i mellemørerne ved Eustachisk dysfunktion etc.
Bemærk, at sundhedsvæsenets helikopter er bemandet med speciallæge i anæstesiologi og med avanceret udstyr. Dette gør sig i mindre grad gældende for redningshelikopteren, hvor henvisende afdelings personale og udstyr dog kan medtages, men på bekostning af manglende kendskab med spilleregler og layout.
Der er desuden forskelle i, hvorhen og hvornår de forskellige helikoptere kan flyve, hvilket ligger udenfor rammerne af nærværende guideline. Der henvises til flyvemedicinsk litteratur og de enkelte udbydere.
Forslag til børneintensivt udstyr på akutsygehus
Ved planlægning af faciliteter og udstyr bør tænkes på forskellige scenarier, fx traumemodtagelse og forskellige medicinske nødsituationer, så relevant materiel er tilgængeligt relevante steder og eventuelt i mobil udgave.
Derudover anbefales at gennemtænke udstyr i forhold til forskellige størrelser børn og i forhold til overflytningsopgaven, herunder ikke mindst en egnet transportrespirator til mindre børn og evt nyfødte.
Der er anbefalinger til udstyr til luftvejshåndtering i kapitlet herom. Herudover er konkrete anbefalinger ikke formuleret, men der er yderst relevante og detaljerede anbefalinger at finde i forskellige internationale koncensusguidelines.
Der henvises særligt til
- “Standards for the care of critically ill children 4th ed.” udgivet i 2010 fra det britiske børneintensive selskab41. Udstyr fremgår af ledsagende appendices55
samt
- “Standards for children and young people in emergency care settings”, udformet i 2012 i fællesskab af britiske akutpædiatriske interessenter, herunder pædiatere, kirurger, anæstesiologer, almen medicinere, sygeplejersker og ambulanceudbydere23.
I begge udgivelser gøres meget brugbare og relevante overvejelser om organisering og indretning af faciliteter inklusiv til pårørende, og der beskrives konkrete krav til færdigheder hos aktører på sygehuse, der skal kunne løfte pædiatrisk resusciteringsopgave.
Der foreligger lignende amerikanske guidelines22 og tjekliste56, som dog synes sværere at overføre til danske forhold.
ABCDE før overflytning
Stabilisering af kritisk syge børn adskiller sig ikke principielt fra voksne. Der arbejdes struktureret og prioriteret efter den vanlige ABCDE model. Der henvises til de internationale koncensusguidelines udgivet af European Resuscitation Council og American Heart Association24,25, og det anbefales at opsøge den strukturerede træning i pædiatrisk vurdering og stabilisering baseret på disse, som tilbydes, i Danmark fx i form af European Paediatric Life Support (EPLS) kurser under Dansk Råd for Genoplivning, hvor der gennem en årrække alene i Danmark er uddannet over 700 EPLS ‘providers’. Dette giver en fælles platform og sprog for teamarbejdet. Følgende er en gennemgang er hyppige ABCDE overvejelser hos børn forud for transport, uanset hvem, der overflytter
AIRWAY
Vurdér
- Luftvejen fri/truet/sikker?
- Potentiel ABCD instabilitet under transport?
Pædiatriske overvejelser (aldersafhængig)
- Højt anteriort larynx
- Lang, blød, mobil epiglottis
- Tyndeste sted hos <8 årige er cricoideabrusken, ikke stemmelæberne
- Stort baghoved medfører tendens til fleksion i nakke
- Nogle mindre børn har tendens til ‘floppy airway’ og dermed dynamisk obstruktion
- Lille diameter i luftvej medfører dårlig tolerance for slimhindeødem (Pouiseuilles lov)
- Kort trakea giver høj risiko for ekstubation eller endobronkial intubation, inkl ved ændring af hovedstilling
Behandlingsstrategi
- Forestående transport kan være en indikation for intubation ved potentiel ABCD instabilitet, og hellere tidligt end sent, hvis indiceret. Cave sufficient resuscitering i øvrigt, herunder cirkulatorisk. Tænk over volumenstatus, induktionsstoffer og -mængde
Intubation
- Se kapitel om luftvejshåndtering for tilgang
- Klassisk RSI uegnet til mindre børn. Blid maskeventilation anbefales
- A eller B indikation: Overvej cuffet tube (tillader kontrol med volumen og tryk), tjek cufftryk
- B indikation: Så stor tube som mulig (af hensyn til ventilation og clearance af sekret)
- Kapnograf: Gøres klar inden intubation og anvendes til at bekræfte tubeplacering og kontinuert herefter
- Tubeplacering: Tjek røntgen af thorax. Tubespids ideelt mellem klavikelenderne. Tjek for komplikationer. Fixér tuben godt
- Hovedet i neutralstilling mhp. sikring af tubeplacering (særligt hos de mindste)
- Overvej paralyse af hensyn til at sikre tubeplacering i transportmiljøet. Kræver selvsagt sedation
Medicin
- Se kapitel om luftvejshåndtering
Særlige tilstande
- Traumer: Cervikalcolumna immobiliseres. Inline stabilisering som hos voksne ved intubation
BREATHING
Vurdér
- Respirationsfrekvens
- Tidalvolumina
- Respirationsarbejde
- Central cyanose
i forhold til alder og herudfra:
- Forventet udvikling og støttebehov
Pædiatriske overvejelser
- Nyfødte er obligat nasalt respirerende
- Små børns respiration er overvejende diaphragmal, hvorfor abdominal distension kan udløse respirationssvigt, herunder ved luft i ventriklen fra maskeventilation eller CPAP
- Respiratorisk dekompensering indtræder ofte abrupt og uvarslet
- Mindre børn har ca. dobbelt så højt iltforbrug per kg legemsvægt og dårlig apnøtolerance
- FRC < closing capacity hos mindre børn, hvilket giver tendens til atelektase og shunting
Behandlingsstrategi
- Hos selvventilerende uden støtte
- Vurdér løbende støttebehov
- Hav plan A og B klar til udførelse
- Hos CPAP-/ high flow-iltbehandlet barn
- Tryk og FiO2 titreres
- Vær opmærksom på højt ilt/luftforbrug ift. transport
- Skal have v-sonde
- Plan A+B klar til udførelse ved forværring
- Hos intuberet/overtryksventileret patient
- Lungeprotektiv ventilation, se kapitel om respiratorbehandling (6ml/kg, alderssvarende RF)
- Håndventilation og rekruttering frarådes generelt (svært at kontrollere tryk og volumina)
- Pneumothorax skal være dræneret
- Ventrikelsonde til frit overløb. Oral, hvis hovedtraume
- Stabilisér på transportrespirator i god tid før afgang (minimum 20 min)
- ETco2 og Paco2 måles og differensen noteres. Anvend ETco2 som trend under transport. Transkutan CO2 kan alternativt give mere præcise absolutte værdier, hvis tilgængelig57
- Kvantitativ grafisk kapnografi obligat under transport til kontrol af A+B status
- Oxygeneringssvigt efter intubation og forslag til tiltag: “DOPES”
- Displacement af tuben (tjek kapnograf)
- Obstruction over/i/under tube, fx sekret/blod/kink. (Tjek kapnograf, sug i tuben)
- Pneumothorax (tryk- eller ej?, dræneres)
- Equipment (fejlfind, mens der ventileres med “Ambu” eller C-system)
- Stomach (tøm ventriklen, sug til frit overløb)
Hvortil kan tilføjes:
- Bronchospasm (↓ RF, ↑ E:I ratio, bronkolytisk behandling)
- Stacked breaths, dvs hyperinflation ⇒ nedsat preload og kredsløbskollaps (deflatér, ↓ RF, ↑ E:I ratio, behandl obstruktion, herunder fx bronkolytisk behandling eller sugning)
- Shunt (atelektase og/eller slimpropper, øg PEEP, evt. sug +/- skylning) Shock, dvs low cardiac output state (inotropi?, volumenbolus?)
- Synchrony problem (patient modarbejder respiratoren, skift til støttemodus eller øg sedation og/eller tillæg paralyse)
Medicin
Gennemgås i kapitlerne om luftvejshåndtering og forskellige årsager til respiratorisk svigt (croup, bronchiolitis, astma).
Udstyr
- SpO2 måling og kvantitativ grafisk kapnografi er obligat under og kontinuerligt efter intubation
- Transportrespirator:
- Størrelse ift. barnet. Passer respirator, slanger og kapnograf til alder og vægt? Ofte begrænser deadspace og nedre tidalvolumina anvendelighed af almindelige transportrespiratorer til små børn. De hyppigt anvendte Dräger Oxylog respiratorer har fx følgende deadspace58,59:
- Oxylog 3000: 28-33ml uden CO2 cuvette og HME filter
- Oxylog 3000plus: 16,5 ml med CO2 cuvette (med børneslanger)
- Funktion. Tjek og indstil inden intubation. Er batteriet opladt? Virker lader?
- Neopuff: Har lavt deadspace og tillader kontrol med inspirationstryk, men binder til gengæld kliniker til patienten og må derfor generelt frarådes under transport. Konferer med modtagende afdeling
- Størrelse ift. barnet. Passer respirator, slanger og kapnograf til alder og vægt? Ofte begrænser deadspace og nedre tidalvolumina anvendelighed af almindelige transportrespiratorer til små børn. De hyppigt anvendte Dräger Oxylog respiratorer har fx følgende deadspace58,59:
- Fugter: Skal anvendes. HME eller aktiv
- Gennemløbspose (Mapleson C) og selvudfoldende (“Ambu”/”Rubens”) altid ved patienten, inkl. under transport intra/interhospitalt
- Transportsug og katetre. Medbring rigeligt. Tjek størrelse ift trakealtuber (kan de passere?).
Specifikke tilstande
- Astma: Forvent komplikationer ved og efter intubation. Se kapitlet herom.
- Bronkiolitis og pseudocroup: Se kapitler herom
CIRCULATION
Vurdér i forhold til alder
- hjertefrekvens
- blodtryk
- pulsvolumen
- perifer perfusion (kapillærfylde, hudtemperatur)
- øget preload (leverstase? halsvenestase? lungestase?)
Pædiatriske overvejelser
- Det mindre barn kan ikke øge SV meget og CO er derfor mere frekvensafhængigt
- BT er ufølsom parameter for shocktilstand, men hypotension et alvorligt alarmsignal
- Primært hjertesvigt kan nemt fejltolkes som fx respiratorisk svigt, som er hyppigere forekommende
- Gode kompensationsmekanismer, men dekompensation abrupt
- Ved traumer er der risiko for betydelig indre skade uden større ydre tegn pga eftergiveligt skelet
- Septisk shock hos børn er i forhold til voksne hyppigere hypodynamisk
Behandlingsstrategi
Cirkulatorisk strategi afhænger meget af klinisk scenarie og af barnets størrelse, se blandt andet dokument om septisk shock, der er en hyppig årsag, men der er en lang række af differentialdiagnoser hos barnet med kredsløbssvigt (strukturel hjerte/kar-sygdom, myokarditter, arytmier etc.). Det kredsløbssvigtende barn kan være vanskeligt at vurdere, ikke mindst hos de små. Konsultér med børnecenter.
- Nyfødt op til et par måneder: Overvej duktusafhængigt kredsløb. Start prostin på vid indikation
- Hypocalcæmi hyppig, korrigeres. Cave ekstravasation, anvend evt. calciumglukonat frem for CaCl
- Intubation ifm. kredsløbssvigt er risikabel, men kan bestemt være indiceret. Overvej induktionsstoffer
Kredsløbsadgange
- Venøse adgange: Ofte vanskelige at opnå. Intraossøs bør overvejes tidligt. Inden transport bør mindst 2 adgange være etableret, flere ved behov, herunder separat til bolusvæske og -medicin. Fixeres godt.
- Arteriel adgang: Ved cirkulatorisk instabilitet overvejes invasiv BT måling, men cave tidsforbrug og opgavefixation, ikke mindst hos de mindre børn
- Centralvenøs adgang: Anbefales ikke hos mindre børn, da det er tidskrævende og risikobehæftet i urutinerede hænder. Intraossøs kan overvejes til vasopressorer som alternativ, som dog også kan køre perifert initielt
Medicin
- Se kapitel om kredsløbsstøtte
- Tænk frem og bland til eventualiteter
- Alle infusioner bør tjekkes af 2 personer
- Prostin: Mulige bivirkninger inkluderer apnø, som kan kræve intubation. Infusion kræver egen i.v. adgang
Væske/volumen
- KAD anlægges hos de fleste
- Volumen: Mange, men ikke alle kritisk syge børn er initialt volumendepleterede. Ved bolus er vurdering af effekt essentiel. •
- Nyfødte/spæde: Overvej mindre bolus (5-10ml/kg), da de håndterer volumenoverload dårligt
- Vedligeholdsvæske: Kan IKKE anvendes som volumenterapi (hypotone, risiko for hyponatriæmi). Vedligehold kan typisk vente til modtagende afdeling med undtagelse af dækning af glukosebehov
- Transport: Forbered blodprodukter, væsker, varme/kolde
Specifikke tilstande
- Kongenitte hjerte/kar-sygdomme: Konferér om strategi. Prostin?
- Traumer: Stabilisering af frakturer, ekstern hæmostase, damage control kirurgi?
- Sepsis: Kan være meget volumenkrævende. Som hos voksne prioriteres hurtig dyrkning og empirisk antibakteriel / antiviral behandling. Sepsisklinik er uspecifik hos nyfødte og mindre børn, se kapitel om septisk shock. Behandl på mistanken, også for relevante differentialdiagnoser
- Brandsår: Mål for væsketerapi i samråd med modtagende afdeling
- Nyfødt: Mors blod kan anvendes til cross match forud for transfusioner. Medbring evt. EDTA blod fra mor med sufficient dokumentation (forhør om lokal politik på modtagende enhed), hvis mor ikke kan ledsage barnet, fx postpartum.
DISABILITY
Vurdér
- Pupiller
- Motorisk respons
- AVPU og/eller GCS
- Kramper
- Blodsukker
- Nakkerygstivhed og petekkier
Pædiatriske overvejelser
- Børns globale neurologi er anderledes at vurdere end voksnes. GCS er aldersafhængig. AVPU et simplere og operationelt alternativ
- Traumatisk hjerneskade og meningitis er en potentielt tidskritiske læsioner
- Børn er i højere risiko for hypoglykæmi, herunder særligt: Nyfødte, sepsis, leversvigt, metabolisk sygdom Behandlingsstrategi
- Afhænger af problemet (sepsis, neurotraume, meningitis etc)
- Hurtig radiologi om nødvendigt til afklaring af diagnose / problem
- Tidskritisk neurotrame: Skal overføres til definitiv behandling hurtigst muligt, men kræver sufficient stabilisering af luftvej og kredsløb mv.
- Krampekontrol: Se dokument herom
- CPP mål ved traumatisk hjerneskade typisk 40-50mmHg, mindst hos de små60. Konferér med neurokirurg eller børneintensivist
- ICP kontrol: Venøst afløb (30 grader eleveret, cave halsremme, lavt PEEP), sedation, paCO2 4-4,5mmHg. Undgå hyperventilation
- Hyperosmolær terapi ved neurotraume kun efter konferering med neurokirurg: Førstevalg er hyperton NaCl 3% i bolusdosis på 6,5-10ml/kg, evt med efterfølgende infusion60
- Normoxæmi
- Normotermi med enkelte undtagelser (fx hypotermi ved hypoksisk iskæmisk encephalopati hos nyfødt)
- Blodsukker i normalområde. Jævnlig kontrol. BS < 3mM kræver generelt behandling. Bolus/infusion p.n. af typisk 10% glukose
- Sedation: Til kortere (transport)formål kan propofol generelt anvendes, særlig hvis hurtig opvågning mhp. vurdering er ønskværdig. Alternativ anvendes hyppigt midazolam og morfin
- Analgesi: Bør institueres hos alle børn med smerter, eller som del af sedationsplan
- Paralyse: Overvejes af hensyn til ABC, men cave tabt neuroobservation
Medicin
- Kramper: Se kapitel herom
- 3% NaCl: Kan fremstilles af NaCl 1mM fortyndet 1:1 med sterilt vand (bliver 2,92%)
ENVIRONMENT / “EVERYTHING ELSE”
Vurdér
- Temperatur på barn, etabler kontinuert måling
- Særlige behov, fx kuvøse
- Skærmning af barnet
- Fastgørelse af barnet under transport
- Fastgørelse af udstyr
- Fastgørelse af personale og evt. ledsagere
Pædiatriske overvejelser
- Børn har større ratio mellem overflade og legemsvægt og taber derfor hurtigt varmen (des mindre barn, des mere udtalt)
- Der er betydelige fordampningstab hos neonatale, særligt præmature
Behandlingsstrategi
- Kuvøse er relevant for små børn (i praksis typisk <5kg)
- Ambulancen kan opvarmes, gerne før forflytning hertil
- Pakning af barnet, kan eventuelt svøbes
- Fastspænding er obligat, typisk med 4 punkts sele, som alle udbydere har
- Alt udstyr og behandlere skal fastspændes af hensyn til egen og patientens sikkerhed
2. LUFTVEJSHÅNDTERING AF KRITISK SYGE BØRN
Forfatter: Lasse Høgh Andersen
Korrespondance: lasse.andersen@dadlnet.dk
Resumé
Kompetence
- To personer med intubationserfaring skal være tilstede, heraf om muligt minimum én speciallæge
- Konferér med modtagende afdeling eller børneanæstesiolog for råd og vejledning
Forbered udstyr og personale
- Luftvejsvurdering: Flere specifikke syndromer samt misdannelser, der involverer ansigt og ører, indikerer høj risiko for vanskelig intubation
- Klargør sug, tungeholdere, ventilationsudstyr og Magill-tang i passende størrelser
- Fremlæg tuber og laryngoskopblade én str. større og mindre end beregnet
- Tuber med cuff kan anvendes i alle aldre og foretrækkes i akutte situationer
- Stilet bør ligge klar
- Klargør kapnograf, tubefixering og cufftrykmåler
- Klargør respirator med beregnet tidalvolumen og respirationsfrekvens samt passende filter- og slangestørrelse
- Klargør sedation til brug efter intubation
- Assistent kontrollerer udregnede medicindoser, tubestr. og –dybde
- Kontrollér i.v.-adgang og monitorering
- Formuler en plan for evt. uventet vanskelig intubation
- Nødudstyr til vanskelig intubation skal være umiddelbart tilgængeligt ved enhver luftvejshåndtering af kritisk syge børn (Appendix A)
Optimér barnets tilstand
- Forudse forværring af bestående bronkospasme efter intubation
- Forudse hypotension efter induktion og overtryksventilation, dvs. klargør/giv væske, bolus atropin og adrenalin. Ved shock eller svær sepsis bør inf. dopamin eller adrenalin opstartes på forhånd
- Overvej atropin profylaktisk før intubation til børn < 1 år, ved tilstedeværelse af bradykardi eller ved anvendelse af suxamethonium til børn < 5 år
- Præoxygenér bedst muligt
- Tøm ventriklen, hvis barnet har en sonde i forvejen samt ved ileus
- Lejring efter alder: Småbørn <1 år med hoved i neutralposition, større børn i sniffing position
Ved forventet vanskelig intubation
- Ved mistanke om vanskelig intubation anvendes teknik med bevaret spontan respiration, typisk inhalationsanæstesi.
Procedure ved i.v. induktion
- Sørg for adækvat anæstesidybde. Det letter både maskeventilation og intubation
- Overvej S-ketamin som anæstesimiddel ved shock
- Undgå etomidat ved septisk shock
- Ved i.v. induktion anvendes altid muskelrelaksans; enten rocuronium eller suxamethonium
- Intubér oralt i akutte situationer
- Prioritér oxygenering: Maskeventilér før og mellem intubationsforsøg, også under akut indledning
- Intubationsforsøg afbrydes senest efter 30 sekunder samt ved bradykardi eller desaturation
Ved uventet vanskelig intubation
-
- Prioritér oxygenering. Begræns antallet af intubationsforsøg. LMA er førstevalg som rescue device. (Appendix B + C)
- KIM-KIT: Invasiv teknik er indiceret ved hypoksisk udløst hjertestop. Udføres ideelt set af ØNH-læge. Nåle-cricothyreotomi kan forsøges i alle aldre (gennem trachea hos børn < 1 år) (Appendix D)
- Efter vellykket intubation
- Bekræft korrekt tubeplacering med kapnograf (obligatorisk), stetoskopi og ved tvivl re-laryngoskopi. Tag røntgen af thorax: Tubespidsen bør ligge mellem claviklerne.
- Fiksér tuben omhyggeligt
- Kontrollér cuff-tryk < 20-30 cmH2O
- Ved akut hypoksi efter intubation kan anvendes huskereglen “DOPES”: Displacement, Obstruction, Pneumothorax, Equiment failure, Stomach
Afgrænsning af emnet
Denne vejledning omhandler luftvejshåndtering af kritisk syge børn med behov for intensiv terapi. Den omhandler ikke luftvejshåndtering til elektive procedurer. Der fokuseres primært på sikring af luftvejen ved intubation, men maskeventilation og nødteknikker ved vanskelig intubation omtales også. Elektiv tracheotomi ved langvarig respiratorbehandling ligger udenfor vejledningens emneområde. Principperne i vejledningen gælder for børn i alle aldre.
Baggrund
Anatomi og fysiologi
Børns luftveje er både mindre dimensionerede og anderledes proportionerede end voksnes. Forskellene aftager med alderen. Hos de mindste børn baghovedet prominerende, hvilket der skal tages hensyn til under lejring. Tungen er relativt stor og kan obstruere luftvejen. Epiglottis er lang og smal og prominerer ind i luftvejen. Hos småbørn er mandiblen er kort og larynx højtliggende hvilket kan vanskeliggøre laryngoskopi. Hele luftvejen er let kompressibel og kan obstrueres bl.a. ved kompression af den bløde mundbund under maskeventilation. Luftvejen er sårbar for irritation, og larynx- og bronkospasme opstår let ved stimulation under overfladisk anæstesi. Ødem eller sekreter medfører lettere obstruktion pga. de mindre dimensioner. Hypoksi opstår hurtigt under apnø som følge af højt iltforbrug og lav funktionel residualkapacitet. Den ledsagende bradykardi kan medføre kredsløbsshock hos småbørn, da hjertets minutvolumen hos disse primært er frekvensafhængigt61–64.
Kompetence
Intubation af kritisk syge børn er en højrisiko-procedure, der ideelt set udføres af rutineret personale efter omhyggelig forberedelse i et miljø, hvor ekstra hænder og hjælpemidler er umiddelbart tilgængelige. Hvis barnets kliniske tilstand fordrer, at intubation udføres under suboptimale omstændigheder, er regel nummer ét at kalde hjælp tidligt. Der bør altid være minimum to personer med intubationserfaring tilstede, og om muligt skal mindst én af disse være speciallæge i anæstesiologi. På afdelinger, der ikke har decideret børneanæstesiologisk funktion, kan man – om tid haves – konferere med modtagende børneintensive specialafdeling eller børneanæstesiolog for råd og vejledning. Trods risikoen for komplikationer ved luftvejshåndtering af kritisk syge børn, skal det dog understreges, at proceduren er potentielt livreddende og samlet set bærer en høj succesrate. Påkrævet luftvejshåndtering af et kritisk sygt barn må ikke udsættes pga. manglende daglig erfaring med aldergruppen.
Anæstesilæger, der sjældent intuberer børn, bør vedligeholde deres færdigheder ved hjælp af simulationstræning65.
Komplikationer
Selv i øvede hænder er risikoen for komplikationer til luftvejshåndtering af kritisk syge børn betragtelig, og den er betydeligt højere end ved elektive procedurer66. De fleste børn > 1 år er nemme at intubere, men desaturerer hurtigt ved vanskeligheder62,63,67,68. Jo yngre des hurtigere og hyppigere indtræder hypoksi, der er den hyppigste komplikation61,69,70. Øvrige komplikationer er, som hos voksne intensivpatienter, hypotension, arytmi, aspiration, uerkendt endobronchial intubation, barotraumer og fysiske traumer på luftvejen. Risikoen for larynx- og bronkospasme er forhøjet især ved nylig luftvejsinfektion. Trachealtuber displaceres let både opad og nedad. Luft i ventriklen kan kompromittere både spontan og kontrolleret ventilation betydeligt hos mindre børn.
Ved hypoksi efter intubation kan huskereglen “DOPES” benyttes25:
- D: Displacement (til øsofagus, svælg eller hovedbronchus)
- O: Obstruction
- P: Pneumothorax
- E: Equipment failure
- S: Stomach (luft i ventriklen)
Overvej også: Bronkospasme, aspiration, atelektase, shuntning, respirator-dyssynkroni, hjertesvigt mv.71
Forberedelse
Forberedelse inkl. valg af korrekt dimensioneret udstyr, grundig præoxygenering og en prædefineret strategi er nøglen til succes ved intubation af børn61,62,72.
Luftvejsvurdering
Børn der må intuberes i skadestue og på intensiv afdeling er i højere risiko for komplikationer under luftvejshåndtering end børn, der intuberes på operationsgangen61,72. Det anbefales altid at vurdere luftvejen kritisk og kalde hjælp på forhånd ved mistanke om potentielle vanskeligheder.
Særlige prædiktorer for vanskelig intubation af børn61,64,67,68:
- Intubatør med sparsom børneanæstesiologisk erfaring
- Patientalder < 1 år
- Undervægt
- Mandibel-hypoplasi
- Begrænset mundåbning
- Stor tunge
- Misdannelser, der involverer ansigt eller ører
- Hjerte- og ØNH-kirurgiske patienter
- Specifikke syndromer: Pierre Robin, Treacher Collins, Goldenhar, Apert, mucopolysaccharidoser mfl.
Hertil kommer almene risikofaktorer fælles med voksne, fx tidligere vanskelig intubation, Mallampati score ≥3 (vanskeligt at vurdere på børn, især ved kritisk sygdom), tonsilhypertrofi, nedsat bevægelighed af nakken, fedme, søvnapnø, traumer i og omkring luftvejen, epiglottitis, anafylaksi, inhalationsskader osv.
Strategi for luftvejshåndtering
På baggrund af luftvesjvurdering, barnets tilstand og lokale ressourcer træffes valg vedrørende strategi for håndtering af luftvejen. Ved forventet vanskelig intubation bør luftvejshåndtering foretages ved teknik med bevaret spontan respiration, typisk under inhalationsanæstesi (se nedenfor).
De følgende afsnit omhandler primært forhold ved planlagt i.v. induktion.
Plan B
Der bør på forhånd formuleres en plan for, hvad man vil gøre, hvis intubationen viser sig at være vanskelig eller at medføre komplikationer. Planen skal aftales med teamet, før proceduren indledes.
Udstyr, medicin og væske
Følgende udstyr bør ideelt set ligge klargjort på stuen:
- Laryngoskoper, to stk. med fungerende lys
- Minimum to størrelser laryngoskopblade
- Nødudstyr umiddelbart tilgængeligt fx placeret i vanskelig-luftvejsvogn. Udstyret bør som minimum omfatte larynxmaske, bougie/tube exchanger og sæt til invasiv teknik ved KIM-KIT situation. Børne-videolaryngoskop og –fiberskop anbefales. (Appendix A)
- Tube i den valgte størrelse samt 0.5 mm mindre og større
- Medicin optrukket i forudberegnede doser herunder også atropin og adrenalin
- Stilet + gel
- Magill-tang i børnestr.
- Tungeholdere
- Sug klargjort med stort sugekatheter (orale sekreter/blødning) samt et mindre af passende str. i fht. tubestørrelsen
- i.v.-adgang, mininum én velfungerende, velfixeret og tilsluttet NaCl eller Ringer-laktat
- Maske + ventilationspose tilsluttet iltudtag
- Monitorering med minimum EKG, BT (passende manchetstr.) og SpO2
- Kapnograf eller -meter
- Cuff-trykmåler
- Respirator klargjort og indstillet på beregnet tidalvolumen og respirationsfrekvens med passende filter- og slangestørrelse (børneslanger anvendes typisk < 20-25 kg)
- Tubefiksering klargjort
- Sedation klargjort til efter intubation
- Hvis barnet er septisk eller kredsløbspåvirket, bør dopamin eller adrenalin opblandet efter vægt klargøres før intubation
Personale
Følgende personale bør ideelt set være tilstede:
- To personer med intubationserfaring, heraf om muligt minimum én speciallæge i anæstesi
- Sygeplejerske (anæstesi- eller intensiv-), gerne to
Indbyrdes rollefordeling skal aftales inden proceduren indledes: Medicinindgift, primær intubatør, sekundær intubatør, holde øje med skop, betjene respirator og kapnograf, hente ekstraudstyr, tage sig af forældre
Lejring
Skab plads omkring sengen. Småbørn tilgås lettest ved lejring på tværs af sengen i en akut situation. Ved større børn eleveres hovedgærdet let under præoxygenering.
Spædbørns lejres med hovedet i neutral position, hvilket hos nyfødte kan opnås ved at placere en tynd pølle under skuldrene. Større børns (> 1 år) luftvej åbnes ved let ekstension (head tilt) af nakken, medmindre der er mistanke om skade på columna cervicalis, og over 5-6 år lejres evt. i sniffing position. Under maskeventilation anvendes chin lift og jaw thrust i alle aldre. Munden skal være let åben, og tungen fri af ganen25,64.
Optimering af vitale organfunktioner
Præoxygenering
Forsøg altid at præoxygenere med 100% O2 på tætsiddende maske i 3 minutter. Undgå dog at påtvinge et vågent barnet iltmasken, hvis det sætter sig kraftigt til modværge, idet gråd og angst blot medfører øget sekretion, luftfyldt ventrikel og hurtigere desaturation. Anvend i stedet flow by ilt i disse tilfælde. Nogle vågne børn accepterer masken, hvis de må holde den selv. Andre børn kan præoxygeneres efter let sedation med fx en lille dosis fentanyl eller s-ketamin.
Respiration
Ved hypoventilation støtteventileres under forberedelse af intubation. Non-invasiv ventilation kan også anvendes som præoxygenering. Astma behandles aggressivt, og forværring af bronkospasme efter intubation må forudses.
Kredsløb
Anæstesiinduktion og overtryksventilation medfører kredsløbskollaps hos hypovolæme og præshockerede børn. Korrigér hypovolæmi før intubation. Ved sepsis eller kredsløbspåvirkning af anden årsag bør dopamin eller adrenalin opblandes efter vægt før intubation og opstartes før manifest kredsløbssvigt.
Barn og forældre
Forældre kan ønske at være tilstede. De bør i så fald være grundigt informeret om proceduren, og der skal være afsat en person til at tage sig af dem. Barnet informeres evt. ud fra alder og omstændigheder.
Maskeventilation
Maskeventilation benyttes om påkrævet, mens intubation forberedes. Der maskeventileres rutinemæssigt efter anæstesiinduktion for at undgå desaturation. Ved vanskelig intubation maskeventileres mellem intubationsforsøg.
Teknik
Undgå at komprimere den bløde mundbund, da dette medfører luftvejsobstruktion. Ventilér forsigtigt ca. 1 sekund pr. indblæsning indtil moderat thoraxløft med en frekvens lavt i det alderssvarende normalområde. Andre foretrækker at ventilere med hurtige, små indlæsninger. Uanset teknik skal kraftfulde indblæsninger undgås, da dette kan medføre luft-insufflation i ventriklen og følgeligt kompromitteret ventilation samt øget aspirationsrisiko 25. Pga. tendens til hurtig desaturation anbefales forsigtig maskeventilation også under akut indledning. Maskeventilation bør som minimum påbegyndes senest når SpO2 falder til 95%, hvis hypoksi skal undgås61,69.
Udstyr
Masken skal dække næse og mund tætsiddende uden at dække øjnene. Masker af klart materiale foretrækkes, da disse er mindre skræmmende for barnet, og tillader inspektion af luftvejen under brug.
Ventilationspose-størrelse vejledende:
- Vægt <15 kg: 0,5 l.
- Vægt >15 kg: 1,0 l.
- Voksen: 2,0 l.
Hjælpemidler
- Oral airway: Længde udmåles fra fortænder til lige under angulus mandibulae. Indsættes hos småbørn med den konkave side nedad evt. ved hjælp af en tungespatel. Uegnet til vågne patienter.
- Nasal airway: Længde udregnes fra næsefløj til øreflip. Anvend en ucuffet tube str. 4.0-4.5 (eller 1.0 mindre end alderssvarende oral tube). Skal lubrikeres. Kan med fordel indføres over et sugekatheter som guide. Forsigtighed ved mistanke om fraktur af basis cranii eller mellemansigtet samt ved hæmorragisk diatese.
- Håndgreb: Chin lift og jaw thrust
- To-personers maskeventilation
- Sug: Skal altid findes klargjort. Tøm ventriklen (stort sug 10-12 F) ved vanskelig maskeventilation. Risiko for larynxspasme og vagus-stimulation ved insufficient anæstesidybde.
- Sugekatheter-størrelse: Afpasses tubestørrelse. Vejledende:
- Præmatur: 5-6 F
- Neonatal: 6-7 F
- 0-3 år: 8 F
- 4-8 år: 10 F
- >10 år: 12 F
- Sugekatheter-størrelse: Afpasses tubestørrelse. Vejledende:
- Farmaka: Insufficient anæstesidybde kan medføre larynxspasme, aspiration og vanskelig maskeventilation. Adækvat anæstesidybde samt muskelrelaksation kan bidrage til at løse disse problemer62.
Vanskelig maskeventilation
Vanskelig maskeventilation er sjældent og skyldes som regel dårlig teknik eller insufficient anæstesidybde. Umulig maskeventilation hos børn er uhyre sjældent61,62,68. Anvend ovennævnte hjælpemidler. Se Appendix B for forslag til algoritme. Larynxspasme behandles med CPAP, chin lift, bolus propofol 1 mg/kg og/eller muskelrelaksans, fx en lav dosis suxamethonium 0,3 mg/kg i.v.62,64
Intubation
Anæstesivalg
Ved mistanke om vanskelig intubation vælges teknik med bevaret spontan respiration, typisk inhalationsanæstesi, hvorunder intubation udføres med fiberskop eller ved direkte laryngoskopi. Til øvrige anvendes i.v. anæstesi, og følgende forhold skal da overvejes:
- Ved i.v. anæstesi anvendes altid muskelrelaksans, da dette giver optimale intubationsforhold62,73
- Rocuronium og suxamethonium er ligeværdige som relaksans, hvis der anvendes høj dosis af førstnævnte. Obs. kontraindikationer for suxamethonium som fx hyperkaliæmi, brandsår, og kroniske neuromuskulære tilstande inkl. langvarig immobilisation, hvor rocuronium bør foretrækkes74
- Atropin i.v. bør overvejes profylaktisk til børn < 1 år, ved anvendelse af suxamethonium på børn < 5 år samt ved bradykardi forud for intubation75–77
- Foretag en afbalancering af sedationsbehovet versus risikoen for hæmodynamisk påvirkning. Et semicomatøst barn med septisk shock bør ikke gives en stor dosis anæstesimiddel. Anvend evt. S-ketamin ved shock78
- Etomidat frarådes ved septisk shock pga. risikoen for binyrebark-suppression78
- Tag hensyn til forhøjet ICP
- Klargør væske, atropin og inotropi til behandling af kredsløbskollaps forårsaget af anæstesi- og overtryksventilation.
Vejledende doser for en række relevante stoffer
Generelt vælges lave doser til kritisk syge børn.
Hypnotika
- Propofol: Bolus 2-5 mg/kg + 0,5 mg/kg p.n. i.v.
- Thiopental: Bolus 3-8 mg/kg + 1 mg/kg p.n. i.v.
- S-Ketamin: Bolus 1-2 mg/kg + 0,25 mg/kg p.n. i.v.
- Midazolam: Bolus 0,1-0,3 mg/kg + 0,05 mg/kg p.n. i.v.
Relaksans
- Suxamethonium: Bolus 1,5 mg/kg i.v., gentages ikke
- Rocuronium: Bolus 0,6 mg/kg (-1,0 mg/kg ved akut indledning) + 0,15 mg/kg i.v. p.n.
Opioid
- Morfin: Bolus 0,1 mg/kg + 0,05 mg/kg i.v. p.n.
- Fentantyl: Bolus 2-4 µg/kg + 1-2 µg/kg i.v. p.n.
- Alfentanil: Bolus 10-20 µg/kg + 5 µg/kg i.v. p.n.
Antidoter
- Atropin: 20 µg/kg (maximum 1 mg) i.v. p.n.
- Adrenalin: 10 µg/kg i.v. (ved hjertestop)
- Sugammadex: 2 mg/kg (rutine-revertering) – 16 mg/kg (straks-revertering) i.v. NB: Sparsom erfaring hos børn
- Naloxon: 0,01 mg/kg (max 0,8 mg/dosis) i.v.
- Flumazenil: 0,01 mg/kg (max 0,2 mg/dosis) i.v.
Væskebolus ved hypotension:
- 20 ml/kg krystalloid i.v.
Tubestørrelse og –dybde
Vejledende tubestørrelse og –placering kan udregnes ud fra nedenstående formler, men bør altid vurderes klinisk. Børn, der er meget små eller store i forhold til alderen, vil kræve justering, anvend bedste skøn. Beregn ud fra alder i år:
Tubestørrelse for cuffede tuber (ID mm):
- Spædbørn: 3.0-3.5 mm
- Alder 1-2 år: 3.5-4.0 mm
- Alder > 2 år: (Alder/4) + 3,5
Tubestørrelse for ucuffede tuber (ID mm): (0.5 mm større end ovenstående)
Tubedybde oralt (cm):
- Børn < 3 år: Tubedybde (cm) = 3 x tubediameter (mm)
- Børn > 3 år: (Alder/2) + 12
Tubedybde nasalt (cm):
- Børn < 3 år: Tubedybde (cm) = (3 x tubediameter (mm)) + 2-3
- Børn > 3 år: (Alder/2) + 15
Tube-valg
Tube med cuff foretrækkes i akutte situationer til kritisk syge børn. Cuff-tryk skal holdes < 20(-30) cmH2O79,80.
Intubationsrute
Kritisk syge børn intuberes under den akutte resuscitation og ved akut reintubation som hovedregel oralt. Omlægning til nasal tubeplacering kan altid udføres i rolig fase, hvis det findes indiceret<subp25,72,81.
Laryngoskopblad
Til neonatale anvendes ofte Miller-blad (lige blad), men Macintosh-blad (buet) kan også anvendes, og valget er et spørgsmål om personlig præference. Efter neonatalperioden anvendes som hovedregel Macintosh-blad.
Vejledende:
- Præmatur – 3 mdr.: Miller 0 eller Macintosh 0
- 0 – 2 år: Macintosh 1 eller Miller 1
- 2 – 10 år: Macintosh 2
- >10 år: Macintosh 3
Sikker akut indledning
Kritisk syge børn er som udgangspunkt ikke fastende og dermed i risiko for aspiration under anæstesi. Hos børn medfører traditionel Rapid Sequence Induction (RSI) med undladelse af maskeventilation dog hyppigt hypoksi. Man bør derfor maskeventilere forsigtigt også under RSI hos børn. Dyb sedation og adækvat muskelrelaksation medvirker til at mindske aspirationsrisikoen61,62. Cricoideatryk medfører sandsynligvis ingen fordele og kan medføre vanskelig ventilation og intubation, hvorfor det ofte ikke anvendes.
Intubationsproceduren
- Forbered udstyr, roller og plan B systematisk. Anvend gerne en tjekliste (fx resuméet i denne vejledning)
- Vurdér barnets luftvej og tidligere journal mhp. vanskelig intubation og maskeventilation
- Tag stilling til aspirations-risiko. Tøm ventriklen, hvis barnet har sonde i forvejen. Læg kun sonde før induktion hvis barnet har ileus
- Udregn medicindoser og udstyrsstørrelser og få en kollega til at tjekke dem
- Bekræft passende og fungerende monitorering inkl. tilstedeværelse af kapnograf/-meter
- Bekræft funktion af laryngoskop, sug, iltudtag og maskeventilationsudstyr
- Kontrollér i.v.-adgang og indstilling af trevejshaner
- Stilet er ikke obligat men bør ligge klar
- Optimal lejring af barnet i forhold til alderen
- Præoxygenér 3 minutter med 100% O2 (efter bedste evne)
- Maskeventilér forsigtigt efter induktion og mellem intubationsforsøg – også under rapid sequence induction
- Intubationsforsøg afbrydes ved bradykardi (hjertefrekvens < 60), desaturation (SpO2 < 90%) og efter senest 30 sekunder. Genoptag forsigtig maskeventilation og overvej hvordan næste forsøg optimeres. Bradykardi kan skyldes vagal stimulation, men bør betragtes som hypoksiudløst, indtil det modsatte er bevist.
- Anvend ekstern larynx-manipulation til at bedre indblik til glottis
Efter vellykket intubation
- Bekræft korrekt tubeplacering med kapnograf (obligatorisk), stetoskopi og ved tvivl evt. re-laryngoskopi25,63
- Fiksér tuben omhyggeligt. Utilsigtet ekstubation hænder let hos børn.
- Revurdér barnets status (ABCDE) med fokus på evt. komplikationer til intubationen, navnligt respiratorisk og cirkulatorisk.
- Kontrollér cuff-tryk. Bør være < 20-30 cmH2O.
- Tag røntgen af thorax mhp. kontrol af tubeplacering, helst inden evt. overflytning. Tubespidsen bør ligge mellem claviklerne. Uerkendt endobronchial intubation er ikke sjældent hos børn og kan ikke udelukkes med stetoskopi alene63,72
- Dokumentér proceduren i journalen.
Alternative intubations-teknikker
Videolaryngoskop
Videolaryngoskoper kan bedre indblikket til glottis, men evidensen for brug hos børn er endnu sparsom. Udvalget af devices øges hastigt. Specifikke pædiatriske devices, der kan benyttes i alle aldre, er videolaryngoskoperne GlideScope Cobalt og Storz DCI, Storz C-MAC samt de indirekte optiske skoper Airtraq og Truview. Det udbredte McGrath Series 5 videolaryngoskop kan anvendes hos børn fra ca. 30 kg og opefter. Der kræves et vist erfaringsgrundlag med hver enkelt model for optimal succesrate68,82,83.
Supraglottisk airway
Larynxmaske (LMA) eller tilsvarende supraglottiske airway devices kan anvendes som midlertidigt alternativ ved svigtende oxygenering under uventet vanskelig intubation, men udgør ikke en sikker luftvej61–63,68. Meget små størrelser LMA (str. 1-1,5) displaceres let og medfører oftere luft i ventriklen. Efter anlæggelse kan fleksibel fiberoptisk intubation udføres gennem larynxmasken.
Vejledende størrelser LMA efter vægt:
- < 5 kg: 1
- 5-10 kg: 1,5
- 10-20 kg: 2
- 20-30 kg: 2,5
- 30-50 kg: 3
- 50-70 kg: 4
LMA indføres på mindre børn (< 20 kg) med åbningen opad og roteres 180 grader på plads i svælget for at undgå at folde den relativt lange epiglottis25,64.
Fastrach Intubating Laryngeal Mask Airway (ILMA) str. 3 er designet til børn mellem 30-50 kg, men er relativt dårligt valideret. Anvendt på børn > 25 kg i en enkelt undersøgelse var succesraten for blind intubation 66% mod 96% ved anvendelse af fiberskop gennem ILMA84. Findes ikke mindre end str. 3.
Fleksibelt fiberskop
Intubation med fleksibelt fiberoptisk skop betragtes også hos børn som gold standard ved forventet vanskelig intubation62,68,85. Talrige teknikker er beskrevet både nasalt og oralt og guided gennem diverse supraglottiske airway devices. Fælles for dem alle er, at de kræver øvelse og kan være tidskrævende, hvorfor de ofte ikke er relevante ved uventet vanskelig intubation. Udføres som regel i anæstesi med bevaret egenrespiration.
Andre alternative teknikker
Der findes en lang række alternative intubationsteknikker i litteraturen. Disse er sjældent anvendte.
Vanskelig intubation
Der findes ingen alment accepterede retningslinier for håndtering af hverken forventet eller uventet vanskelig intubation hos børn. Fleksibel fiberoptisk intubation opfattes som gold standard ved forventet vanskelig intubation62,68,85.
Forventet vanskelig intubation
Ved forventet vanskelig luftvejshåndtering bør intubation med fiberskop eller videolaryngoskop under anæstesi med bevaret spontan respiration vælges. En intubatør med børneanæstesiologisk erfaring bør om muligt stå for proceduren. Hjælpemidler og alternative luftvejs-devices skal være klargjort på stuen. Hvis ØNH-læge kan tilkaldes, bør vedkommende være tilstede med udstyr klargjort til invasiv teknik.
Uventet vanskelig intubation
Der findes enkelte forslag til algoritmer for håndtering af uventet vanskelig intubation hos børn, men ingen af dem har opnået almen udbredelse62,63. De overordnede principper er:
- Kald hjælp tidligt
- Prioritér oxygenering. Maskeventilér altid mellem intubationsforsøg.
- Optimér hvert nyt forsøg, dvs. fx
- Forbedre lejring
- Forbedre anæstesidybde og muskelrelaksation
- Skift laryngoskop (Miller, Macintosh, videolaryngoskop, anden længde)
- Skift intubatør
- Begræns antallet af forsøg
- LMA er førstevalg ved svigt af intubation
- Invasiv teknik ved KIM-KIT med hjertestop eller ekstrem bradykardi
De britiske selskaber Association of Paediatric Anaesthetists (APA), Difficult Airway Society (DAS) og Royal College of Anaesthetists (RCoA) har i 2012 udsendt en online Paediatric Airway Guideline i form af følgende tre algoritmer, der er vedhæftet dette dokument som appendices:
- Appendix B: Difficult mask ventilation86
- Appendix C: Unanticipated difficult tracheal intubation87
- Appendix D: Cannot intubate and cannot ventilate88
Algoritmerne er udformet mhp. elektiv intubation af 1-8 årige, men kan tjene som vejledning for akutte intubationer af børn i alle aldre. Den bagved liggende datagennemgang afventer fortsat publicering.
Nød-teknikker
Ved kan-ikke-maskeventilere-kan-ikke-intubere (KIM-KIT) situationer hos børn er invasiv teknik indiceret ved hypoksisk bradykardi, hvor hjertestop er nært forestående eller er indtrådt. Der eksisterer stort set ingen evidens for valg af nødteknik hos børn, der derfor baseres på case reports, dyreforsøg og ekspertanbefalinger. Hvis muligt er kirurgisk intervention fra en erfaren ØNH-læge at foretrække. Uanset valg af teknik må man forvente en lavere succesrate og en højere komplikationsrate end hos voksne, hvorfor nødteknikkerne kun må anvendes som absolut sidste udvej64,68.
Samlet set kan følgende anbefales:
- Kirurgisk adgang udført af en erfaren ØNH-kirurg er at foretrække
- Jet-ventilation via nåle-cricothyreotomi anvendes som primær nødteknik hos børn i alle aldre. På børn < 1 år kanyleres trachea lige distalt for cartilago cricoidea
- Ved svigt af nåle-cricothyreotomi anvendes aldersbaseret approach:
- Børn < 5 år: Kirurgisk tracheotomi
- Børn 5-8 år: Kirurgisk cricothyreotomi
- Børn >8 år: Cricothyreotomi med Seldingerteknik, fx med Cook Melker Emergency Cricothyrotomy Kit
Se Appendix D for en foreslået algoritme fra de britiske selskaber APA, DAS og RCoA.
Valg af teknik vil dog altid afhænge af personlig erfaring og lokale forhold.
Nåle-cricothyreotomi
Transtracheal jet-ventilation kan udføres via et katether placeret gennem membrana cricothyroidea eller trachea og anbefales som den primære invasive teknik af flere autoriteter25,63,89. En enkelt forfatter fraråder teknikken pga. lav succesrate og høj komplikationsfrekvens62. I et forsøg på smågrise opnåedes en succescrate på 65-70% indenfor en 2 minutters tidsgrænse. Der var en høj incidens af komplikationer, primært i form af perforation af tracheas bagvæg83.
Teknik25,64:
- Eksponer barnets hals: Ekstendér nakken og læg noget under skuldrene
- Anvend et kommercielt samlet sæt eller sammensæt et venflon 14-16 G (grå eller orange) med en vandfyldt 5 ml-sprøjte
- Punktér membrana cricothyroidea (på børn < 1 år punkteres trachea lige under cartilago cricoidea) med nålet vinklet 45 grader kaudalt. Undgå at komprimere trachea under proceduren
- Luftaspiration bekræfter placering af kanylespidsen i trachea
- Fremfør venflonet og fjern kanyle. Pas på – venflon’et kinker let. Genbekræft luftaspiration.
- Påsæt åben tre-vejshane hvor der forinden er påsat hvid iltslange
- Tilslut højtryks-iltkilde med iltflow i L/min = alder (år), dog højst 6 L/min. Giv inspiration 1 sekund ved at holde for trevejshanen og ekspiration 4 sekunder ved at slippe
- Øvre luftvej skal holdes åben for at tillade ekspiration og undgå barotraume, fx med LMA
- Metoden tillader oxygenering i en begrænset periode, men fjerner kun minimalt CO2 Beskrivelse af de øvrige invasive teknikker ligger udenfor rammerne af denne vejledning.
Appendix 2.1. Forslag til udstyr i pædiatrisk vanskelig-luftvejsbakke
Skuffe 1: Vanskelig maskeventilation
- Masker
- Vinkelventil
- Ventilationsposer 0,5, 1,0 og 2,0 L
- Orale airways
- Nasale airways/ucuffede tuber
- Gel
Skuffe 2: Vanskelig intubation, plan A
- Ekstra laryngoskop
- Laryngoskopblade Miller 0-2 samt Macintosh 0-3
- Ekstra tuber, cuffede
- Børne-Magilltang
- Børne-stilet + gel
- Bougie
Skuffe 3: Vanskelig intubation, plan B
- (Pædiatrisk videolaryngoskop hvis det haves)
- (Børnefiberskop hvis det haves inkl. ekstra batterier og antidug)
- LMA str. 1 til 4 + gel
- ILMA str. 3
- Airway Exchange Catheter 7-14F
Skuffe 4: KIM-KIT
- Kit til nåle-cricothyreotomi (kommercielt eller samlet lokalt), label “Førstevalg til alle aldre”
- Kit til kirurgisk tracheotomi, label “Alder < 5 år, 2. valg”: Skalpel, krum pean, stump tang, skarp saks, trachealkrog
- Kit til kirurgisk cricothyreotomi, label “Alder 5-8 år, 2. valg”: Skalpel, krum pean, trachealkrog
- Cook Melker Emergency Cricothyrotomy Kit str. 5,0 ID med cuff samt 4,0 ID uden cuff, label “Alder > 8 år, 2. valg”
Appendix 2.2. APA/DAS/RCoA algoritme for vanskelig maskeventilation hos børn
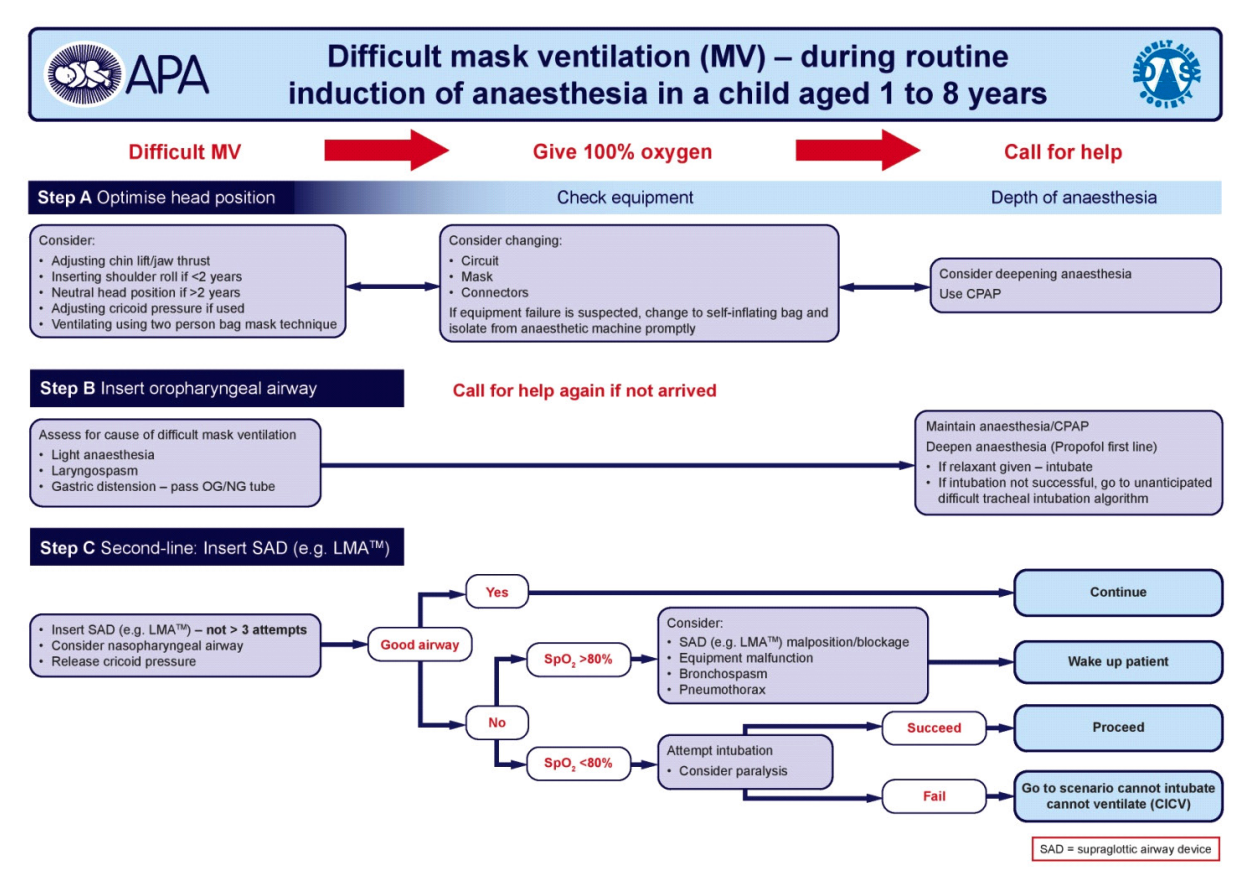
Reference86
Appendix 2.3. APA/DAS/RCoA algoritme for vanskelig intubation hos børn
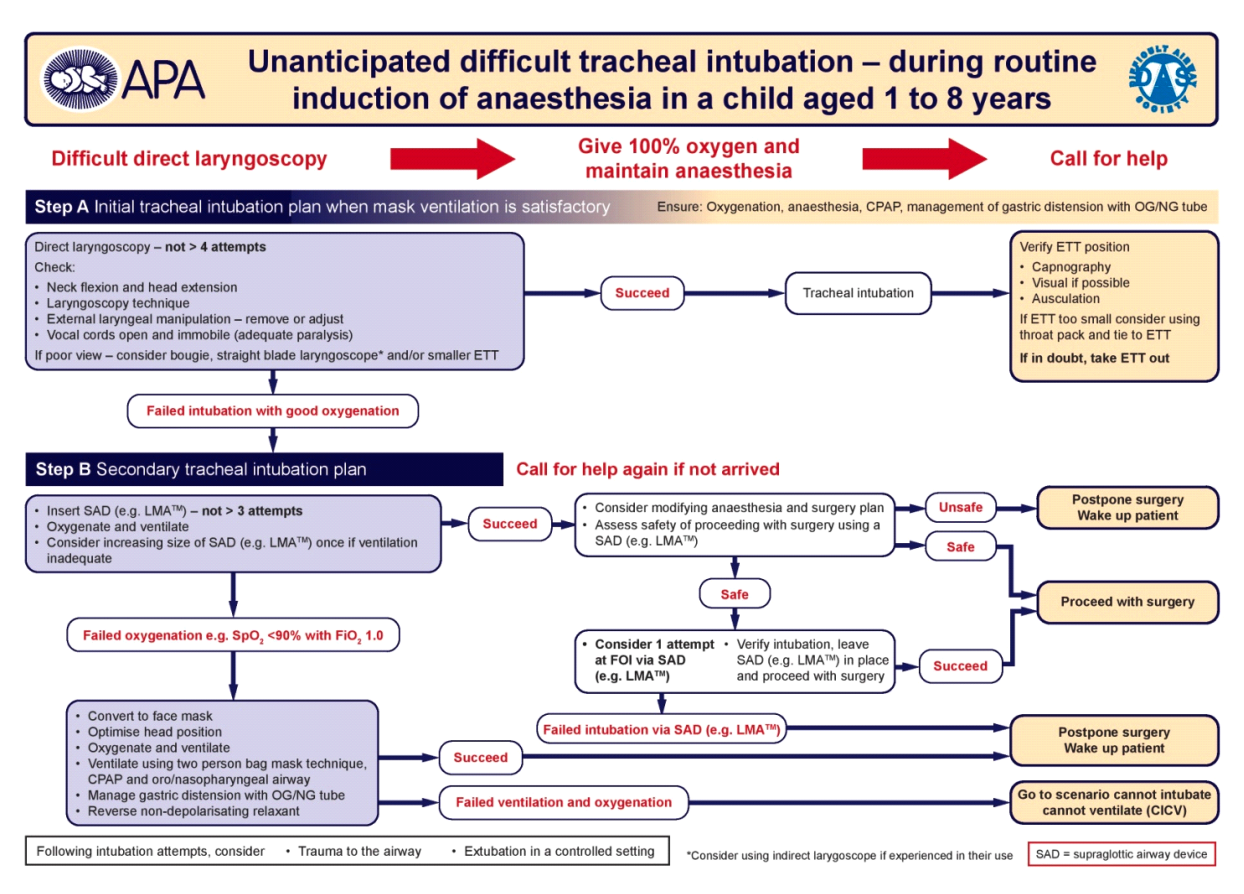
Reference87
Appendix 2.4. APA/DAS/RCoA algoritme for KIM-KIT situation hos børn
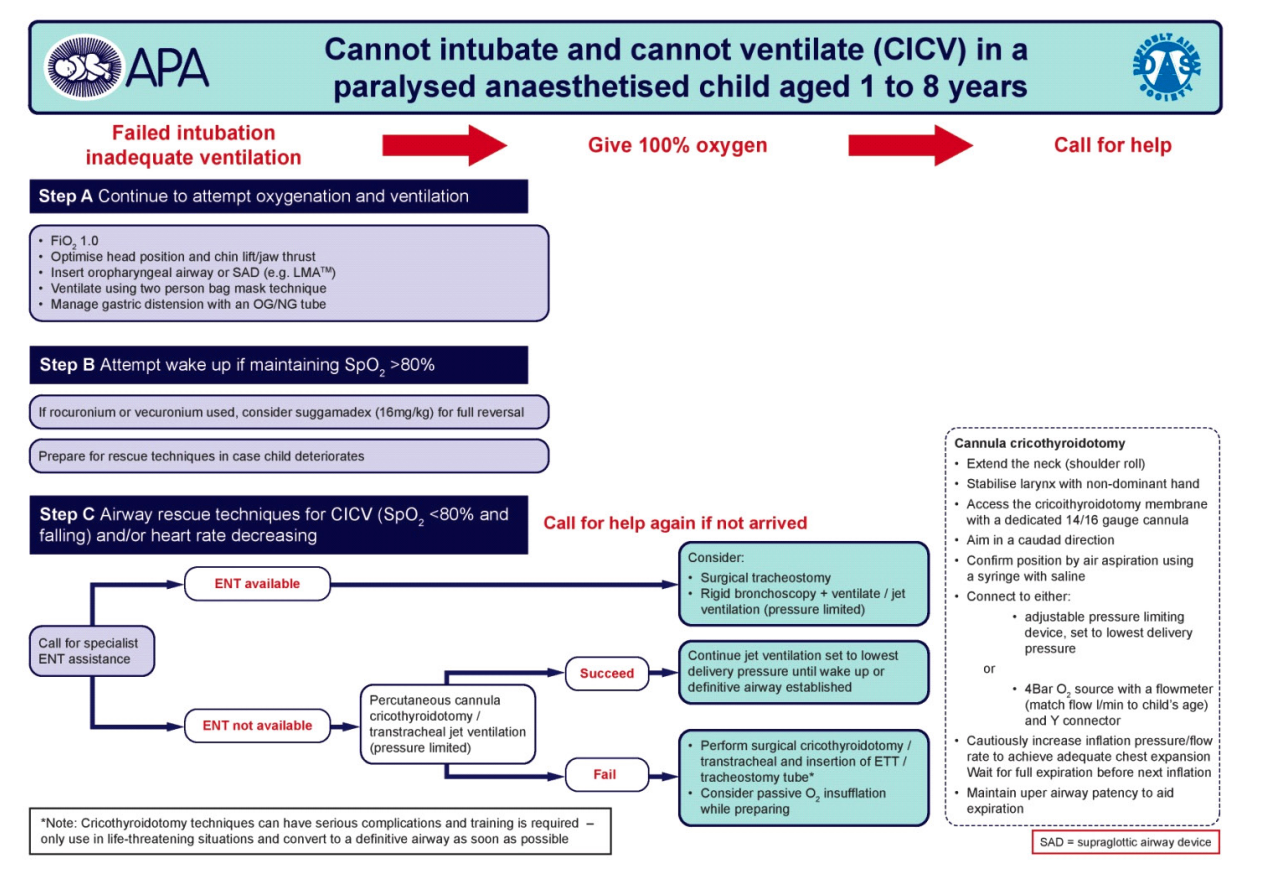
Reference88
3. LIVSTRUENDE ASTMA
Forfatter: Lasse Høgh Andersen
Korrespondance: lasse.andersen@dadlnet.dk
Resumé
- Overflytning til intensiv afdeling er indiceret ved livstruende astma eller ved svær astma, der ikke retter sig i løbet af højst to-tre timer – også selv hvis der ikke findes behov for respiratorbehandling endnu. Hav en lav tærskel især ved børn < 2 år eller ved tidligere behov for intensiv terapi
- Overvej udløsende årsag, differentialdiagnoser og komplikationer specifikt inklusiv fremmedlegeme, anafylaksi og pneumothorax •
- Medicinsk standardbehandling:
- Ilt-tilskud til SpO2 ≥ 94-95%
- Væskeresuscitation især ved takykardi og før intubation. Børn er ofte hypovolæme ved ankomst.
- Salbutamol (Ventoline) inh. 0,15 mg/kg (min. 2,5 mg, max 5 mg) hvert 20 minut de første timer, herefter hver 1-4 time
- Ipratropium inh. 250 µg hvert 20-30 min. de første 1-2 timer, herefter fast inh. 250 µg x 3-4. Dosisjustering < 1 år og > 12 år
- Solu-Medrol i.v. 1 mg/kg x 4 dag 1, reduceret til 1 mg/kg x 2
- Ilt-tilskud til SpO2 ≥ 94-95%
- Yderligere til børn > 1-2 år med livstruende astma eller ved svær astma uden bedring efter 1-3 timers standardbehandling:
- Magnesiumsulfat, bolus 0,1 mmol/kg i.v. (0,1-0,3 mmol/kg, max 8 mmol) over 20 min. Kan evt. gentages mhp. se-Mg++ 1,3-1,9 mmol/L
- Salbutamol (Ventoline®), bolus 5-15 µg/kg i.v. over 10 minutter + infusion i.v. 5-7,5 µg/kg/t – kan øges efter effekt helt op til 300 µg/kg/t. Dosisreduktion ved takykardi, arytmi, troponin- eller laktatstigning
- Yderligere kan forsøges:
- Før intubation: Theophyllin i.v., Heliox, adrenalin-inh. mukolytika
- Efter intubation: Tung sedation (evt. inkl. S-Ketamin), muskelrelaksans, inhalationsanæstesi
- ECMO som sidste udvej
- Respiratorbehandling er indiceret ved hypoksi (PaO2 < 8 kPa), hyperkapni (PaCO2 > 6-7 kPa) eller svær bevidsthedspåvirkning. Bør overvejes ved gradvis forværring og indtryk af respiratorisk udtrætning
- Medfører risiko for barotraumer, hypotension og forværret bronkospasme
- Undgå histaminfrigørende farmaka til intubation (undgå thiomebumal, mivacurium og actracurium)
- Respiratorbehandling med permissiv hyperkapni, dvs. relativt lavt tidalvolumen (≤ 6 ml/kg), langsom RF, lang ekspirationstid (I:E-ratio < 1:2). PEEP 0-5 cmH2O
- Tung sedation ofte påkrævet
- Bronkoskopi udføres ved mistanke om fremmedlegeme, slimpropper, bronkietræ-afstøbninger (bronchial casts) eller persisterende atelektaser
- Kaliumsubstitution ofte påkrævet
- Deeskalering af terapi indledes tidligst efter 12-24 timers stabil tilstand. Behandlingerne pauseres én ad gangen i omvendt rækkefølge af deres opstart. Standardbehandling opretholdes, indtil barnet er ude af intensiv afdeling.
Afgrænsning af emnet
Denne instruks omhandler behandling af børn > 1 måned med svær eller livstruende akut astma.
Baggrund
Astma er den hyppigste kroniske sygdom blandt børn, og akut astma og astmatisk bronkitis er meget hyppige indlæggelsesdiagnoser på pædiatriske afdelinger. Langt størstedelen af disse børn kan behandles på pædiatrisk afdeling med medicinske standardbehandlinger, men enkelte vil kræve indlæggelse på intensiv afdeling med behov for yderligere medicinsk behandling og evt. respiratorterapi. Intensivmortalitet og -outcome afhænger af visitationsretningslinierne. I et amerikansk studie af 13.552 børn med astma på intensive afdelinger blev 11% respiratorbehandlet. Den samlede mortalitet var 0,3%, mod 2,5% blandt respiratorbehandlede90. Børn indlagt med astma har generelt en lavere dødelighed end voksne91.
Diagnose
Akut astma er en klinisk diagnose, der stilles hos barnet med dyspnø, rhonci, forlænget expirium og klinisk besværet vejrtrækning fx med indtrækninger, spil af alae nasi og brug af accessoriske vejrtrækningsmuskler. Anamnesen kan omfatte tidligere besværet vejrtrækning eller langvarig hoste ved virusinfektioner, anstrengelse eller eksposition for luftvejsirritanter eller allergener, men der kan også være tale om debut uden forudgående tilfælde. Mindre børn er sjældent udredt med lungefunktionsundersøgelser.
Årsager
Hos børn <2-3 år indlagt med bronkospasme er der sjældent tale om atopisk astma, som det ses hos børn over 5 år. Virus er oftest udløsende årsag snarere end allergener og irritanter. Dette har dog kun sparsom behandlingsmæssig konsekvens i det akutte forløb92,93. Hos spædbørn er der ofte tale om bronchiolitis – se separat vejledning.
Inddeling
Sværhedsgraden af akut astma inddeles på baggrund af den kliniske præsentation, se tabel 3.1. Peakflow kan ikke måles ved svær eller livstruende astma og er derfor udeladt. Bemærk, at børn kan være forbløffende alment velbefindende langt hen i forløbet trods svær bronkospasme93. Hvis patienten opfylder kriterier svarende til forskellige sværhedsgrader, klassificeres anfaldet som den højeste af disse.
Tabel 3.1. Oversigt over sværhedsgrad92–94
*) stigende PaCO2 er indikator for livstruende astma. Normal PaCO2 kombineret med svært respiratorisk distress indikerer høj risiko for respirationsstop
Risikofaktorer for astma-relateret død
Risiko for astmarelateret død omfatter bland andet følgende92,93,95:
- Tidligere respiratorbehandlet for astma
- Indlagt med exacerbation indenfor seneste år eller gentagne tilsyn i børnemodtagelse/skadestue
- Behandles med (eller er nyligt ophørt med) peroralt steroid
- Får mere end tre slags fast medicin mod astma
- Meget højt vanligt brug af β2-agonister
Visitation og vurdering
Følgende børn med akut astma bør indlægges på intensiv afdeling:
- Børn med livstruende astma
- Børn med svær astma, der forværres eller ikke retter sig markant i løbet af de første to-tre timers behandling
- Ved klinisk indtryk af begyndende respiratorisk udtrætning
- Børn med tidligere astma-relateret intensiv-indlæggelse bør overflyttes tidligt til intensiv afdeling
- Børn < 1-2 år er i størst risiko for respirationssvigt95 og bør derfor overflyttes tidligt til intensiv afdeling
Bemærk at disse børn bør overflyttes til intensiv afdeling, også selvom der ikke umiddelbart findes behov for respiratorbehandling.
Undersøgelser
Kun få parakliniske undersøgelser er relevante ved akut svær astma. Klinisk vurdering er den vigtigste parameter93.
- Anamnese: Udløsende årsag inkl. specifik vurdering af sandsynligheden for evt. fremmedlegeme i luftvejen. Varighed af anfaldet. Komplicerende sygdomme
- Røntgen af thorax mhp. udløsende årsag, komplikationer og evt. differentialdiagnoser
- Blodprøver: Infektionstal, elektrolytter inkl K+, Mg++, fosfat, nyretal, se-teofylin (hvis relevant)
- Blodgas-analyse på arteriel eller kapillær blodprøve
- EKG
- Trakealsug til D+R, PCR for atypisk pneumoni og PCR for luftvejsvira (bør omfatte: Influenza A+B, RSV, metapneumovirus, parainfluenza 1+2+3, rhinovirus, adenovirus, bocavirus og enterovirus)
- Bronkoskopi udføres diagnostisk og terapeutisk på vid indikation (se “Differentialdiagnoser samt “Andet”)
Peakflow eller FEV1 er irrelevante og som regel umulige at måle ved svær og livstruende astma95.
Komplikationer
- Pneumothorax, pneumomediastinum
- Aspiration
- Atelektase
- Slimpropper, plastic bronchitis
- Hypovolæmi
- Kardielle bivirkninger til medicinsk behandling
- Laktatstigning som følge af højdosis β2-agonist-behandling
- Generelle ICU-komplikationer som fx. ventilator-associated-pneumonia (VAP)
- Hjertestop
Differentialdiagnoser
- Bronchiolitis hos småbørn (se separat vejledning)
- Lungeinfektioner
- Fremmedlegeme
- Anafylaksi
- Epiglottitis, tracheitis
- Recurrensparese
- Tracheal kompression, indre eller ydre
- Cystisk fibrose
- Bronkopulmonal dysplasi
- Hjertesvigt
- Gastroøsophageal-reflux
Medicinsk behandling
Medicinsk behandling sigter mod at reducere bronkospasme, luftvejsinflammation, luftvejsødem og hypersekretion. Eliminér udløsende årsager som fx. infektion eller kontakt med allergener. Forvent hyperreaktivitet ved sugning og instrumentering af luftvejen92. Behandlingen bør foregå i et roligt miljø, da barnets tilstand kan forværres af agitation. Hvis anafylaksi mistænkes som udløsende årsag, behandles specifikt mod dette med adrenalin, antihistamin og binyrebarkhormon.
Standard-behandling
Jf. internationale guidelines92–95
- Ilt-tilskud til SpO2 ≥ 94-95%
- Væskeresuscitation især ved takykardi og før intubation
- Salbutamol (Ventoline®) inhalation 0,15 mg/kg (min. 2,5 mg, max 5 mg) hvert 20 minut de første timer, herefter hver 1-4 time, evt. kontinuerligt. Opblandes til 4 ml ialt med isoton NaCl mhp. inhalationsvarighed på 5-15 min.
- Bivirkninger: Tremor, hypokaliæmi, takykardi, agitation, laktatstigning
- Kan have nedsat effekt hos børn < 18 mdr, men anvendes alligevel
- Terbutalin (Bricanyl) kan anvendes i samme doser og intervaller. Det er dog uafklaret, om det er ligeså effektivt som salbutamol93,96
- Ipratropium inhalation. 250 µg hvert 20-30 min. de første 1-2 timer. Uklart om der er effekt af videre behandling herefter, men det kan forsøges: Dosisforslag 250 µg x 3-4 inh. Kan blandes med Salbutamol i forstøver.
- Alderjusteret dosis:
- Børn < 1 mdr: 62,5 µg/dosis
- Børn 1-12 mdr: 125 µg/dosis
- Børn 1-12 år: 250 µg/dosis
- Børn > 12 år: 500 µg/dosis
- Alderjusteret dosis:
- Solu-Medrol i.v. 1 mg/kg x 4 dag 1, reduceret til 1 mg/kg x 2 på dag 2 og herefter evt. yderligere til 1 mg/kg x 1 (max 60 mg/døgn) såfremt der er bedring. Peroralt steroid er lige så effektivt men frarådes pga. upålidelig gastrointestinal absorption ved kritisk sygdom hos børn
- Bivirkninger: Agitation, hypertension, hyperglykæmi
Andenlinie-behandling
Andenlinie-behandlingerne er nævnt i rækkefølge efter styrken af deres evidens. Bør opstartes i den her anførte rækkefølge:
- Magnesiumsulfat i.v., bolus 0,1 mmol/kg i.v. (0,1-0,3 mmol/kg, max 8 mmol) over 20 min. Har muligvis størst effekt anvendt tidligt i behandlingen og kan med fordel opstartes allerede i skadestue/børnemodtagelse. Anvendes til børn > 2 år ved svær akut astma ved manglende bedring efter 1 times standardbehandling93,95
- Gentagelse: Behandlingen kan gentages p.n., skønt der ingen evidens findes for dette. Klinisk effekt kan sandsynligvis forventes ved se-magnesium på 1,3-1,9 mmol/L (normalområde 0,6-0,9 mmol/L)97,98
- Bivirkninger: Tolereres generelt godt. Hypotension ved hurtig indgift. Muskelsvækkelse ved overdosering.
- Evidens: I er randomiseret studie af 143 børn på 2-15 år med svær akut astma reduceredes andelen med efterfølgende behov for respiratorterapi signifikant fra 33% til 4% ved bolus magnesiumsulfat 0,1 mmol/kg over 20 min. indenfor første time99. En metaanalyse fra 2005 omfattende 5 randomiserede undersøgelser af i alt 182 børn med moderat-svær astma påviste ligeledes, at magnesiumindgift i den initiale behandling reducerede behovet for indlæggelse, number-needed-to-treat = 4100.
- Salbutamol (Ventoline®) i.v., bolus 5-15 µg/kg i.v. over 10 minutter + infusion i.v. 5-7,5 µg/kg/t. Gives til børn ≥ 1-2 år ved svær astma hvor inhalationsbehandling ikke er mulig, fx ved næsten ophørt luftskifte, eller ved manglende bedring efter 2-3 timers standardbehandling, evt. tidligere92–94.
- Infusionhastighed justeres efter effekt og bivirkninger. Anbefalet infusionsrate varierer vidt mellem kilder og kan formentlig øges betydeligt i forhold til ovenstående101. British Thoracic Society anbefaler fx infusionshastighed på 60-300 µg/kg/t til børn ≥ 2 år93.
- Bivirkninger: Takykardi, hypertension, troponinstigning, hypokaliæmi, laktatstigning – obs EKG. Reducér infusionshastighed ved takykardi eller laktat > 2,2 mmol/L102
- Evidens: Et Cochrane-review fra 2012 fandt blot to randomiserede undersøgelser af i.v. β2-agonister til børn med akut astma, hvoraf det ene fandt klinisk effekt, og det andet ikke gjorde103–105.
- Terbutalin (Bricanyl®) kan formentlig anvendes men evidensen er mindre omfattende, og det er uvist om det er ækvipotent med salbutamol. Internationale guidelines omtaler primært salbutamol.
Yderligere behandlingsmuligheder
Ved livstruende astma, der er refraktær overfor al anden behandling, kan man afhængigt af den kliniske situation forsøge en eller flere af nedenstående – stort set udokumenterede – behandlinger.
Før intubation
- Theophyllin i.v. bolus 5 mg/kg over 20 min. + infusion 1 mg/kg/t (reduceret til 0,8 hos børn > 9 år). Kan overvejes til børn >1-2 år med svær astma, der ikke bedres af nogen af ovenstående behandlinger. Stor forsigtighed tilrådes hos uintuberede børn pga. høj forekomst af opkastninger. Må kun gives på intensiv afdeling. o
- Dosisjustering: Hvis barnet er i fast behandling med theophyllin, gives ingen bolus. Mål serum-værdi, start infusionen og korrigér efter svar94. Infusionshastighed reduceres generelt ved hjerte- eller leverinsufficiens. Terapeutisk targetværdi er 5-10 µg/ml.
- Evidens: Meget sparsom evidens for effekt om nogen106–108. Anbefales som escape-drug af Global Initiative for Asthma samt British Thoracic Society93,94. Frarådes af det amerikanske National Instutite of Health pga. manglende dokumentation af effekt men sikker dokumentation for bivirkninger95.
- Bivirkninger: Kvalme, opkastning, mavesmerter, agitation, takykardi, arytmi, kramper.
- Heliox kan anvendes bl.a. som drivmiddel i inhalationer blandet med 20-30% O2. Anbefales af nogle91, men evidens for effekt er ikke entydig108.
- Adrenalin inhalation 0,15 mg/kg (max. 4 mg) kan forsøges hos børn < 2 år, hvor ødem og hypersekretion ofte er mere fremtrædende er bronkiekonstriktion.
- Mukolytika: Ingen dokumenteret effekt, men mange børn med svær astma har slimpropper i bronkietræet. Forsøg evt. inh. Pulmozyme® 2,5 mg x 1 (ringe erfaring < 5 år, overvej risk-benefit).
Efter intubation
- Tung sedation under respiratorbehandling er ofte nødvendig. Luftvejen er hyperreaktiv og bronkospasmen forværres af intubation ved insufficient sedationsdybde. Giv aldrig sedativa til unintuberede børn med astma
- S-Ketamin: Frembyder teoretisk set en fordel ved bronkospasme109, men der er stort set ingen klinisk evidens for denne effekt95,110,111
- Muskelrelaksation kan forsøges ved høje luftvejstryk under respiratorbehandling
- Inhalationsanæstesi med fx sevofluran kan forsøges som en næstsidste udvej
- ECMO skal overvejes som sidste udvej
Følgende behandlinger har ingen dokumenteret effekt ved akut astma: Leukotrienreceptor-antagonister, kromoner, anti-IgE-antistoffer (omalizumab), højdosis steroid, lidocain i.v., inh. furosemid, fysioterapi.
Vanlig medicin
- Inhalationssteroid: Kan pauseres sålænge der gives systemisk steroid
- Leukotrien-antagonister (typisk montelukast (Singulair®)) fortsættes, hvis barnet er i fast behandling94
- Langtidsvirkende B2-agonister pauseres, hvis patienten får inhalationer mere end hver 4 time93
Kontraindiceret medicin
NSAID og betablokkere er kontraindiceret ved akut svær astma. Sedativa må aldrig gives til unintuberede93,95.
Væskebehandling
Patienterne er som regel hypovolæme som følge af manglende væskeindtag og høj perspiration. Deficit skal erstattes, da hypovolæmi bidrager til takykardi, hypotension, laktatstigning og acidose95. Overhydrering skal dog undgås af hensyn til risikoen for komplicerende lungeødem. Elektrolytbalancen monitoreres. Hypokaliæmi ses ofte som følge af β2-agonister108.
Respiratorbehandling
Respiratorbehandling af børn med svær eller livstruende astma kan kompliceres af høje peak-tryk, hyperinflation og højt intrinsic PEEP, men trods dette viser publicerede kliniske resultater, at respiratorbehandling af børn med astma kan udføres med gode resultater til følge112. Intubation må derfor ikke udsættes indtil det tidspunkt, hvor faren for respirations- og hjertestop er overhængende95.
Non-invasiv ventilation, nasal-CPAP eller high-flow nasal ilt kan ikke anbefales generelt, da evidensen er sparsom, og små børn ofte ikke kan kooperere pga. angst. Teknikkerne bør kun forsøges i udvalgte tilfælde i ventetid på effekt af medicinsk terapi ved lettere tegn på begyndende udtrætning. Det må aldrig forsinke påkrævet respiratorbehandling113. Kompliceres ikke sjældent af manglende sekretclearance, aerophagi, høje luftvejstryk og barotraumer.
Indikationer for respiratorbehandling
- Abslout indikation: Respirationsstop, hjertetop, hypoksi (PaO2 < 8 kPa), hyperkapni (PaCO2 > 6-7 kPa) eller svær bevidsthedspåvirkning108
- Relative indikationer: Gradvis forværring trods maksimal behandling. Bevidsthedspåvirkning, stigende PaCO2, kan ikke tale/græde, udtrætning (aftagende respirationsarbejde). Klinisk skøn er vigtigere end absolutte værdier95,108,114
Komplikationer til respiratorbehandling
Forværret bronkospasme, hypotension (tænk: hypovolæmi, farmaka, pneumothorax), barotraumer, dynamisk hyperinflation.
Intubation
- Se separat vejledning om luftvejhåndtering
- Højrisiko-procedure. Giv væske for at forebygge hypotension. Forudse forværring af bronkospasme efter instrumentering. Sørg for dyb anæstesi
- Induktion med propofol eller ketamin. Undgå thiomebumal, da dette er potentielt histaminfrigørende
- Relaksér med med rocuronium eller suxamethonium. Mivacurium og atracurium undgås, da de er potentielt histaminfrigørende
Respiratorindstillling
Sparsom evidens for anbefalinger. Strategien er at minimere luftvejstrykket og kompensere for den forhindrede ekspiration ved at anvende et relativt lavt tidalvolumen (≤ 6 ml/kg), langsom respirationsfrekvens og en lav I:E-ratio (<1:2), dvs. kort inspirationstid og lang ekspirationstid. Strategien medfører ofte CO2-stigning, hvilket tolereres i et vist omfang, så længe pH > 7,15-7,25 (permissiv hyperkapni)95,115,116.
- Modus: Både kontrolleret og spontan respiration kan anvendes. Ved svær bronkospasme vil tung sedation være påkrævet og dermed også fuldt kontrolleret ventilation115
- PEEP: Kontroversielt. Typisk anbefaling er 0-5 cmH2O af hensyn til risikoen for air trappping115,117
Se i øvrigt separat vejledning om respiratorterapi til børn.
Anden behandling
- Bronkoskopi bør udføres på vid indikation ved mistanke om fremmedlegeme, slimpropper, bronkietræ-afstøbninger (bronchial casts) eller persisterende atelektaser. I en amerikansk opgørelse fra 2012 blev 29 af 40 respiratorbehandlede børn med astma bronkoskoperet på disse indikationer uden væsentlige komplikationer og ofte med bedring af respirationen til følge112
- Kaliumsubstitution
- Væsketerapi: Laktatstigning ses hyppigt og er oftest af type 2, dvs non-hypoxæmisk. Forsøg væskebolus. Hvis persisterende overvejes reduktion af β2-agonist inh./i.v.118
Deeskalering af medicinsk behandling
Der er stor fare for recidiv af bronkospasme ved reduktion i den medicinske behandling tidligt i forløbet. Ved livstruende astma, der omsider viser bedring, bør man fortsætte den instituerede behandling i minimum 12-24 timer før deeskalering påbegyndes, medmindre der er komplikationer eller bivirkninger. Ved fortsat fremgang seponeres behandlingerne én ad gangen i omvendt rækkefølge af deres opstart. Standardbehandling opretholdes så længe barnet fortsat er indlagt på intensiv afdeling.
4. BRONCHIOLITIS
Forfatter: Ole Pedersen
Korrespondance: ole.pedersen@rsyd.dk
Introduktion
Respiratoriske symptomer udløses oftest af virale luftvejsinfektioner med glidende overgange mellem, eller samtidig tilstedeværende af, tilgrænsende sygdomsbilleder som forkølelse, sinuitis, konjunktivitis, otitis media, pharyngitis, laryngitis og laryngotracheitis inkl pseudocroup, bronchitis, astmatisk bronchitis, bronchiolitis og (viral) pneumoni. Bronchiolitis er den hyppigste nedre luftvejsinfektion hos små børn fra 1 måned til 2 år. Sygdommen skyldes næsten udelukkende viral infektion specielt Respiratorisk syncytial virus (RSV) afhængig af årstiden, november til marts, men også rhinovirus, parainfluenza virus, adenovirus og sjældent bakterier (fx. Mycoplasma pneumoniae). Bronchiolitis er karakteriseret ved obstruktion af de små lufteveje (bronchiolerne). Akut inflammation, slimhindeødem og afstødte nekrotiske epitelceller danner sammen med mucus propper og resulterer i hvæsende respiration (forlænget eksspiration) og airtrapping.
Vurdering
Symptomer
Bronchiolitis er almindeligvis en selvbegrænsende sygdom med en varighed på 7-10 dage, men kan i sjældne tilfælde medføre respiratorisk svigt og i værste fald død. Typisk debuterer sygdomsforløbet med hoste, feber og kataralia. De øvre luftvejssymptomer udvikles over de næste 3-6 dage til symptomer fra nedre luftveje i form af hoste, takypnø, apnø, hvæsen og thorakale indtrækninger (intersubcostale) stigende til paradoks respiration, cyanose og hypoxæmi. Sekretstagnation og airtrapping fører til hyperekspanderet thorax. Apnø opstår hyppigst hos børn under 2 måneder og specielt hos eks-præmature. Har barnet først haft en apnø er risikoen for fornyet apnø betydeligt forøget119. I svære tilfælde ses barnet med øget respiratorisk arbejde med dybe thorakale indtrækninger og cyanose, dehydratio med nedsat perifer perfusion (nedsat kapillærrespons) og påvirket bevidsthed. Forlænget eksspirium aftager når barnet udtrættes og svigter respiratorisk. Hvis de nedre luftveje er obstruerede høres ikke hvæsen og ved stetoskopi er der ophørt luftskifte (tyst thorax).
Kliniske tegn på svær sygdom
- Nedsat fødeindtag (< 50 % af vanlig døgnmængde)
- Sløvhed
- Apnøtilfælde i anamnesen
- Respirationsfrekvens > 70/min (faldende respirationsfrekvens lige før respiratorisk svigt)
- Spil af alae nasi og/eller knirken
- Svære thorax indtrækninger
- cyanose
Radiologisk kan ses hyperinflation, infiltrater og atelektaser.
Undersøgelser
Diagnosen stilles klinisk ud fra anamnesen og kliniske fund. Bronchiolitis skal mistænkes hos et barn under 2 år med kataralia og hvæsende hoste og eksspiration.
- Ilt saturation
- Blodgas analyse – ved svære respiratoriske symptomer
- Røntgen af thorax – ved diagnostisk usikkerhed eller uventet sygdomsforværring
- Virologisk testning – isolation af RSV-positive børn
- Bakteriologisk testning – ikke indiceret ved typisk akut bronchiolitis
- Blodprøver – infektionsparametre til adskillelse af bakteriel og viral nedre luftvejsinfektion er dårligt undersøgt120
Differentialdiagnoser
Ved recidiverende tilfælde med hvæsende vejrtrækning skal overvejes astma, gastro-øsofageal refluks, aspiration af fremmedlegeme, cystisk fibrose, bronchiektasier, sequester, pneumoni, hjertesvigt (astma kardiale).
Risikovurdering
Børn med følgende tilstande har høj risiko for udvikling af apnø, svær respiratorisk påvirkning eller respiratorisk svigt:
-
Yngre end 3 måneder
- Eks-præmature
- Immundefekt
- Cystisk fibrose
- Kardiopulmonale sygdomme (fx. kongenit hjertesygdom, bronchopulmonal dysplasi)
- Neuromuskulære sygdomme
Behandling
Behandlingen af bronchiolitis er primær respiratorisk understøttende terapi med ilttilskud og kontinuerlig positiv luftvejstryk (CPAP). Ofte forsøges medicinsk behandling i lighed med behandling af astma bronchiale uden der videnskabeligt kan påvises effekt af denne. Den største patologiske faktor i bronchiolitis er sekretophobning i de små luftveje, og det er påvist, at inhalation af hyperton saltvand fremmer sekretmobilisering ved nedsættelse af sekretets viskositet.
Respiratorisk støtte
Ilttilskud er indiceret, hvis iltsaturationen målt med pulsoxymeter vedvarende falder under 92 % hos tidligere lungerask barn121. Den understøttende respiratoriske behandling gives primært via iltmaske og nasal-CPAP, mens en lille minoritet af de mindste børn, særligt de med comorbiditet, vil kræve non-invasiv ventilation(NIV) eller respiratorbehandling.
CPAP forhindrer kollaps af de små luftveje, reducerer airtrapping og fremmer ventilationen. Genvindsten er størst ved tidlig indledning122. Indikation for CPAP er øget respirationsfrekvens, indtrækninger, behov for ilttilskud og apnø hos spædbørn. Til de mindste børn gives kontinuerlig nasal-CPAP via Benveniste ventil. Hvis der i flow-systemet er et manometer, justeres flow til et starttryk 5-8 cmH2O, oftest svarende til flow 10-14 liter/min. Justering af ilttilskud efter saturationen.
Intermitterende maske-CPAP benyttes i behandlingen af atelektaser og til sekretmobilisering, og sjældent i den akutte fase.
Større børn understøttes med NIV, indikationer som for nasal-CPAP. Patientkomfort kan øges ved brug af fullface maske.
Adjuverende behandling med helium-oxygen blanding administreret gennem CPAP-system eller NIV er endnu ikke påvist at forebygge endotracheal intubation og respiratorbehandling123–126.
Målet for den respiratoriske støtte er bedring af oxygeneringen og aftagende respiratorisk arbejde. Vurdering af barnets kliniske tilstand skal suppleres med regelmæssige blodgas analyser.
Behov for respiratorbehandling vurderes kontinuerlig ud fra de kliniske tegn og respons på igangsat terapi. Understøttes barnet med CPAP vil en stigende CO2 indikere begyndende udtrætning med respiratorisk svigt. Der er indikation for intubation og respiratorbehandling ved truende respirationssvigt (+/- CPAP) med påvirkning af bevidsthed, stigende CO2 over normokapnisk niveau, evt. faldende respirationsfrekvens, og cyanose.
Lungefysioterapi anbefales ikke i behandlingen af bronchiolitis123. Det kan forværre barnets respiratoriske stress og øge iltforbruget.
Væske
Børn med mild respiratorisk påvirkning kræver blot observation. Ved forværring af respirationen med stigende respirationsfrekvens øges perspiratio og føde- og væskeindtagelsen kompromitteres, især hvis barnet er kataralsk. Samtidig øges risikoen for aspiration af føde til lungerne. Kan barnet ikke indtage mad og væske sikkert, skal der påbegyndes intravenøs væskebehandling. Væskeindgiften skal justeres efter graden af mulig dehydrering foruden vedligeholdelse (indtil 10 kg: 4 ml/kg/t) og løbende tab.
Medicinsk behandling
Saltvand hyperton (3%) inhalation
Ved bronchiolitis er luftvejsødem og mucus propper de dominerende problemer. Inhalation af hyperton saltvand reducerer ødemet og fremmer mucus clearance. Ved sammenligning med isoton saltvand har hyperton saltvand vist at afkorte indlæggelsestiden ved bronchiolitis hos småbørn127.
Inhalationen kan kombineres med en bronchodilatator, både adrenalin og β2-agonist, til et samlet volumen 3-6 ml. Dosis: NaCl 3 %, 4 ml. Kan fremstilles ved en 1:1 blanding af NaCl 1 mmol/ml (58,5 gr/l) og sterilt vand, hvilket giver en koncentration på 2,9 %.
Inhalation af bronchodilatator
Obstruktion af de nedre luftveje skyldes primært slimhindeødem og propper af afstødte epitelceller og mucus, og i mindre grad øget konstriktion af glat bronchialmuskulatur. Rationalet for behandling med bronchodilatatorer er derfor svag.
Indenfor gruppen af brochodilatatorer findes β2 agonister, anticholinergika og adrenergika128,129.
Adrenalin-inhalation
Adrenalin har potentielt større effekt ved at reducerer slimhindeødemet i luftvejene og samtidig relakserer glat luftvejsmuskulatur. Adrenalin inhalation har ved sammenligning med β2–agonister vist større gevinst for ambulante patienter, mens der ikke er signifikant effekt i form af kortere hospitalsophold for indlagte patienter130. Trods den manglende evidens for brug af bronchodilatatorer er den kliniske erfaring, at udvalgte patienter har gavn af behandlingen. Et behandlingsforsøg kan retfærdiggøres under hensyn til respons. Fortsat behandling bør kun ske, hvis der er sikker klinisk effekt indenfor 1 time122,128. Dosis: 0,1-0,2 mg/kg, max 2 mg. Blandes med isoton NaCl til samlet volumen 3-5 ml. Ved hyppige inhalationer skal monitoreres for eventuelle systemiske bivirkninger med puls- og blodtryksstigning.
β2-agonist-inhalation
Ved bronchiolitis er β2-agonist inhalation hyppigt anvendt, men evidensniveauet er lavt131. Rutinemæssig brug af β2-agonist inhalation anbefales ikke120,128. Der kan gøres et behandlings forsøg, som kan kontinueres ved dokumenteret effekt – vurderet på respirationsfrekvens, saturation, hvæsen og respiratorisk arbejde128. Størst effekt kan forventes tidligt i sygdomsforløbet. Dosis: Terbutalin, Salbutamol: 0,1-0,2 mg/kg, max. dosis 5 mg. Ved behov blandes med isoton NaCl til samlet volumen 3-5 ml. Ved hyppige inhalationer risikeres systemisk påvirkning med pulsstigning og (sjældent) laktatstigning132.
Ipratropium
Ipratropium er et korttidsvirkende antikolinergikum, som ved binding til de muskarine receptorer i den bronkiale glatte muskel hæmmer den kolinerge bronkokonstriktion. Evidensen for brug af Ipratropium i behandlingen af bronchiolitis er lav133. Inh. 250 µg hvert 20-30 min. de første 1-2 timer. Uklart om der er effekt af videre behandling herefter, men det kan forsøges: Dosisforslag 250 µg x 3-4 inh. Kan blandes med β2-agonist i forstøver.
Steroider (+inhalation)
Steroider har antiinflammatorisk effekt og reducerer, teoretisk, luftvejs inflammation og ødem. Imidlertid er der ikke i studier påvist effekt, hvorfor der ikke anbefales inhalations steroid eller systemisk steroid til behandling af bronchiolitis hos børn134–137.
Systemisk steroid kan forud for ekstubation benyttes profylaktisk til patienter i høj risiko for postekstubation øvre luftvejs obstruktion og dermed reintubation138,139. Dosis: Methylprednisolon 1 mg/kg x 1-2 med 6 timers interval før og efter ekstubation, Dexamethason 0,5 mg/kg x 1-2, med 6-timer interval før og efter ekstubation.
Antibiotika
Der skal ikke rutinemæssigt behandles med antibiotika. Antibiotika er berettiget ved positiv dyrkning fra urin eller blod, eller ved pneumoni med infiltrat på røntgen af thorax.
Børn som indlægges med svære respiratoriske symptomer med behov for understøttende respiratorisk terapi, skal undersøges for bakteriel infektion. Der skal påbegyndes bred antibiotisk behandling efter afdelingens instruks. Fortsat antibiotisk behandling revurderes efter 3 dage.
Op mod 40 % af børn med bronchiolitis, der indlægges på børneintensiv, har bakterier i de nedre luftveje. Disse børn har længere indlæggelsestid i intensiv og på hospital selvom de ikke har diagnosen bakteriel pneumoni.
Behandling, der kan forsøges i børneintensivt regi
Surfactant
Administreres til nyfødte med Respiratorisk Distress Syndrom (RDS), meconiumaspiration og evt. svær pneumoni.
I få mindre studier tyder det på, at svær viral bronchiolitis resulterer i sekundær surfactant mangel. Hos de børn som kræver respiratorbehandling vises, at exogen surfactant nedsætter tiden i respirator og indlæggelsestiden på intensiv140,141.
Kan anvendes som rescue-therapy ved betydelige oxygeneringsproblemer på trods af 100 % ilt og/eller betydelige problemer med CO2 eliminationen. Forsøges før ECMO-behandling. Dosis: 100-200 mg/kg.
Dornase alfa (Pulmozyme®)
Dornase alfa inhalation har vist sig anvendelig hos non-cytiskfibrose patienter med atelektase (primært leukocyt DNA). Effekten af DNAse afhænger sandsynligvis af DNA-indholdet i mucus propperne. Da de fleste mucuspropper har beskeden indhold af DNA, bør DNAse ikke betragtes for standardbehandling.
Anbefales ikke i behandlingen af bronchiolitis hos børn142.
Koffeincitrat (caffeine citrate)
Apnø hos (præmature) spædbørn skyldes, at barnets vejrtrækningscenter i hjernen ikke er fuldt udviklet. Koffein virker primært som et CNS-stimulerende middel. Dette er grundlaget for koffeins virkning i præmatur-betinget apnø, for hvilket der har været foreslået adskillige virkningsmekanismer, herunder: stimulering af åndedrætscentret, øget minutventilation, nedsat grænse for hyperkapni, øget respons på hyperkapni, øget tonus i skeletmuskulaturen, nedsat diaphragmatisk træthed, øget metabolisme og øget iltforbrug.
Dosis: Mætningsdosis: 20 mg/kg. Vedligeholdelsesdosis: 5 mg/kg x 1 pr. døgn. Gives langsomt i.v. over 10 min. Alternativt oral administration via sonde x 1 pr. døgn143.
Appendix 4: Vurdering og behandling af bronchiolitis
Tabel 4.1. Vurdering af bronchiolitis
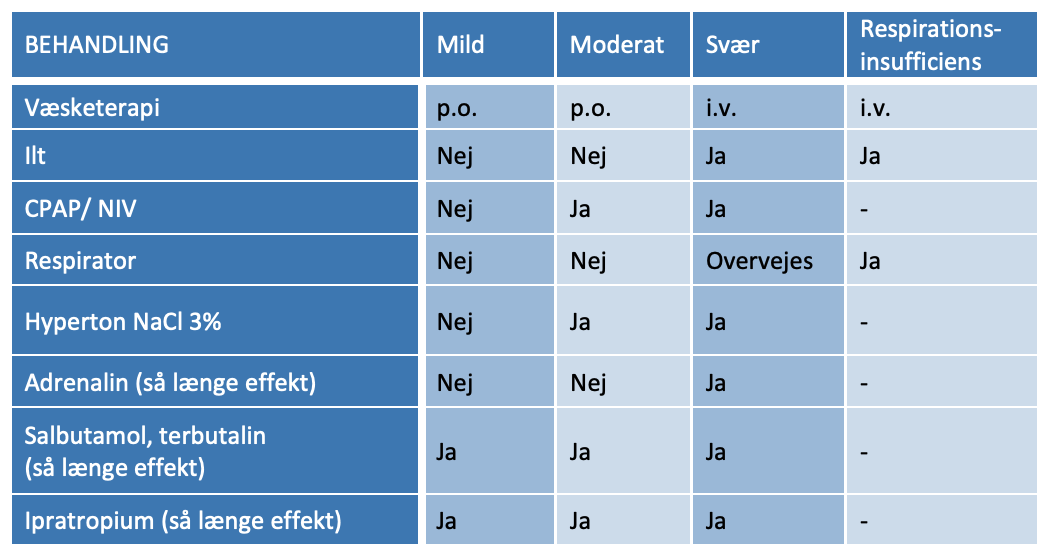
Tabel 4.2. Behandling af bronchiolitis
5. PSEUDOCROUP
Forfatter: Ole Pedersen
Korrespondance: ole.pedersen@rsyd.dk
Introduktion
Pseudocroup forårsages af, og er en komplikation til, en række forskellige virale luftvejsinfektioner, og ses hyppigst hos børn i alderen 6 måneder til 3 år, med højeste incidens i 2-års alderen. Oftest er der tale om markante symptomer men mild sygdom. Tilstanden kan (sjældent) udvikle sig til livstruende respirationsinsufficiens.
Pseudocroup er defineret ved gøende (croupal) hoste, hæshed og inspiratorisk stridor, udløst af subglottisk ødem, enten direkte inflammatorisk (laryngotracheitis m.fl.) eller reaktivt, svarende til det angelsaksiske begreb “spasmodic croup” som i Danmark formentlig sjældent fører til indlæggelse. Stridoren er betinget af delvis luftvejsobstruktion, og sker under inspiration, hvor den maximale forsnævring i luftvejen findes i den øvre, ekstrathoracale del af trachea.
Behandling har til formål at reducere luftvejsobstruktionen og mindske risikoen for respirationsinsufficiens, men ændrer ikke forløbet af den grundlæggende virale infektion.
Vurdering
Symptomer
Barnet præsenterer sig med hæshed, inspiratorisk stridor, ingen eller moderat feber og gøende (croupal) hoste i forbindelse med lettere viral øvre luftvejsinfektion. Ved udvikling af sygdommen forværres symptomerne. Tegn på forestående respirationssvigt er ændring i mental status, såsom træthed og sløvhed, bleghed, cyanose, mindre markante indtrækninger, aftagende respirationslyde med mindre stridor. Se skema 5.1, vurdering af pseudocroup.
Diagnostik
Diagnosen stilles klinisk ud fra anamnese og objektive fund. Primær undersøgelse og håndtering af barnet begrænses idet ophidselse forværrer situationen, og hverken blodprøver eller mikrobiologisk diagnostik bidrager til vurdering eller behandling i typiske tilfælde.
Differentialdiagnoser inkluderer:
- Difteri.
- Epiglottitis: høj feber, halssmerter, synkesmerter, savlen.
- Bakteriel laryngotracheitis: høj feber, toksisk, forudgået viral infektion.
- Retropharyngeal, peritonsillær absces: feber, savlen, smerter ved bevægelser af nakken.
- Angioødem.
- Fremmedlegemeaspiration.: pludselig indsættende hoste, ingen feber
Vurdering af sygdommens sværhedsgrad
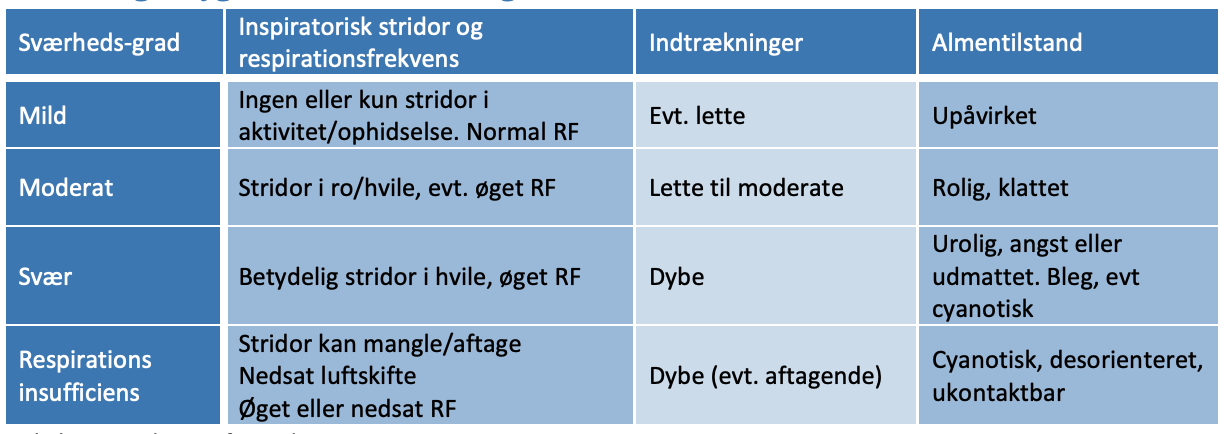
Tabel 5.1. Vurdering af pseudocroup
Brug af pulsoxymetri til vurdering af sygdommens sværhedsgrad er af mindre relevans. Fund af lav ilt-saturation er et sent tegn på svær forsnævring af trachea med betydelig risiko for bradykardi og kardiorespiratorisk stop. Hypoksi betinget af pseudocroup er indikation for intensiv behandling. Til hjælp i vurderingen af sygdommens sværhedsgrad kan benyttes Westley croup score, hvor mild pseudocroup scorer ≤ 2, moderat 3-7 og svær ≥ 8144.
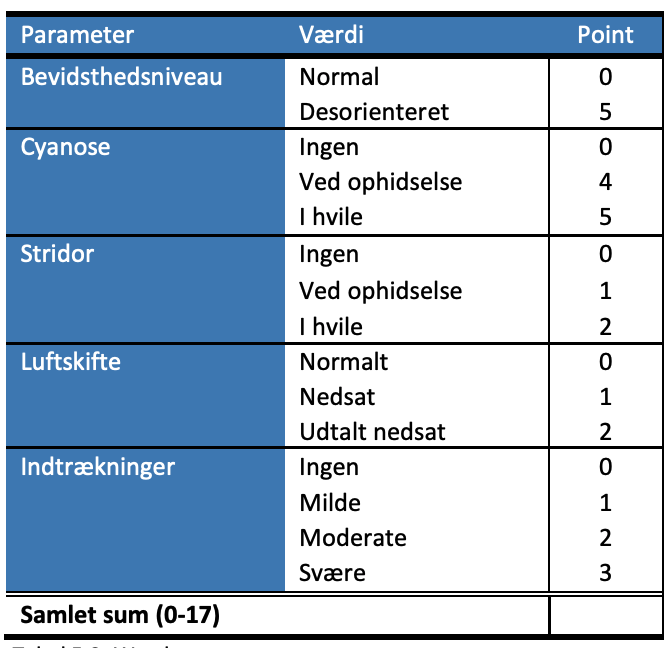
Tabel 5.2: Westley score
Behandling
Barnet med stridor bør håndteres roligt og unødige procedurer skal undgås. Et stresset, grædende barn genererer betydelige negative intrathoracale tryk, hvilket forstærker kollapset af det forsnævrede tracheale lumen, og en ond cirkel med øget stress og forværret vejrtrækning skabes. Behandlingsintensiteten afhænger af sygdommens sværhedsgrad, hvor børn uden stridor vanligvis ikke gives farmakologisk behandling, men råd om kold luft/koldt at drikke, smertestillende osv. Se tabel 5.3.

Tabel 5.3: Medicinsk behandling af pseudocroup
Ilt
Er indiceret til børn med hypoksi defineret som ilt-saturation under 92 %. Ilt administreres via maske som holdes få centimeter fra barnet ansigt, så barnet ikke bliver agiteret145.
Helium-oxygen (Heliox)
Glukokortikoider er en del af standardbehandlingen af pseudocroup med god effekt på symptomerne, men det tager tid før virkningen indsætter. I mellemtiden er barnet i risiko for udvikling af respiratorisk svigt. Mindre studier og kasuistikker tyder på, at Helium i blanding med oxygen kan lindre respiratorisk distress. Helium er en inert gas med lav vægtfylde uden farmakologisk eller biologisk effekt. Ved øvre luftvejsobstruktion nedsætter heliox turbulensen i luftstrømmen under respirationen og bedrer de kliniske symptomer. Imidlertid kan der ikke, i de få studier der foreligger, påvises signifikant effekt, hvorfor heliox ikke anbefales i behandlingen af pseudocroup146, 147.
Adrenalin
Inhalation af adrenalin reducerer slimhindeødemet i de inflammerede luftveje. Adrenalin er indiceret til børn med svær respiratorisk påvirkning med betydelig stridor, thoracale indtrækninger, takypnø og/eller almen påvirkning, samt agitation. Ofte ses symptomatisk bedring indenfor minutter, mens virkningen aftager efter 1 time. Inhalationen kan gentages hvert 10-15 minutter initialt. Dosis Adrenalin 1 mg/ml, 2 ml.
Under behandlingen monitoreres med pulsoximeter. Ved hyppige inhalationer skal monitoreres for eventuelle systemiske bivirkninger med puls- og blodtryksstigning.
Såfremt der er indikation for adrenalininhalation kan budesonid og adrenalin blandes og gives samtidig145, 148–150.
Respirator
Ved ringe respons af igangsat terapi med adrenalin eller hurtigt recidiv af svære symptomer trods gentagne inhalationer, skal intubation og respiratorbehandling overvejes145, 150, 151.
Glukokortikoider
Glukokorticoider er grundbehandlingen af pseudocroup. I flere randomiserede studier og metaanalyser, har steroider vist at reducere antallet og varigheden af respiratorbehandling, reintubationer og hospitalsindlæggelser, foruden færre kontakter til sundhedsvæsenet efterfølgende150, 152.
Behandlingen kan gives oralt, intramuskulært, intravenøst eller som inhalation.
- Inhalation: Administration af et forstøvet budesonid tager normalt mellem 10 og 15 minutter at administrere, og kan forårsage betydelig agitation hos barnet. Budesoniddosis er 0,5 mg/ml, 4 ml (2 mg). Kan administreres samtidig med adrenalin150
- Oralt: Prednisolon 1-2mg/kg (max 75mg/dosis). Kan gives i stedet for inhalation
- Intramuskulært, intravenøst: Methylprednisolon 2mg/kg (max 100mg), primært til patienter med behov for indlæggelse på intensiv afdeling. Hos intuberede eller fortsat ustabile patienter gentaget som 0,8mg/kg (max 50mg/dosis) x 4 i 1(-2)døgn
Børn med kronisk eller recidiverende stridor grundet fx. laryngo/tracheomalaci eller subglottisk stenose, tidligere svær pseudocroup, Trisomi 21 eller besværet mucocilliær clearence af anden årsag gives glukokorticoid på vid indikation.
Appendix 5. Vurdering og behandling af pseudocroup
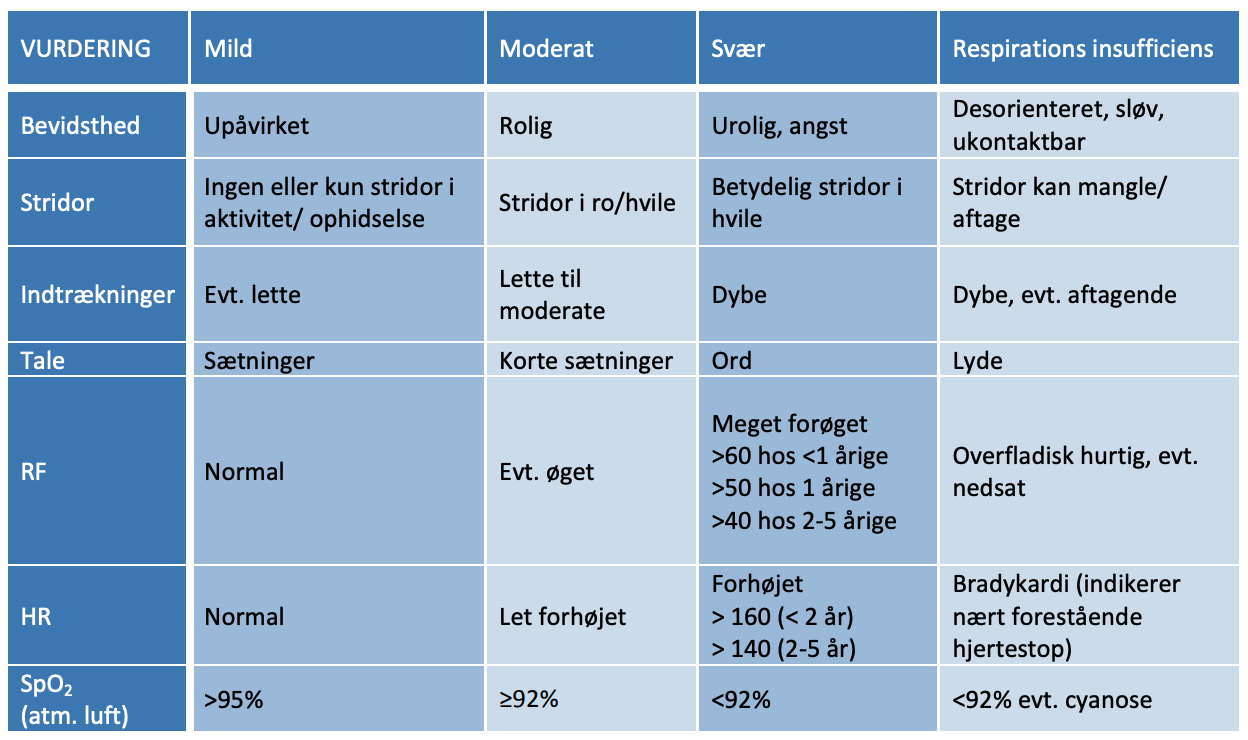
Tabel 5.4: Vurdering af pseudocroup
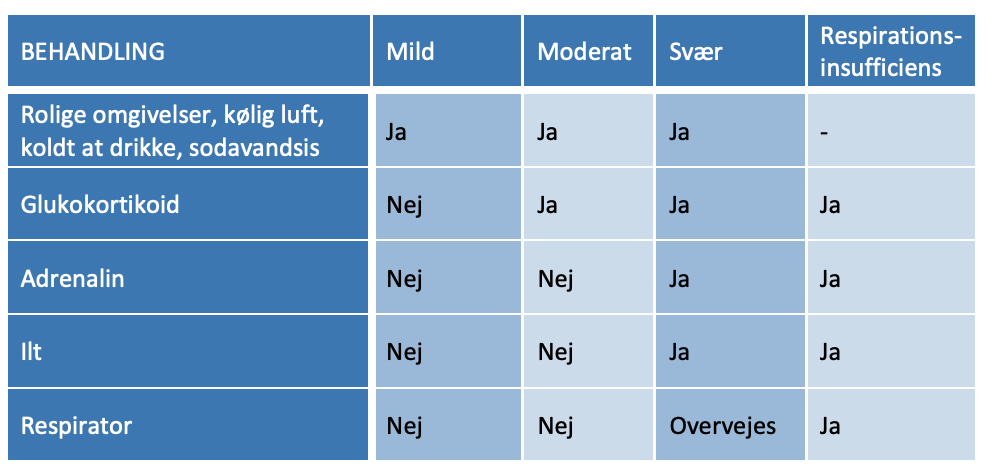
Tabel 5.5: Behandling af pseudocroup
6. RESPIRATORBEHANDLING AF BØRN
Forfattere: Pernille Opstrup, Marcela Carlsson, Søren Kjærgaard og Birgitte Schousboe
Korrespondance: marcela.carlsson@rsyd.dk
Indledning
Respiratorbehandling har været kendt siden 1920’erne, men fik for alvor sit gennembrud i 1950’erne med den store polio-epidemi, som primært ramte børn. Den hyppigste årsag til indlæggelse af børn på Intensiv afdeling (PICU) er behovet for respiratorbehandling153.
Afgrænsning af emne
Denne vejledning omhandler respiratorbehandling af kritisk syge børn på alment intensive afdelinger. Den omhandler derfor ikke respiratorbehandling under anæstesi. Principperne i vejledningen gælder for børn < 15 år, bortset fra neonatale børn, idet denne behandling i Danmark varetages i pædiatrisk regi. Både generelle principper og specifikke anbefalinger er de samme, uanset om barnet behandles på almindelig intensiv afdeling eller på specialiseret børneintensivt afsnit.
Kritisk sygdom hos børn med akut behov for respiratorisk støtte kan debutere hvor som helst. Derfor kan initial behandling og stabilisering af barnet samt indledning af respiratorterapi blive nødvendig på et sygehus, der ikke til dagligt har ansvar for kritisk syge børn. Respiratorbehandling af kritisk syge børn ligner i høj grad respiratorbehandling af voksne154 og en del anbefalinger er baseret på ekstrapolation fra voksne studier155.
Anatomi og respirationsfysiologi
Thoraxformen hos børn ændres fra at være tøndeformet med vandret stillede costae hos spædbørn til en mere flad brystkasse med skråtstillede costae hos de større barn. Intercostalsmuskulaturens andel af den samlede tidalventilation øges med stigende alder. Småbørn trækker primært vejret med diafragma. Da diafragma hos spædbørn har en umoden sammensætning af muskelfibre, sker der hurtigt en udtrætning, når respirationsarbejdet øges. Thoraxvæggens compliance er hos spæd- og småbørn nærmest uendelig pga. manglende ossifikation af costae og den svage intercostalmuskulatur, og funktionel resicualkapacitet (FRC) opretholdes primært ved konstant tonus i diafragma. Der ses derfor typisk indtrækninger subcostalt og senere intercostalt og sternalt under udvikling af respirationsinsufficiens64.
Lungerne hos børn indeholder endvidere et mindre antal alveoler end hos voksne og er umodne af opbygning. Spædbørns pulmonale reserve er nedsat, idet FRC/TLC ratio er betydeligt lavere end større børn. FRC i absolutte tal (ml/kg) er imidlertid ens uanset alder. Øget metabolisme hos børn medfører øget behov for alveolær ventilation (alveolær ventilation/FRC er 5:1 i forhold til 1,5:1 hos voksne)156. Iltforbruget er højt sammenlignet med voksne (gennemsnitligt iltforbrug hos spædbørn er 7-8 ml/kg/min mod 3-4 ml/kg/min hos voksne). Hos børn < 6år er closing capacity (CC) større end FRC, hvilket medfører høj risiko for atelektasedannelse i forbindelse med anæstesi og mekanisk ventilation.
Normalværdier for respirationsfrekvens for børn i forskellige aldre157
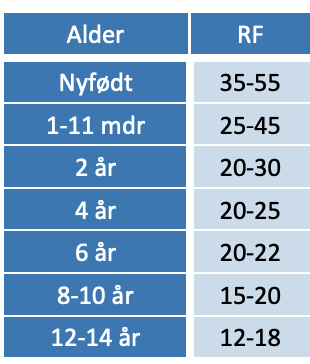
Tabel 6.1. Normalværdier for respirationsfrekvens
RFstiger ved feber med 4-10 min-1 per grad Celcius.
Kliniske rekommandationer
Andelen af børn behandlet med respirator indlagt i PICU varierer i forskellige opgørelser op til 55 %.
Indikationer for respiratorbehandling
- Respiratorisk svigt
- Cirkulatorisk svigt
- CNS sygdom
- Sikring af luftvejene
Mortaliteten blandt respiratorbehandlede børn blev opgjort til 58,3 %, mens den samlede mortalitetsrate i PICU i øvrigt var 12,2 %158–160.
Mål med behandlingen161
- at genoprette den alveolære ventilation og dermed normalisere gasudvekslingen.
- at aflaste det respiratoriske arbejde ved udtrætning af respirationsmuskulaturen,
- at reducere det systemiske og/eller myocardielle oxygenforbrug ved at reducere det respiratoriske arbejde
Respiratorstrategi
Anbefalingerne for respiratorbehandling af børn er overvejende baseret på ekstrapolation fra voksne studier154, 155. Overordnet er der tale om lungeprotektiv ventilation: lavt tidalvolumen (TV), lavt luftvejstryk og lav FiO2 for at nedsætte den skadevoldende effekt af overtryksventilation. Ventilation Associated Lung Injury (VALI) kan forværre eller vedholde SIRS. Der findes ingen prospektive studier omhandlende anvendelse af LPV til pædiatriske patienter, men retrospektive studier har vist færre komplikationer, signifikant lavere mortalitet og flere respirator frie dage 162, 163.
Anbefalinger
- Initial respiratormodus: PC eller VC
- Tidalvolumen: 4-6ml/kg
- Respirationsfrekvens aldersafhængig
- Plateau tryk <30cmH2O
- FiO2 < 0,6
- PEEP: 5-10 cmH2O
- I:E ratio 1:2
- Behandlingsmål: PaO2:8-11 kPa.
- Behandlingsmål: PaCO2: 4,5-6,0 kPa.
Ved svært respiratorisk svigt kan permissiv hyperkapni (pH>7,20) anvendes for at reducere plateautryk < 30 cmH2O, med mindre patienten har højt ICP eller udtalt acidose164. Ligeledes kan permissiv hypoxæmi overvejes hos det kredsløbsstabile barn med normal hæmoglobin165, 166.
PEEP
PEEP skal indstilles med henblik på at holde FRC over closing volume i ekspirationsfasen og herved modvirke mikroatelektaser. I klinisk praksis justeres PEEP mellem 5-10 (20) cmH2O, øges progressivt med 2-3 cmH2O til saturation kan holdes ml. 90-95 % med en FiO2 < 0,6. Samtidig skal barnet monitoreres for tegn på hæmodynamisk instabilitet.
Tegn på for lavt PEEP kan være fald i saturation og bedring af compliance ved øgning af PEEP. Tegn på at det indstillede PEEP er for højt, er bedring af compliance ved sænkning af PEEP, stabil eller bedret PaO2/FiO2 ved lavere PEEP og fald i CO2 ved reduktion i PEEP.
Rekruttering
Lungerekruttering af børn anses for at være en specialist-opgave.
Da rekruttering kan have skadelige hæmodynamiske og respiratoriske effekter (voksne), er rekommandationen på nuværende tidspunkt begrænset til den tidlige fase af svær ARDS. Lungerekruttering bør ikke benyttes som rutinemæssigt hos børn, men kan benyttes ved tidlig ARDS og svær hypoxæmi167–169.
Forslag til rekrutteringsprocedure:
- Monitorering med invasivt arterietryk, pulsoximetri og EKG
- Indstil FiO2 100% og bibehold aktuelle RF
- Indstil øvre alarmgrænser for tryk og PEEP hensigtsmæssigt
- Respiratormodus: PC indstillet til et drivende tryk (peak inspiratorisk tryk minus PEEP) på 15 cmH2O
- Hvert 2. minut øges PEEP med 5 cmH2O til maximalt PEEP på 25 cmH2O
- Herefter findes det optimale PEEP-niveau ved at reducere PEEP med 5 cm H20. Hvis compliance (Cdyn) er ens på 2 PEEP-niveauer, sættes det optimale PEEP-niveau til det laveste niveua plus 2 cmH2O.
Kriteriet for umiddelbar ophør med rekruttering er vedvarende saturation < 85 % i 1 minut, hypotension eller bradykardi. Ved reduktion af MAP > 20 % anbefales bolus NaCl isot. 10 ml/kg. Hvis hypotension persisterer, afbrydes rekruttering. Røntgen af thorax efter rekruttering bør overvejes mhp. komplikationer. Lungerne hos børn er mere vulnerable overfor VALI end hos voksne
Aftrapningsstrategi
Da respiratorbehandling kan være forbundet med komplikationer, ønskes varigheden af behandlingen så kort som muligt. Der er begrænset litteratur om aftrapning og valg af ekstubationstidspunkt hos børn, hvorfor det i praksis beror på en klinisk vurdering. Der anbefales:
- Kontrol af grundmorbus
- ABC-stabilitet på aktuel behandling
- Etableret/stabil spontan respiration (fx. PS)
- Vågent barn uden abstinenser
- Test af lækage omkring trachealtuben
Ved klinisk vurdering af ekstubationstidspunkt ses behov for reintubation i 2-20 % uafhængigt af længden af respiratorbehandling. Det største problem efter ekstubation af børn er den øvre luftvejsobstruktion170.
Der kan udføres Spontaneous Breathing Test (SBT) ved anvendelse af T-stykke med ilttilskud eller Pressure Support (PS) med minimal trykstøtte. Over 30-120 minutter observeres der for tegn på respiratorisk stress.
Et pilotstudie har dog vist, at protokolleret aftrapning af behandlingen hos børn kan forkorte varigheden af respiratorbehandling171.
Komplikationer til respiratorbehandling172
- Atelektaser
- Post-extubations-stridor
- Accientiel extubation
- Pneumothorax
- Vævsskader til naso- og oropharynx
- Ventilator Associeret Pneumoni (VAP)
Incidensen af VAP refereres i forskellige studier til at være mellem 2 og 5 %, således en relativ sjælden komplikation, men associeret med betragtelig øget morbiditet og mortalitet173. Der kan opnås markant reduktion i incidens af VAP ved implementering af VAP-pakke:
Forebyggelse af VAP hos børn:
- Håndhygiejne
- Eleveret hovedgærde 30-45 grader til spædbørn og store børn
- Daglig mundhygiejne
- Skift af respiratorslanger/cirkel kun ved synlig forurening
Accidentiel ekstubation og efterfølgende reintubation er forbundet med øget risiko for udvikling af VAP.
NIV
Anvendelsen af non-invasiv ventilation (NIV) er tiltaget i pædiatrisk regi over det sidste tiår. NIV anses for at være en veltolereret behandling til børn. Den er associeret med faldende antal intubationer og dermed færre komplikationer174.
Afhængig af lokale forhold og alderssvarende udstyr (masker) kan NIV benyttes til børn under nøje observation og intubationsberedskab.
Bugleje
Ved svært hypoksisk lungesvigt kan bugleje overvejes, men hos børn findes der ingen evidens på nuværende tidspunkt for effekt (bugleje øger ikke antallet af respiratorfrie dage eller forbedret klinisk outcome hos patienter med acute lunge injury) 175.
High Frequency Oscillation Ventilation
High Frequency Oscillation Ventilation (HFOV) kan overvejes ved svigt af konventionel respiratorbehandling. HFOV har været anvendt igennem længere tid til neonatale og betragtes som en rescue-behandling til børn med behandlingsrefraktær svær hypoxæmi. HFOV opfylder teoretisk alle kravene til lunge protektiv ventilation med små tidalvolumina, stabile/konstante om end høje middeltryk i luftvejene samt vedvarende rekruttering. En retrospektiv opgørelse har vist, at forbedret oxygenering efter 24 timers behandling er associeret med bedret overlevelse176.
Extracorporeal membran oxygenering
ECMO betragtes (i lighed med HFOV) som en rescue-behandling til børn med behandlingsrefraktær svær hypoxæmi. Indikation for denne behandling er arterielle ilttension < 8 kPa trods 100 % O2, højt plateautryk og manglende udsigt til bedring inden for de nærmeste timer. Konferer med Intensiv AUH-Skejby 7845 1019 (barn > 1md gammel) eller GN 3545 1327 på Rigshospitalet (barn < 1md gammel).
Færdigheder
Afdelinger godkendt til respiratorbehandling af børn bør sikre døgndækning af personale med kompetencer i intubation, behandling og observation af børn samt følgende udstyr:
- Børneslanger og -filtre til børn < 20 kg for at sikre lavt kompressivt volumen og deadspace
- Monitorering i form af EKG, pulsoximetri, kapnografi og arterielt blodtryksmåling (anbefales).
- Udstyr til nødprocedure ved fx. accidentiel ekstubation skal forefindes på stuen, samlet klar til brug.
Det er hensigtsmæssigt at skabe fysiske rammer til børn i respirator, der tillader at mindst en af forældrene kan opholde sig og eventuelt overnatte ved siden af barnet.
Anbefalinger vedrørende respiratorterapi af kritisk syge børn
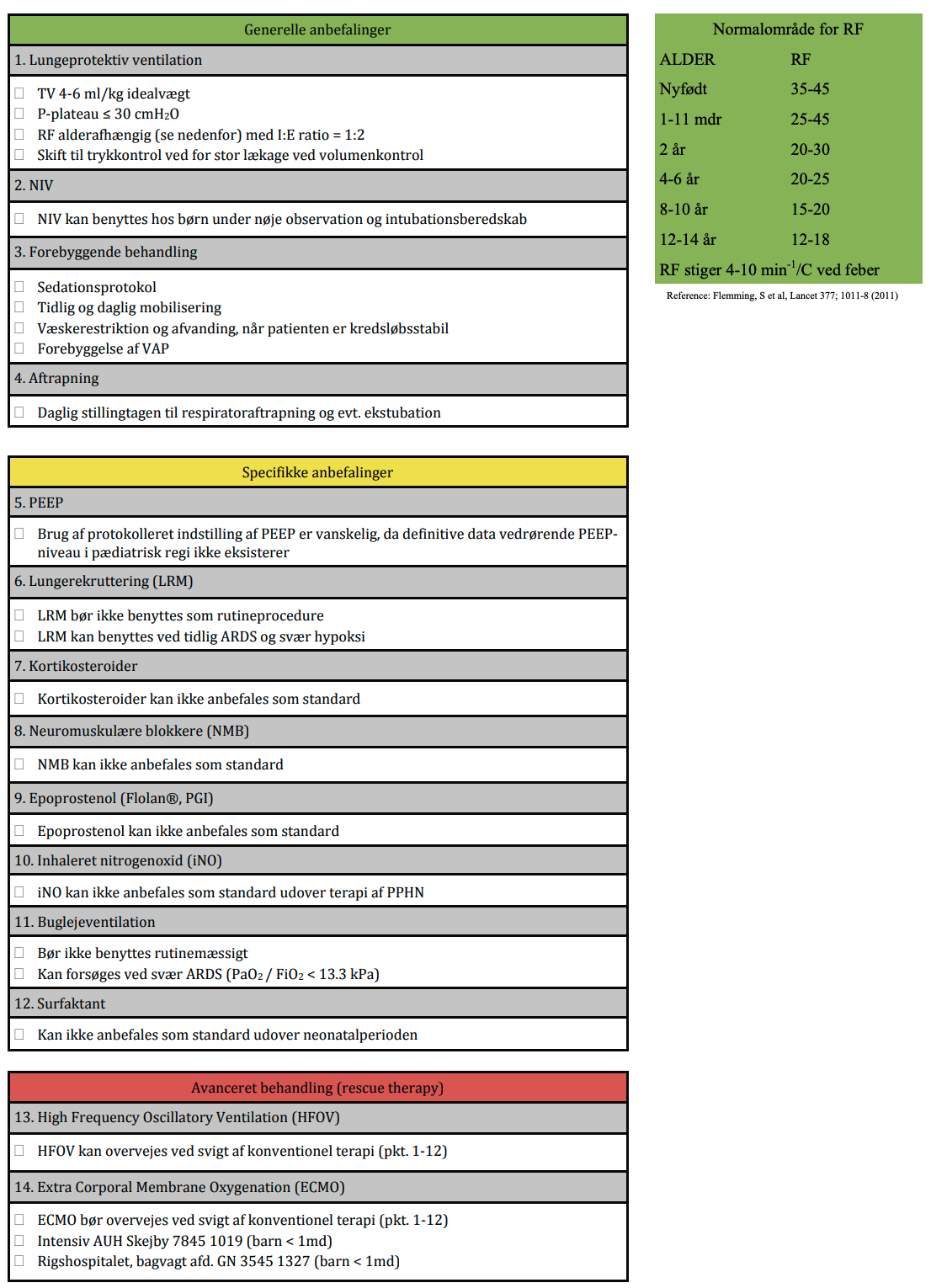
7. SEPTISK SHOCK HOS BØRN
Forfattere: Lasse Høgh Andersen, Niels Risør Hammer, Rolf Dall, Jakob Gjedsted, Kaare Engell Lundstrøm
Korrespondance: lasse.andersen@dadlnet.dk
Resumé
- Erkend septisk shock ved infektion ledsaget af tegn på utilstrækkelig vævsperfusion. Hypotension og laktatstigning er ikke altid tilstede
- Stabilisering efter ABCDE-principperne. Intraossøs adgang, hvis venflon ikke kan anlægges hurtigt, især ved nedsat blodtryk
- Væskeresuscitation med isoton krystalloidvæske og/eller human albumin 5% 20 ml/kg over 5-10 min. gentaget efter behov. Revurdér kliniske tegn på shock og evt. tegn på begyndende overhydrering mellem hver væskebolus. Aggressiv bolusterapi bør ikke anvendes ved sepsis uden shock
- Behandlingmål omfatter: Normalisering af bevidsthedsniveau, normalisering af hjerteaktion, kapillærresponstid < 2 sek. varme ekstremiteter, BTsystolisk > 70 + (2 x alder (år)) mmHg, diurese ≥ 1 ml/kg/t, laktat < 2 mM, base excess -2 til +2. Hvis invasiv monitorering haves: ScvO2 ≥ 70%, CVP 8-12 mmHg, cardiac index 3,3-6,0 L/min/m2
- Vasoaktiv behandling opstartes simultant med væskeresucitation ved svært shock og senest efter indgift af væske svt. 60 ml/kg ved fortsat shock
- Dopamin eller adrenalin kan anvendes som førstevalgsbehandling uanset kredsløbstilstanden men er især indicerede ved “koldt shock”, hvor kredsløbet er præget af nedsat cardiac output og vasokonstriktion
- Noradrenalin anvendes som førstevalg ved “varmt shock”, hvor kredsløbet er præget af vasodilatation og normalt/øget cardiac output
- Opstart af vasoaktiv terapi må ikke afvente CVK-anlæggelse. Dopamin eller adrenalin kan opstartes i venflon eller intraossøs adgang
- Dyrkning og tidlig indsættelse af bredspektret antibiotisk behandling < 1 time
- Fokussanering om muligt: Kirurgi, perkutan drænage eller fjernelse af inficerede devices
- Steroid shock-reversal er indiceret ved katekolamin-resistent shock (fortsat shock trods optimal ino-pressor behandling) OG verificeret eller begrundet mistanke om binyrebarkinsufficiens. Dosis hydrocortison 50 mg/m2 BSA/døgn
- Korriger anæmi (Hb < 6 mmol/l de første 6 timer, herefter Hb < 4,5 mmol/l). Regulér blodsukker > 10 mM under hensyntagen til børns øgede risiko for hypoglykæmi. Normalisér elektrolytter inkl. calcium
- Respiratorbehandling på vanlige indikationer samt evt. til CVK-anlæggelse
- Dialysebehandling ved anuri/oliguri trods væskeresuscitation, helst inden vægtøgning > 10%
- Refraktært septisk shock: Overvej anden genese til shock – gennemgå tjeklisten (se senere). Overvej ECMO
- Neonatal sepsis: Behandles på mistanken alene. Væskebolus 10 ml/kg. Udeluk mb. cordis differentialdiagnostisk. Dopamin førstevalg ved inotropibehov. Obs tendens til hypoglykæmi. Blodtransfusion ved Hb < 6-7,5 mM
Indledning
Om denne guideline
Formålet med denne vejledning er at støtte den enkelte kliniker i behandlingen af børn med septisk shock. Målgruppen for denne vejledning omfatter læger på generelle intensive afdelinger, hvor initial stabilisering af kritisk syge børn kun lejlighedsvis foretages. Principperne er dog de samme som ved behandling på afdelinger med specialfunktion i intensiv terapi til børn.
Vejledningen vedrører behandling af septisk shock hos børn fra fødsel til pubertet. Den fysiologiske overgang fra barn til voksen sker gradvist, hvorfor afgrænsningen opadtil er noget arbitrær. Vejledningens anbefalinger er i særlig grad relevante for mindre børn, mens større børn ofte med god ret kan behandles som “små voksne”. Evidensen bag anbefalinger for behandling af septisk shock hos børn er generelt svagere end hos voksne. Til trods for, at der de seneste år er publiceret en del højkvalitetesstudier af emnet, må en del anbefalinger fortsat baseres på ekstrapolation fra voksenstudier.
Baggrund
På verdensplan udgør infektionssygdomme den hyppigste dødsårsag blandt børn177. En stor del af disse børn dør ultimativt af hypovolæmi eller septisk shock. Incidensen af septisk shock blandt danske børn kendes ikke, men i en amerikansk opgørelse er incidensen af svær sepsis anslået til 56 pr. 100.000 børn pr. år178. Forekomsten af svær sepsis og septisk shock på pædiatriske intensiv afdelinger varierer med optageområde og indlæggelseskriterier179, 180. Blandt børn med svær sepsis i USA er mortaliteten fundet at være 10% på tværs af alle aldersgrupper, hvilket er lavere end blandt voksne. Højeste mortalitet ses blandt børn med komorbiditet med højeste case fatality rate ved infektioner med pneumokokker og svampe. Neuroinfektioner, endocarditis og primær bakteriæmi har højere dødelighed end sepsis udgående fra andre foci. Mortaliteten stiger fra 7% ved monoorgansvigt til 53% ved fire organsvigt178. En italiensk opgørelse blandt børn indlagt på PICU angiver mortalitet stigende fra 4% ved sepsis, 24% ved svær sepsis til 51% ved septisk shock179. I en tilsvarende opgørelse fra en enkelt PICU i USA var mortaliteten ved septisk shock 14%, stigende fra 0% blandt tidligere raske børn til 16% blandt kronisk syge børn181. Mortaliteten reduceres kraftigt ved anvendelse af goal directed therapy182.
Forskelle fra voksne
- Mange børn med sepsis har en tilgrundliggende lidelse. Fordelingen af prædisponerende faktorer varierer med alderen. Hos neonatale dominerer respiratorisk og kardiel komorbiditet, hos småbørn dominerer neuromuskulære og hæmatologiske/immunologiske sygdomme, og hos større børn dominerer maligne lidelser178, 179. Andre disponerende faktorer kan være urinvejslidelser, medfødte eller erhvervede immundefekter eller svær fejlernæring. Ydre prædisponerende faktorer er sår, brandsår, traumer, ethvert invasivt device, kronisk antibiotikaforbrug samt immunosuppressiv behandling inklusiv kemoterapi.
- Hyppigste foci er luftveje og primær bakteriæmi fulgt af infektioner i CNS, abdomen, bløddele og urinveje. En stor del af patienterne har uafklaret fokus178, 179.
- Hyppigste bakterier i internationale opgørelser er stafylokokker (alle typer), streptokokker (inkl. pneumokokker) og pseudomonas arter. Svampeinfektioner ses ikke sjældent hos immunsupprimerede178, 179. Det ætiologiske spektrum afhænger bl.a. af endemiske forhold, nationalt antibiotikaforbrug og vaccinationspraksis. I Danmark er hyppigheden af invasiv pneumokok-sygdom således aftaget kraftigt efter indførsel af pneumokok-vaccination i børnevaccinationsprogrammet, ligesom haemophilus langt sjældnere forårsager meningitis efter indførsel af vaccination183, 184.
- Ved septisk shock hos børn er kredsløbssvigtet, modsat hos voksne, hyppigere karakteriseret ved nedsat cardiac output end ved nedsat kredsløbsmodstand185.
Diagnose
Definition af septisk shock hos børn
Shock defineres som en klinisk tilstand med utilstrækkelig vævsperfusion, hvor ilttilbuddet til vitale organer er mindre end behovet medførende varierende grader af organsvigt25. Den videnskabelige definition af septisk shock hos børn er for praktiske formål identisk med voksen-definitionen blot med aldersrelaterede vitalparametre. Septisk shock defineres som sepsis ledsaget af kredsløbssvigt (hypotension, behov for inotropi/vasopressor eller min. to af følgende: Metabolisk acidose med base-excess < -5 uden anden årsag, forhøjet laktat, oliguri < 0,5 ml/kg/t, forlænget kapillærresponstid > 5 sek. eller forskel mellem kerne- og hudtemperatur > 3˚C) trods væskeindgift ≥ 40 ml/kg indenfor én time186.
Klinisk diagnose
Diagnose og behandling må ikke afhænge af forsinkende biokemiske undersøgelser eller invasive målinger. Derfor er der udarbejdet en rent klinisk diagnose af septisk shock hos børn, som det anbefales at anvende initialt. Det er vigtigt at erkende, at hypotension og laktatstigning langt fra altid er tilstede78:
- Mistænkt infektion ledsaget af hyper- eller hypotermi OG
- Kliniske tegn på utilstrækkelig vævsperfusion, dvs.:
- Nedsat bevidsthedsniveau (sløv eller irritabel) ELLER
- Nedsat timediurese < 1 ml/kg/t ELLER
- Forlænget kapillær responstid > 2 sek. svage perifere pulse, kølige marmorerede ekstremiteter (“koldt shock” ) ELLER
- Momentant kapillærrespons, kraftige perifere pulse og øget pulstryk (systolisk BT minus diastolisk BT) (“varmt shock”).
Hypotension eller laktatstigning er langt fra altid tilstede og er ej heller påkrævet for at stille shock-diagnosen.
Differentialdiagnoser til sepsis ved shock hos børn
Kredsløbssvigt hos børn kan have flere årsager, og i visse tilfælde er tilstanden multifaktoriel. Dette gælder ikke mindst ved septisk shock.
Årsager til shock omfatter:
- Hypovolæmisk shock: Blødning, væsketab (diarré, opkast, forbrænding, polyuri mv.)
- Kardiogent shock: Kongenit mb. cordis, hjertesvigt, arytmi
- Distributivt shock: Sepsis, anafylaksi, neurogent shock
- Obstruktivt shock: Trykpneumothorax, hjertetamponade, lungeemboli, abdominal compartmentsyndrom
- Metabolisk shock: Hypoglykæmi, hypotermi, hypoksi, acidose, svær anæmi, binyrebarkinsufficiens, hypothyreoidisme
- Dissociativt shock: Kulilte-forgiftning, cyanid-forgiftning
Ved behandling af kredsløbssvigt hos børn bør følgende haves in mente:
- Blødning mistænkes indtil andet er bevist hos børn, der nyligt har været udsat for operation eller fysisk traume
- Hypovolæmi er den hyppigste årsag til kredsløbssvigt hos børn. Flere øvrige shock-tilstande vil desuden bedres med øget intravaskulært volumen. Som hovedregel gives derfor væske ved shock, medmindre der er klare tegn på overhydrering/stase.
- Fejl-måling af blodtryk mistænkes ved hypotension hos et relativt upåvirket barn. Mål på begge arme. Kontroller højde af tryk-transducer ved invasiv blodtrykssmåling.
- Iatrogent? Overvej altid, om pågående behandling kan være årsag eller medvirkende årsag til tilstanden. Medicin (navnlig sedativa, analgetika og hjertemedicin) kan have udløst eller forværret tilstanden.
Behandling
Behandlingsstrategi
Resuscitation efter ABC-princippet. Tidlig, adækvat væskebehandling. Tidlig brug af inotropi og evt. vasopressorer. Tidlig brug af bredspektret antibiotika < 1 time. Kirurgisk sanering af infektionsfokus om muligt. Se figur 1 for flowchart vedrørende behandling.
Behandling må aldrig udsættes mhp. anlæggelse af CVK eller arterie-kanyle, der kan være meget tidskrævende at anlægge hos børn. Inotropi/vasopressorer kan opstartes i perifert venflon eller intraossøs adgang.
Væskebehandling
- Hvilken væske?: Isoton krystalloidvæske, dvs. enten NaCl eller Ringer-laktat. Som kolloid kan albumin 5% anvendes men frembyder næppe nogen fordel. Syntetisk kolloid anvendes ikke pga. risiko for nyresvigt og død (ekstrapolation fra voksendata). På nogle centre har man rapporteret om gode resultater med brug af albumin 5% som primær resuscitationsvæske, men der eksisterer ingen egentlig evidens herfor, hverken hvad angår potentielle fordele eller ulemper. Andre anbefaler, at albumin i hvert fald overvejes, hvis fortsat væskebehov efter indgift ≥ 60 ml/kg initialt. Blodprodukter anvendes kun på specifik indikation.
- Hvor meget?: Initial resuscitation med bolus á 20 ml/kg over 5-10 minutter. Skal ofte gives x 2-3 i den første time, men langt mere kan være påkrævet. Ved svært shock anbefales opstart af inotropi samtidigt med væskeresuscitation. Væskeindgiften reduceres væsentligt, hvis den ikke ledsages af hæmodynamisk bedring og der samtidig er tegn på adækvat fyldning af hjertet.A
- Hvilken vej?: Intravenøst eller intraossøst (overvejes tidligt). CVK anlægges først når væske-, antibiotika- og inotropi/vasopressor-infusion er påbegyndt i perifer adgang. Patienter med shock, der responderer tilstrækkeligt på væskeindgift, monitoreres non-invasivt.
Behandlingsmål
Væske- og kredsløbsterapi vejledes af kliniske mål for shock, cardiac output og perifer kredsløbsmodstand, dvs. hjertefrekvens, timediurese, kapillærresponstid, bevidsthedsniveau. Der kontrolleres for tegn på akut overhydrering i form af nyopstået hepatomegali, dyspnø, hypoksi, lungekrepitation, lungeødem eller stigende CVP uden ledsagende stigning i blodtryk (nedsat MAP ÷ CVP).
- Systolisk blodtryk. Anbefales ikke som selvstændig resuscitationsparameter, da børn kan opretholde et normalt BT trods større volumendeficit. Det skal bemærkes at non-invasiv blodtryksmåling er relativt upålideligt på børn < 5 år. Placering af arteriekanyle i a. radialis foretrækkes. Ved manifest hypotension kan komplet kredsløbskollaps forventes når som helst, og derfor anbefales følgende værdier som nedre normalværdier:
- 0 – 1 mdr: 50-60 mmHg
- o 1 – 12 mdr: 70 mmHg
- 1 – 10 år: 70 + (2 x alder (år)) mmHg
- >10 år: 90 mmHg
Blodtryksværdier skal tolkes i fht. den samlede kliniske tilstand. Et systolisk blodtryk på netop 70 + (2 x alder) er fuldt tilstrækkeligt hos et sederet barn > 1 år, hvis der i øvrigt er tegn på acceptabel organperfusion (diurese, kapillærrespons), men vil være bekymrende hos et usederet eller klinisk påvirket barn.
- Hjerteaktion. En relativt uspecifik parameter. Mål: Normalisering mod alderssvarende værdier. Trend vigtigere end absolut værdi. Faste grænseværdier er vanskelige at definere. Følgende foreslås som guide157:
- 0 – 3 mdr: 100-180
- 3 mdr – 2 år: 85-170
- 2 – 10 år: 60-150
- >10 år: 50-100
- Perifere pulse. Mål: Normale perifere pulse uden forskel mellem central og perifer puls.
- Kapillærresponstid. Mål: < 2 sekunder centralt
- Hud. Mål: Varme ekstremiteter
- Diurese. Mål: Timediurese ≥ 1 ml/kg/time
- CNS. Mål: Normalisering af bevidsthedsniveau
- Centralvenøs ilt-saturation (ScvO2). Mål: ≥70 %. Ligesom hos voksne er det vist, at goal-directed therapy vejledt af bl.a. ScvO2 mindsker mortaliteten ved septisk shock. Har begrænset værdi ved cyanotisk kongenit mb. cordis samt svær lungesygdom. Hvis CVK ej haves, kan kapillærresponstid < 2 sek. bruges som surrogatmål svt. ScvO2 ≥ 70%.
- CVP. Mål: CVP 8-12 mmHg (ekstrapolation fra voksendata). Større stigning i CVP uden ledsagende stigning i blodtryk (MAP) tyder på overhydrering.
- Laktat. Mål: Faldende og min. < 4 mM, helst < 2 mM.
- Base excess (BE). Mål: Aftagende metabolisk acidose, fx mod BE -2 til +2 mM
- Hæmoglobin. Mål: Hb > 6,0 mmol/l ved septisk shock ledsaget af lav ScvO2 eller ved septisk shock i de første 6 timer af behandlingen. Herudover er målet Hb. > 4,5 mmol/l.
- Cardiac output. Avanceret kredsløbsmonitorering anbefales ved refraktært septisk shock mhp. at opnå cardiac index på 3,3-6,0 L/min/m2 .
- PiCCO. PiCCO-katetre str 3F (1,0 mm), 7 cm kan anlægges i a. femoralis på børn med kropsvægt ≥ 7 kg. PiCCO termodilutions-cardiac output er valideret hos kritisk syge børn. Pulskontur-deriverede værdier samt EVLWI og ITBVI er sparsomt validerede og bør ikke lægges til grund for terapeutiske beslutninger.
- Ekkokardiografi. Kontakt (børne-)kardiolog mhp. ekkokardiografi for vurdering af fyldningsgrad, pumpefunktion, klapfejl og evt. kongenit mb. cordis inkl. intrakardielle shunts. Ikke-kardiologisk ekkokardiografi (FATE eller lign.) kan forsøges, men med betydeligt forbehold i fortolkningen. Ekkokardiografi af børn er en ekspertopgave.
- A.Pulmonalis-kateter. Swan-Ganz katetre anvendes i helt særlige tilfælde til børn, typisk i forbindelse med hjerteoperationer eller ved svær pulmonal hypertension.
__________________________
A Et afrikansk studie (FEAST-trial) har sået tvivl om den gavnlige effekt af aggressiv væskeresuscitation med bolusindgift, men resultaterne lader sig vanskeligt overføre til danske forhold. Hos septiske børn uden shock bør væskeresuscitation med store bolus-doser undgås.
Vasoaktiv terapi
Inotropi, vasopressorer eller vasodilatorer kan være påkrævet i den initiale resuscitation, selv før hypovolæmi er korrigeret. Septisk shock kan manifestere sig med forskellige kombinationer af påvirket cardiac output og/eller påvirket kredsløbsmodstand på forskellige stadier af sygdom (og behandling) hos det enkelte barn. Behandlingen skal justeres derefter. Hos børn er kredsløbssvigtet hyppigere præget af nedsat cardiac output end af nedsat kredsløbsmodstand (modsat hos voksne).
Præparatvalg
Er man i tvivl om kredsløbstilstanden, kan dopamin eller adrenalin anvendes som generelt førstevalg, da de har både inotrop og vasokontraherende effekt.
- “Koldt shock”: Ved tilstand præget af nedsat cardiac output og perifer vasokonstriktion anbefales det at anvende dopamin eller adrenalin som førstevalg. Alternativt kan anvendes dobutamin. men kun ved normalt BT.
- “Varmt shock”: Ved tilstand præget af vasodilatation og normalt eller øget cardiac output kan noradrenalin anvendes som førstevalg.
- Ved manglende effekt af ét præparat adderes eller skiftes til anden vasoaktiv terapi.
Præparater
Det anbefales, at inotropi/vasopressorer opblandes som efter vægt. Grundlæggende anvendes doseringer ift. vægt som til voksne.
- Dopamin: Kan anvendes som førstevalg ved væskerefraktært shock. Især indiceret ved “koldt shock”. Ved manglende bedring trods infusionhastighed ≥ 10 µg/kg/min bør skiftes til eller suppleres med andet vasoaktivt stof.
- Dosisinterval: 1-20 (max. 30) µg/kg/min. Ved doser < 15 µg/kg/min primært øget cardiac output, HR og nyregennemblødning. Ved doser herover tiltagende vasopressoreffekt.
- Anbefalet startdosis: 5 µg/kg/min.
- Kan opstartes i perifer adgang
- Blandingsforslag: Dopamin 6 mg/kg opblandes til i alt 100 ml med isoton glucose eller NaCl. Infusion 1 ml/t = 1 µg/kg/min
- Adrenalin: Alternativt førstevalg eller som tillægsbehandling. Især indiceret ved “koldt shock”.
- Dosisinterval: 0,05-0,3 (- max. 1,0) µg/kg/min. Ved doser < 0,3 µg/kg/min primært β-adrenerg effekt. Ved doser herover tiltagende vasopressoreffekt.
- Anbefalet startdosis: 0,05-0,10 µg/kg/min.
- Kan opstartes i perifer adgang
- Blandingsforslag: Adrenalin 0,06 mg/kg opblandes til i alt 100 ml med isoton glucose eller NaCl. Infusion 1 ml/t = 0,01 µg/kg/min.
- Noradrenalin: Kan anvendes som førstevalg ved “varmt shock” præget af vasodilatation.
- Dosisinterval: 0,05-0,3 (- max 1-2) µg/kg/min.
- Anbefalet startdosis: 0,05-0,10 µg/kg/min.
- Frarådes at opstarte i perifer adgang
- Blandingsforslag: Nordrenalin 0,06 mg/kg opblandes til i alt 100 ml med isoton glucose eller NaCl. Infusion 1 ml/t = 0,01 µg/kg/min
- Dobutamin: Kan anvendes ved shock-tilstande karakteriseret ved kliniske tegn på lavt cardiac ouput og høj/normal kredsløbsmodstand (kolde ekstremiteter, forlænget kapillærresponstid, nedsat diurese men med normalt blodtryk efter væskeresuscitation).
- Dosisinterval: 2-20 (max 40) µg/kg/min.
- Anbefalet startdosis: 5 µg/kg/min.
- Kan opstartes i perifer adgang
- Blandingsforslag: Dobutamin 6 mg/kg opblandes til i alt 100 ml med isoton glucose eller NaCl. Infusion 1 ml/t = 1 µg/kg/min
- Andet:
- Vasodilatorer, fx inf. nitroglycerin, anbefales ved vedvarende lavt cardiac output, høj kredsløbsmodstand og normalt/højt blodtryk trods væske- og inotropibehandling. Vasodilation i denne tilstand kan være afgørende for vævsperfusionen.
- Fosfodiesteraseinhibitor type III fx milrinon (Corotrop) kan forsøges ved normotensive tilstande med lavt cardiac output og høj kredsløbsmodstand trods adrenalin- og vasodilatorbehandling. Denne kredsløbstilstand er hyppigere ved septisk shock hos børn end hos voksne. Evidensen er sparsom.
- Calcium-sensitizer fx levosimendan eller enoximone. Kun kasuistisk beskrevet ved septisk shock hos børn.
- Vasopressin kan forsøges ved ekstremt lav kredsløbsmodstand refraktært for noradrenalin. Der eksisterer ingen evidens herfor.
Antibiotika
Tidlig antibiotisk behandling (< 1 time) har samme høje prioritet hos børn som hos voksne. Dyrk fra alle tænkelige foci inkl. blod. Undgå at tage bloddyrkning fra a-kanyle, medmindre denne er helt nyanlagt, da disse ofte forurenes..
Præparatvalg
Da mange børn med sepsis vil have en tilgrundliggende lidelse eller særlig udløsende årsag, er det vanskeligt at angive specifikke antibiotikaprotokoller. Det anbefales at skele til afdelingens vanlige protokoller for voksne samt at diskutere præparatvalg med pædiatrisk og mikrobiologisk vagthavende. Præparatvalg, dosis og interval bør bl.a. tage hensyn til følgende:
- Mistænkt fokus
- Ved meningitis: Obs forhøjede doser og/eller hyppige doseringer. Husk steroid.
- Ved toxic shock syndrome: Clindamycin anbefales, da det har specifik anti-toxin-effekt. Desuden kan overvejes intravenøst immunglobulin.
- Aktuelle lokale epidemier
- Allergier
- Nyrefunktion, leverfunktion
- Tidligere relevante dyrkningssvar
- Nylig antibiotikabehandling
- Immunstatus
- Risiko for kateterrelateret infektion (koagulase-negative stafylokokker)
- Risiko for infektion med resistente bakterier, fx MRSA
- Risiko for pseudomonas-infektion
- Risiko for svampeinfektion
Særligt vedr. flouroquinoloner (ciprofloxacin): Kan frit bruges til børn ved alvorlig infektion. Man har tidligere været tilbageholdende med brug til børn, da dyreforsøg viste risiko for skader på ledbrusk. Kliniske opgørelser har dog afkræftet mistanken.
Særligt vedr. aminoglykosider (gentamycin): Bruges relativt hyppigt i pædiatrien. Risikoen for nyrepåvirkning er nok mindre end hos voksne. I intensivt regi er man traditionelt mere tilbageholdende med disse præparater, da kritisk syge patienter er i høj risiko for nyresvigt af flere årsager. Aminoglykosider er absolut kontraindicerede ved tidl. beh. med cisplatin/carboplatin/ciclosporin. Alternative midler til gram-negativ dækning kan være ciprofloxacin, colistin, meropenem eller piperacillin-tazobactam.
Anbefalede intravenøse doser af diverse antibiotika (NB: ikke neonatale).
De anførte dosisintervaller er normaldosis ved infektion, med evt. maksimaldosis ved særlige infektioner i parentes. Dosisforslagene er baseret på gennemgang af flere kilder og afviger derfor i visse tilfælde fra pro.medicin.dk. Ved særlige infektionsfoci kan højere dosis eller hyppigere dosering være påkrævet, fx ved meningitis. Dosisjustering ved nedsat nyre- eller leverfunktion vil være relevant for flere af præparaterne, se speciallitteratur.
Doser gældende efter neonatalperioden (> 28 dage)
- Penicillin: 0,1-0,3 MIE/kg/døgn fordelt på 4(-6) doser.
- (Ved meningitis: 0,3 MIE/kg/døgn fordelt på 6 doser, max. 24 MIE/døgn)
- Ampicillin: 100(-200) mg/kg/døgn fordelt på 4(-6) doser, max 2-4g/dosis.
- (Ved meningitis: 200-400 mg/kg/døgn fordelt på 6 doser, max 12 g/døgn)
- Piperacillin/Tazobactam (Tazocin): 240-300 mg Piperacillin/kg/døgn fordelt på 3 doser, max 4 g/dosis
- Cefuroxim: 100(-200) mg/kg/døgn fordelt på 3 doser, max 1,5(-3) g/dosis
- Ceftriaxon: 50-100 mg/kg/døgn fordelt på 1 dosis, max 2-4 g/døgn.
- (Ved meningitis: 100 mg/kg/døgn fordelt på 1 dosis, max 4 g/døgn)
- Meropenem: 60(-120) mg/kg/døgn fordelt på 3 doser, max 1-2 g/dosis.
- (Ved meningitis: 120 mg/kg/døgn fordelt på 3 doser, max 3 g/dosis.)
- (Ved pseudomonas-behandling: 120 mg/kg/døgn fordelt på 3 doser, max. 2 g/dosis)
- Gentamycin: 5 (3,0-7,5) mg/kg/døgn fordelt på 1 dosis, max 240 mg/dosis. Gives som hovedregel kun i tre døgn.
- Ciprofloxacin: 30 mg/kg/døgn fordelt på 2-3 doser, max 400 mg/dosis
- (Ved pseudomonas-behandling: Max. 600 mg/dosis)
- Metronidazol: 20-25(-50) mg/kg/døgn fordelt på 3 doser. Evt. initialdosis 15 mg/kg.
- Clindamycin: 30-40 mg/kg/døgn fordelt på 3 doser, max. 600 mg/dosis.
- Vancomycin: 40 mg/kg/døgn fordelt på 2 doser, max 1g/dosis som startdosis. Herefter vejledt af dagl. serum-vancomycin [terapeutisk dalværdi 10-20 µg/ml]
- (Ved meningitis: 60 mg/kg/døgn fordelt på 3-4 doser, max 1 g/dosis som startdosis)
- Fluconazol: 6-12 mg/kg/døgn fordelt på 1-2 doser, max 800 mg/døgn
For dosering til neonatale: Se afsnit nedenfor
Fokuskontrol
Kirurgisk sanering eller perkutan drænage af infektiøst fokus er afgørende for behandlingens succes.
Inficerede katetre skal fjernes. Ved kliniske tegn på CVK-infektion afventes ikke dyrkningssvar før katetret seponeres.
Abdominale infektioner er ofte vanskelige at diagnosticere, men fatale hvis de overses. Ved uklart infektionsfokus bør abdomen altid mistænkes (fx volvulus, invagination, perforeret appendicitis). Involvér organkirurg tidligt, og tolk negativ billeddiagnostik med en vis skepsis. Visse typer abdominale katastrofer kan kun diagnosticeres eller udelukkes endeligt ved laparotomi/-skopi
Supplerende behandling
Organunderstøttende behandling følger vanlige retningslinier. Kirurgisk sanering af infektionsfokus har høj prioritet om muligt.
- Steroid: Steroid shock reversal anbefales ved katekolamin-resistent shock OG mistænkt eller påvist binyrebarkinsufficiens. Ca. 25% af børn med septisk shock har absolut binyrebarkinsufficiens..
- Dosering: Hydrocortison (Solu-Cortef®) 50 mg/m2 BSA/døgn anbefales af The Surviving Sepsis Campaign 2012. Andre kilder anbefaler hydrocortison i bolusdosering fra 2-50 mg/kg efterfulgt af 24-timers infusion af samme mængde.
- Risikofaktorer for binyrekarkinsufficiens: Svært septisk shock med purpura, daglig steroidbehandling, hypofyse- eller binyresygdom. Børn med disse tilstande behandles med shock-reversal.
- Absolut binyrebarkinsufficiens: P-Cortisol < 18 µg/dL (496 nmol/L) ustimuleret eller stimuleret.
- Relativ binyrebarkinsufficiens: Stigning i P-Cortisol ≤ 9 µg/dL (248 nmol/L) 30-60 min. efter ACTH-stimulation. Hvorvidt disse skal behandles med steroid shock-reversal er omdiskuteret
- Blodtransfusion: Surviving Sepsis Campaign187 samt Sundhedsstyrelsen188 anbefaler blodtransfusion ved Hb. < 6,0 mmol/l ved septisk shock ledsaget af ScvO2 < 70% eller i de første 6 timer af septisk shock, og herudover ved Hb. < 4,5 mmol/l. Andre kilder anbefaler dog at holde Hb. > 6,0 mmol/l ud fra en betragtning om, at ilttilbuddet til vævene i høj grad afhænger af hæmoglobinkoncentrationen182.
- Andre blodprodukter:
- Trombocytter (trc.): Anbefales substitueret ved trc. < 10 x 109 /l samt ved trc. < 20 x 109 /l i tilfælde af øget blødningsrisiko som fx andre koagulationsforstyrrelser eller nylig blødning. Ved aktiv blødning eller planlagte kirurgiske indgreb transfunderes til trc. > 50 x 109 /l.
- Frisk frosset plasma: Kan være indiceret ved svær dissemineret intravaskulær koagulation, trombotisk thrombocytopenisk purpura eller trombotisk mikroangiopati.
- Andre blodprodukter:
- Calcium: Hypocalcæmi er en hyppig medvirkende årsag til shock og skal behandles. Fx med inj. calciumchlorid 0,05-0,1 mmol/kg langsomt i.v.
- Intravenøst immunoglobulin (IVIG): IVIG anbefales ved toxic shock syndrome187. Det kan desuden overvejes til børn med svær sepsis af anden karakter. Evidensen er sparsom men generelt positiv også ved andre infektioner end nekrotiserende fasciitis, og også til børn uden kendt immundefekt. Dosisforslag: Privigen eller Kiovig 0,4 g/kg/døgn i.v. fordelt på én dosis, givet i tre dage i alt. Alternativt kan gives engangsdosis 0,5-1,0 g/kg i.v. Mål helst IgG, IgA og IgM først, da muligheden for diagnostik af evt. immundefekt ellers fortabes i flere dage.
- Tromboseprofylakse anbefales generelt til post-pubertale børn ved svær sepsis. Til yngre børn foretages individuel afvejning187. Dyb venøs trombose opstår hyppigst i relation til CVK’er, men profylakse er ikke indiceret alene pga. brug af CVK. Øvrige risikofaktorer er a-kanyle, immobilisation (fx tung sedation), kirurgisk stimulation mfl. Dosisforslag til børn > 2 mdr.: Enoxaparin (Klexane) 0,5 mg/kg s.c. x 2 (targetværdi: Anti-factorXa 0,5-1,0 U/ml) eller , dosisreduktion ved nedsat nyrefunktion.
- Ulcusprofylakse: Ingen generel anbefaling for eller i mod. Ulcusblødning opstår med samme hyppighed som hos kritisk syge voksne, hvorfor protonpumpehæmmer hyppigt anvendes til børn i respirator. Esomeprazol kan anvendes, mens pantoprazol ikke er godkendt til børn < 12 år.
- Glykæmisk kontrol: Blod-glucose (BS) > 10 mmol/l reduceres med insulin. Børn, især nyfødte, er i forhøjet risiko for hypoglykæmi, hvorfor insulinbehandling altid bør ledsages af glucoseinfusion samt hyppig kontrol af BS.
- Aktiveret protein C: Afregistreret. Ingen har dokumenteret effekt189.
- Respiratorbehandling: Adækvat væskeresuscitation vil i enkelte tilfælde fremskynde behovet for assisteret ventilation. Mindsker desuden iltforbrug til ventilationsarbejdet. Sedation og dermed respiratorstøtte kan være påkrævet til CVK-anlæggelse, men bør forudgås af kredsløbsunderstøttende behandling for at mindske risikoen for cirkulatorisk kollaps.
- Respiratorindstillinger: Se separat kapitel. Anvend lungeprotektiv ventilation
- Sedation: Se separat kapitel. Ketamin kan anvendes til intubation. Etomidat bør undgås ved sepsis pga. risiko for binyrebarkinsufficiens. Forsigtighed tilrådes med dexmedetomidin pga. risiko for hypotension. Propofol bør ikke anvendes til sedation af børn fraset til kortvarige procedurer i højst 24 timer pga. risiko for propofol infusions-syndrom.
- Dialysebehandling: Anbefales ved anuri/oliguri trods væskeresuscitation og efterfølgende forsøg på diuretisk stimulation, gerne inden svær overhydrering indtræder. Tegn på manifest overhydrering er nyudviklet hepatomegali, lungeødem og vægtøgning > 10%.
- ECMO: Refraktært septisk shock anses generelt for ECMO-indikation. Gennemgå forinden idé-listen under punktet “Refraktært septisk shock” nedenfor. Overlevelsen hos børn, der behandles på indikation septisk shock, er lidt lavere end overlevelsen hos børn, der behandles for isoleret respiratorisk svigt (ca. 37-50%).
Refraktært kredsløbssvigt
Følgende differentialdiagnoser og komplicerende tilstande mistænkes, diagnosticeres og behandles ved refraktært shock:
- Perikardietamponade: Drænage.
- Pneumothorax: Drænage.
- Binyrebarkinsufficiens: Steroid shock reversal
- Hypothyreoidisme: Thyroideahormon (infusion af triiodthyronin). Ses især ved børn med CNS sygdomme, fx hypofysetumorer, og trisomi 21
- Pågående blodtab: Transfusion, hæmostase
- Forhøjet intraabdominalt tryk: Behandl udløsende årsag. Tøm ventriklen for evt. luft. Ascitesdrænage eller laparotomi
- Manglende infektionskontrol: Kirurgisk sanering, drænage af ansamlinger, bredspektret antibiotika, intravenøst immunoglobulin mod toksisk shock
- Vævsnekrose: Kirurgisk sanering
- Immunsuppression: Pausér eller reducér immunosuppressiv behandling i samråd med ordinerende speciale. Overvej leukocyt-stimulerende behandling ved leukopen sepsis
- Udstyrsfejl: Kontrollér medicinblandinger (inotropi samt sedation). Kontrollér infusioner for subkutant indløb, blokering eller utæthed. Kontrollér niveau af tryk-transducere. Kontrollér blodtryksmålinger invasivt og non-invasivt samt på begge arme
- Andre årsager til shock?: Anafylaksi, lungeemboli, forgiftning etc.
Ved fortsat shock skal ECMO overvejes.
Septisk shock hos neonatale
Behandling af septisk shock er en neonatologisk specialistopgave, især ved præmaturitet, men bliver på flere hospitaler indledt under anæstesiologisk bistand.
Neonatal sepsis
Svær sepsis blandt børn optræder langt hyppigere i neonatalperioden end i andre aldersgrupper. I USA er incidensen 0,3 pr. 100 fødsler. Mortalitetet ved svær sepsis i neonatalperioden er 10% som i øvrige aldersgrupper178.
Risikofaktorer
- Maternelle faktorer: Infektion hos mater, kolonisering med gruppe B streptokokker (GBS), chorioamnionitis
- Intra-partum faktorer: Langvarig vandafgang, præmatur fødsel, mekonium/uklart fostervand, lav Apgar score, lav fødselsvægt, medfødte misdannelser, neonatal genoplivning
- Post-partum faktorer: Intravaskulære katetre, respiratorbehandling, gastrointestinale problemer, diverse farmaka, langvarig indlæggelse
Symptomer
Symptomer på neonatal sepsis er ofte uspecifikke initialt. Sepsis bør generelt overvejes hos nyfødte med almene symptomer som sløvhed, irritabilitet, bleghed, marmoreret hud, takypnø eller udtalte abdominale problemer i form af aspirater/gylpen, diarré eller udspilet abdomen. Decideret patologiske fund omfatter feber, forlænget kapillærresponstid, apnø, taky- eller bradykardi, hypo- eller hypertermi, hypo- eller hyperglykæmi. Ved fremskreden tilstand ses respirationsinsufficiens, hypotension, acidose og påvirkninger af nyrer, lever eller koagulation.
Diagnostik
Neonatal sepsis er vanskelig at diagnosticere men farlig at overse. Infektionstal stiger over timer og kan derfor være normale initialt. En vis overbehandling tolereres af denne grund, således at man alene ved klinisk mistanke starter behandling uanset evt. normale infektionsmarkører.
- Differentialdiagnoser: Sepsis kan være uskelnelig fra en række differentialdiagnoser, der derfor altid skal overvejes og udredes aktivt. Ekkokardiografi er central i udredningen og udføres snarest muligt.
- Morbus cordis congenitus: Ekkokardiografi udføres altid – så tidligt som muligt. Ved kliniske tegn på ductusafhængig mb. cordis (fx cyanose trods ilttilskud, kardiel mislyd, hepatomegali eller forskel i puls eller BT mellem over- og underekstremiteter) konfereres med børnekardiolog. Prostaglandin-infusion mhp. at åbne ductus arteriosus kan være livreddende – se dosisvejledning i tabel 7.
- Persisterende ductus arteriosus: Kan både optræde som differentialdiagnose til sepsis og som komplikation hertil. Ved mistanke konfereres med børnekardiolog.
- Persisterende pulmonal hypertension: Ved mistanke konfereres med børnekardiolog.
- Medfødt stofskiftesygdom (inborn errors of metabolism): Mistænkes specielt ved svær laktatacidose. Ved mistanke konfereres med pædiatrisk center.
- Andre differentialdiagnoser: Asfyksi, respiratorisk distress (RDS), hypoglykæmi, hypotermi
- Særlige årsager til neonatal sepsis: Visse infektionsfoci og ætiologiske agenser kræver særlig opmærksomhed:
- Meningitis: Mistænkes ved kramper, sitren, irritabilitet eller spændt fontanelle. På mistanken alene skal opstartes antibiotisk behandling rettet mod meningitis (se nedenfor), indtil lumbalpunktur kan udføres
- Nekrotiserende enterocolitis (NEC): Mistænkes ved tegn på akut abdomen og diagnosticeres ved røntgenoversigt over abdomen og/eller ultralyd. Ved mistanke konfereres med børnekirurg.
- Neonatal herpes-infektion: Mistanke skal specielt haves ved maternel herpes genitalis + vaginal fødsel, vesikulært exanthem eller leverpåvirkning. Ved mindste mistanke startes behandling med aciclovir i.v. (se nedenfor)
- Andre særlige årsager: Listeriose, svampesepsis og virale infektioner.
Behandling
Behandles generelt som hos større børn. Væsentlige forskelle er fremhævet nedenfor.
- Resuscitation efter ABCDE-princippet.
- Apnøer kan nødvendiggøre tidlig intubation
- IV-adgang forretrækkes via navlevene hos helt nyfødte. Intraossøs adgang kan anvendes med neonatal kanyle. A-tryk via navle-arterie-kateter om muligt.
- Væskeresuscitation mere forsigtigt pga øget risiko for overhydrering. Anvend bolus-doser á 10 ml/kg isoton krystalloidvæske. SAG-M overvejes efter 2-3 væskebolus. Særlig forsigtighed med væsketerapi til præmature med meget nedsat fødselsvægt, hvor hurtig væskeindgift kan medføre intrakraniel blødning. Væskebolus til disse børn gives langsommere, og inotropi bør overvejes allerede efter 2. væskebolus.
- Behandlingsmål som hos større børn inkl. SpO2 > 95% (og < 5% forskel mellem præ- og postduktal SpO2), HR 120-180, BTsys 50-60 mmHg og MAP mmHg > GA i uger (sigt mod GA + 10), ScvO2 > 70%, dog højere Hb-grænse 6-7,5 mM. Mål SpO2 både præ- og postduktalt (hhv. hø. hånd og ve. hånd eller fødder).
- Obs kredsløbstilstand:
- Ductus-afhængig mb. cordis må mistænkes ved kredsløbssvigt, især ved samtidig hepatomegali, cyanose trods ilttilskud, kardiel mislyd eller forskel i puls eller BT mellem over- og underekstremiteter. Opstart infusion prostaglandin (Prostin) indtil diagnosen kan udelukkes ved ekkokardiografi (se separat vejledning).
- Pulmonal hypertension kan forværres af sepsis og overtryksventilation, hvilket kan medføre shuntning fra højre til venstre hjertehalvdel enten via foramen ovale eller via persisterende ductus arteriosus. Behandles med oxygenering til SpO2 100% og normo- eller let hyperventilation (ingen permissiv hyperkapni). Inhaleret NO opstartes så snart det bliver muligt.
- Inotropi/vasopressor: Indiceret ved fortsat shock trods væskeindgift > 60 ml/kg, tidligere til præmature. Præparatvalg følger same overvejelser som hos ældre børn, dog undgås høje doser dopamin, da dette kan medføre pulmonal hypertension. Er man i tvivl om kredsløbstilstanden, kan følgende anbefales:
- Dopamin er førstevalg, dosis 5 (1-9) µg/kg/min (ikke højere aht. risiko for pulmonal hypertension).
- Dobutamin 1-10 µg/kg/min tillægges som 2. valg (ino—dilator)
- Adrenalin 0,05-0,3 µg/kg/min tillægges ved manglende respons af ovenstående.
- Antibiotikavalg: Hyppigste mikrobiologiske agens: E. coli, gruppe B streptokokker (GBS), staph. epidermidis. Langt mindre hyppigt kan ses staph. aureus, pneumokokker, pseudomonas, div. gram-negative stave, listeria, svampe og vira.
- Tidlig sepsis (< 72 t efter fødsel): Overvejende GBS, evt. e. coli erhvervet intrapartum. Forslag: Ampicillin + gentamycin
- Hvis mater har været i antibiotikabeh. forud for fødslen, vælges meropenem i stedet for ampicillin pga. øget risiko for resistens
- Ved meningtis: Meropenem (højdosis) + gentamycin
- Ved nekrotiserende enterocolitis (NEC): Tillæg metronidazol
- Sen sepsis (> 72 t): Mere blandet ætiologi. Forslag: Cefuroxim + gentamycin
- Tidlig sepsis (< 72 t efter fødsel): Overvejende GBS, evt. e. coli erhvervet intrapartum. Forslag: Ampicillin + gentamycin
- Antibiotikadosering til neonatale (< 28 dage):
- Gentamycin
- GA ≤ 33 uger: 5 mg/kg i.v. hver 48 t
- GA 34-37 uger: 4 mg/kg i.v. hver v36 t
- GA ≥ 38 uger: 4 mg/kg i.v. hver 24 t
- Ved behandling > 3 døgn:
- 3-5 mg/kg i.v. x 1/døgn, justeret efter serum-værdi o
- Penicillin
- 0,2 MIE/kg/dg i.v. fordelt på 4 doser
- Meningitis: 0,4 MIE/kg/dg i.v. fordelt på 4 doser
- Meropenem
- 30-60 mg/kg/dg i.v. fordelt på 3 doser
- Meningitis: op til 80 mg/kg/dg i.v. fordelt på 3 doser o
- Cefuroxim
- Alder ≤ 7 dage: 50 mg/kg/dg i.v. fordelt på 2 doser
- Alder > 7 dage: 75 mg/kg/dg i.v. fordelt på 3 doser
- Ampicillin
- 200 mg/kg/dg i.v. fordelt på 4 doser
- Meningitis: 400 mg/kg/dg i.v. fordelt på 4 doser
- Aciclovir
- 60 mg/kg/dg i.v. fordelt på 3 doser
- Gentamycin
- Supplerende behandling
- Overvej Immunoglobulin 0,5 g/kg/døgn i.v. i tre døgn
- Obs øget risiko for hypoglykæmi. Profylaktisk infusion af glucose 10%, start med 2,5 ml/kg/time
- Transfusion SAG-M ved Hb < 6-7,5 mmol/l og septisk shock
- Undgå hypotermi fraset terapeutisk hypotermi ved behandling af asfyksi
- Respiratorbehandling: Ingen permissiv hyperkapni ved tegn på øget tryk i højre hjertehalvdel
- Inhaleret NO ved persisterende pulmonal hypertension
- Surfactant-behandling overvejes ved svær RDS
- Diuretika eller dialyse ved vægtøgning > 10%
- ECMO overvejes ved behandlingssvigt
Supplerende referencer
Udover de anførte i teksten: 190–201
Blanding af kredsløbsaktiv infusionsmedicin
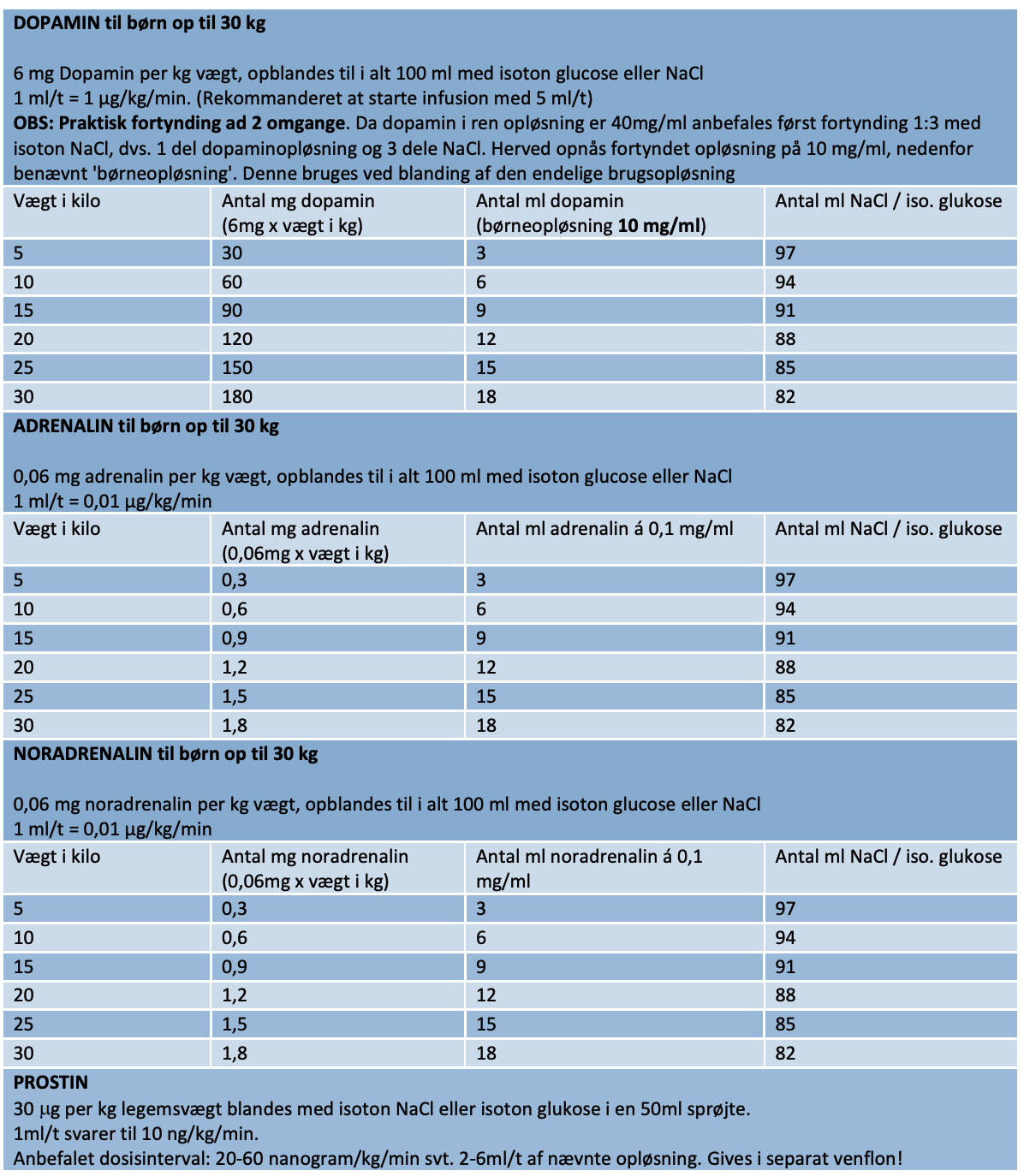
Tabel 7: Blanding af kredsløbsaktive infusioner
8. SEDATION OG ANALGESI PÅ INTENSIV AFDELING
Forfatter: Ole Pedersen
Korrespondance: ole.pedersen@rsyd.dk
Introduktion
Børn som indlægges på intensiv behøver ofte en grad af sedering/ analgesi for at acceptere diverse procedurer og tiltag i bestræbelsen på optimal monitorering og behandling. Den underliggende sygdom, medicinsk eller kirurgisk, kan medføre nødvendig anlæggelse af diverse katetre til blodkar, mavetarmkanal, blære m.m. og forårsage smerte, ubehag og angst. Alle følelserne forstærkes af, at en intensiv afdeling, for patienten, er et ubehageligt miljø med mærkelige maskiner, ukendte personer og overskridelse af personlige grænser.
Før start af sedation eller analgesi skal sikres, at patienten ikke er urolig af en årsag, som kræver anden behandling. Vigtigst er udelukkelse af hypoxæmi, hyperkapni og cerebral hypoperfusion.
Intet sedativa eller analgetika er effektivt eller ideelt til alle patienter. Det er derfor nødvendigt, at være fortrolig med flere forskellige præparater, så der kan skiftes mellem disse, hvis førstevalget er ineffektivt eller medfører uacceptable bivirkninger for patienten.
På grund af diversiteten blandt patienter og stor variation i indikationen for ønsket om sedation og/eller smertebehandling, er det ikke muligt at diktere definitive guidelines for præparatvalg og dosering.
Dosis rekommandationerne i det følgende er tænkt som forslag til startdosis. Efterfølgende titreres dosis op eller ned afhængig af det ønskede niveau for sedation og smertebehandling, så over-/underbehandling undgås.
I tilfælde af et intuberet barn, som kræver sedering i forbindelse med en procedure, eksempelvis transport, vælges ofte midazolam og et opioid – morfin eller fentanyl. Et spædbarn kan ofte sederes med bolus doser, mens større børn vil kræve kontinuerlig infusion.
Indikation for sedation
Der er indikation for sedation af det intuberede barn, hvis det kan forhindre unødvendige lidelser hos barnet eller hvis behandling ikke kan gennemføres uden sedation.
Sædvanligvis gennemføres behandlingen initialt ved en kombination af et opioid og et sedativum intravenøst. Behandlingen suppleres undertiden med andre sedativa i.v. eller p.o.
Hos hæmodynamisk stabile børn uden forhøjet intrakranielt tryk bør man så vidt muligt klare sig med refrakte doser af opioid og sedativa for at begrænse toleransudviklingen mest muligt.
Lægen skal tage stilling til præparat (og dosis), administrationsvej og administrationsmetode (intermitterende/kontinuerlig).
Præparatgrupper
Opioider
Der anvendes sædvanlige scoringssystemer for smerter under hensyntagen til barnets alder.
Bivirkningsprofilen er tilnærmelsesvis ens for de nævnte opioider omfattende respirationsdepression, kvalme/opkastning, obstipation, hudkløe, toleransudvikling ved langvarig brug eller høje doser medførende abstinenser ved ophør eller for hurtig nedtrapning.
Morfin
Førstevalgs-opioid til behandling af stærke smerter. Besidder også sedative egenskaber. Kan hos neonatale og spædbørn være mere effektiv som sedativa sammenlignet med benzodiazepin. De mindste børn har et veludviklet opioidreceptor system. Maksimal effekt efter 20 min. På grund af histaminfrigørelse kan morfin give vasodilatation og muligvis bronchospasmer202. Dette ses specielt efter bolusindgift.
Man forsøger i de fleste tilfælde at klare sig med bolusdosis 25-50 μg/kg.
Der kan være indikation for opsætning af morfinfusion med startdosis 50 μg/kg/time.
Fentanyl
Næsten 100 gange mere potent end morfin med hurtig indsættende effekt. Anvendes specielt til børn med cirkulatorisk instabilitet, f. eks. pulmonal hypertension, som primære stof til sedation. Kan nedsætte cardiac output ved at reducere hjertefrekvensen. Akkumuleres hurtigt i fedtvæv, hvorved halveringstiden forlænges og fremmer hurtig toleransudvikling. Bolusdosis er 2-5 μg/kg og ved infusion 5-10 μg/kg/time. Doser på 50 μg/kg/time kan nås.
Remifentanil
Har kardiorespiratiorisk effekt sammenlignelig med øvrige opioider. Hurtig indsættende effekt og meget kort halveringstid (3 min), uafhængig af lever- og nyrefunktion. Ved langvarig infusion udvikles hurtigt tolerans. Har i en intensiv kontekst relevans som adjuvans i forbindelse med kortvarig sedation og som analgesi i forbindelse med procedurer203,204. Bolusdosis er 1 µg/kg og ved infusion 0,2-1 µg/kg/min205.
Metadon
Anvendes primært til behandling af abstinenser, men kan i længevarende forløb anvendes til sedation og/eller analgesi. Biotilgængeligheden efter oral indgift er 75-80 %. Plasmahalveringstiden varierer fra 19 til 55 timer. Ved gentagen indgift kan doseringsintervallerne øges på grund af en kumulativ virkning. Gennemsnitlig virkningsvarighed ved gentagen indgift er 8-12 timer. Anvendes hyppigst enteralt. Formulering til parenteral administration findes, og kan anvendes i en overgangsfase fra korttidsvirkende opioid indtil mavetarmfunktionen er velfungerende. Dosering startes med 3-4 gange i døgnet og reduceres i løbet af nogle dage til 2 gange i døgnet. Der anvendes dosering som ved morfin, men reduktion i dosis allerede de første døgn pga.den kumulative effekt.
Specielle overvejelser ved sedation af børn med kronisk nyresygdom
Ved Glomerulære Filtrations Rate (GFR) under 30 ml/min/m2 er metabolismen for renalt udskilte lægemidler signifikant ændret og risikoen for toksicitet, grundet akkumulering, høj. De fleste fedtopløselige analgetika metaboliseres i leveren til vandopløselige metabolitter, som udskilles renalt. Nogle af disse metabolitter er farmakologisk aktive, hvilket især gælder morfin. Af denne grund er der betydelig risiko for toksicitet ved morfinindgift til børn med kronisk nyreinsufficient205.
Sedativa
Scoringssystemer til vurdering af sedationsgraden anses ikke nødvendig, når målet for sedation er, at sedere netop så dybt, at behandlingen kan gennemføres, uden barnet lider unødig overlast. Oversedation bør undgås, da studier har vist, at dette forlænger respiratorbehandling og intensivophold foruden at facilitere højere grad af tolerans- og afhængighedsudvikling206, 207. Ønskes der dybere sedation fx. af patientmæssige hensyn, bør overvejes indførsel af sedationsprotokol, da dette har vist at reducere graden af oversedation208.
For børn med forhøjet intrakranielt tryk sederes efter ICP og for børn med pulmonal hypertension sederes efter graden af ekstrapulmonal shuntning.
Midazolam
Maksimal effekt efter 5-10 min. Metaboliseres af cytocrome P450 systemet i leveren (obs. interaktion med antikonvulsiva m.fl.). Eliminationen nedsættes ved nyreinsuffciens og inflammation. Kan udløse hypotension. Dette er mest udtalt ved bolusdosis209, 210. Langvarig infusion fører til afhængighed og toleransudvikling.
Phenobarbital
Anvendes primært ved kramper og abstinensbehandling. Initialdosis 10 mg/kg legemsvægt langsomt i.v. i refrakte doser og kan gentages til kumuleret max. dosis på 30 mg/kg. Vedligeholdelsesdosis er 5 mg/kg legemsvægt/døgn.Ved langvarig fenemalbehandling bør se-phenobarbital monitoreres.
Clonidin
En central virkende α2-receptoragonist med sedative, anxiolytiske og analgetiske egenskaber. Anvendes primært ved abstinensgennembrud. Ved overdosering eller hurtig bolusindgift kan ses hypotension og bradycardi.Efter langvarig administration skal clonidin udtrappes langsomt for at undgå kramper og hypertension203. Dosis til sedation 3-5 μg/kg x 4 i.v. evt. pr. os. Ved infusion kan anvendes 0,1-2 μg/kg/time211.
Dexmedetomidin
Som clonidin en α2-receptoragonist med sedative, anxiolytiske og analgetiske egenskaber, men med kortere halveringstid (1-4 timer) og 8-gange højere specificitet for α2-receptoreren i forhold til α1-receptoren sammenlignet med clonidin. I terapeutisk dosis ses minimal hæmning af den respiratoriske funktion212. Kan anvendes til sedation, oftest i tillæg til andre sedativa, abstinensbehandling og opvågnings delirium. Hyppigste bivirkninger inkluderer hypotension, bradykardi og forbigående hypertension ved bolus dosering eller hurtig infusion.
Ved ophør eller aftrapning af dexmedetomidin-infusion efter mere end 24 timers behandling, skal observeres for abstinenssymptomer (hyppigst agitation og hypertension)213, 214.
Dosering:
- mætning 0,5-1 µg/kg over 10-15 minutter, efterfulgt af
- infusion 0,1-1,4 µg/kg/time.
Propofol
På intensiv er propofol ikke godkendt til langvarig sedation af børn under 16 år, men kan benyttes til korte procedurer. Sedation med propofol må ikke overstige 24 timer og max. 4 mg/kg/time.
Sedativum uden analgetiske egenskaber. Hurtig indsættende effekt og kort halveringstid. Kardiovaskulære bivirkninger inkluderer perifer vasodilatation og negativ inotrop effekt, ses især ved bolus administration. Propofolinfusionssyndromet er et sjældent syndrom, der ses hos patienter, der gennemgår langvarig behandling med høje doser propofol. Det kan føre til hjertesvigt, rhabdomyolyse, metabolisk acidose, hyperkaliæmi, hepatomegali, hyperlipidæmi, hjertearytmi og nyresvigt. Er ofte fatalt215, 216.
Kan benyttes til børn over 1 måned (GA > 44 uger) i forbindelse med induktion og vedligeholdelse af anæstesi til korte procedurer, f. eks. operation og transport. Induktionsdosis 2-5 mg/kg. Dosis til vedligeholdelse af anæstesi varierer betydeligt patienterne imellem, og afhænger af proceduren. Ved doser i størrelsesordenen 9-15 mg/kg/time opnås normalt tilfredsstillende anæstesi. Børn i alderen 1 måned til 3 år kan kræve højere doser, ligesom transport af et sederet/intuberet barn kan forløbe ukompliceret med væsentlig lavere doser 205.
Thiopental
Anvendes til korte procedurer så som endotracheal intubation, dosis 2-8 mg/kg. Efter den første levemåned er induktionsdosis 7-8 mg/kg, derefter jævnt faldende gennem barnealderen. Thiopental har betydelig negativ inotrop virkning og medfører perifer vasodilatation. Der kan forholdsvis uvarslet indtræde cirkulatorisk kollaps hos en patient med uerkendt kardiovaskulær dysfunktion. På intensiv er eneste øvrige anvendelser svært traktabel forhøjet intrakranielt tryk eller antikonvulsiv behandling.
Dosering205, 217:
- initial dosis 0,5-2 mg/kg
- vedligeholdelsesdosis 1-3 mg/kg/time
Prometazin
Er et sederende antihistaminikum med overvejende H1-receptorblokerende virkning. Anvendes kun til børn over 44. postkonceptionelle uger og synes mest anvendelig hos børn med bronchial hypersekretion og respiratorisk svigt f.eks RSV-infektion.
Dosering: 0,5 -2 mg/kg max x 4 p.o.
Der kan ses ekstrapyramidale bivirkninger. Bør ikke anvendes til børn med Reye´s syndrom (akut leversvigt).
Ketamin
Har både sedativ og analgetisk effekt. Aktiverer det sympatiske nervesystem med frigivelse af endogene katecholaminer medførende øget hjertefrekvens og associeret til bronchodilatation hos patienter med astma. Medfører ikke respiratorisk depression eller hypotension og er derfor velegnet til proceduresedation og -analgesi til patienter, som ikke understøttes respiratorisk og til hæmodynamisk ustabile patienter, som ikke tolererer benzodiazepiner eller barbiturater. Ketamins bivirkningsprofil omfatter dosisrelateret takykardi og hypertension, savlen, foruden psykiske symptomer med hallucinationer og delirium. De psykiske symptomer kan minimeres ved samtidig indgift af et benzodiazepin. Ketamin anbefales ikke til patienter med forhøjet intrakranielt tryk grundet cerebral vasodilatation. Metaboliseres i leveren.
Dosering:
- Procedurebolus: 0,5-2 mg/kg i.v. eller 3-7 mg/kg i.m. (+ midazolam 0,1-0,3 mg/kg)
- Infusion til sedation eller svær astma: 0,5-2 mg/kg/time111
Chlorathydrat
Sedativum som administreres enteralt. Absorberes hurtigt fra mave-tarmkanalen og konverteres til den aktive metabolit trichloroethanol (t½ 8-60 timer). Effekt 10-20 min. efter administration. Forsigtighed ved nyre- og leverinsuff. Velegnet til proceduresedation, hvor smerte ikke forventes.
Dosering: 25-75 mg/kg. Max. 2 gram/dosis, max. 200 mg/kg/dag.
Kan ikke infunderes218.
Doseringsvejledning: Sedation og analgesi
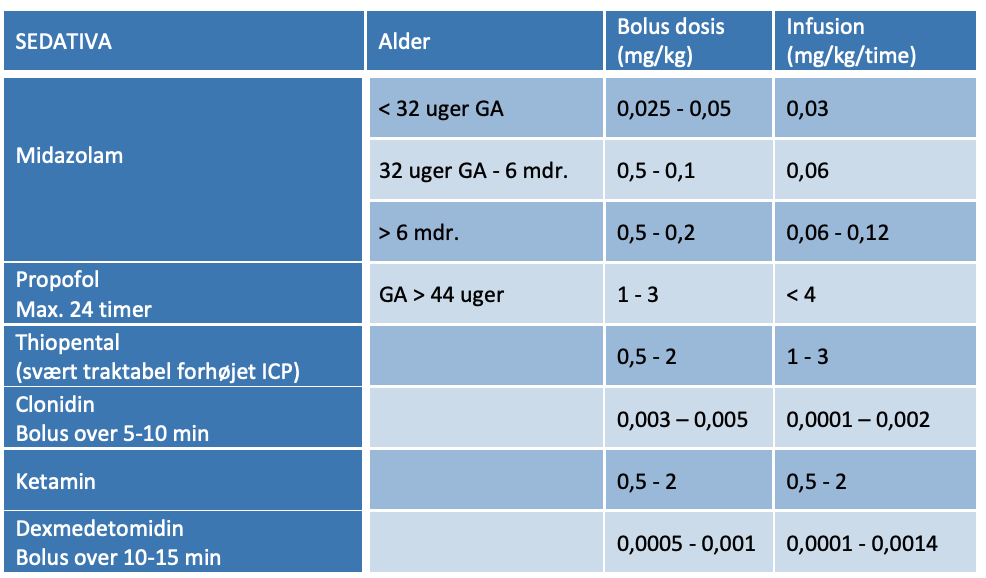
Tabel 8.1 Sedativas dosering. (GA=gestationsalder, ICP=intrakraniel tryk)
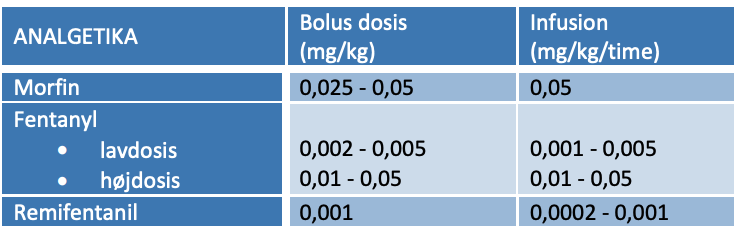
Tabel 8.2. Analgetikas dosering
9. KRAMPER HOS BØRN
Forfatter: Kaare Engel Lundstrøm
Korrespondance: klu@dadlnet.dk
Definitioner
Man inddeler epileptiske anfald i to hovedgrupper:
- Konvulsive anfald: Tonisk/kloniske anfald (kramper).
- Non-konvulsive anfald: Absencer eller komplekse partielle anfald, hvor børnene er bevidsthedspåvirkede og/eller adfærdsmæssigt anderledes end vanligt.
Både konvulsive og non-konvulsive anfald kan udvikles til status epilepticus, som defineres som følger:
- Begyndende status epilepticus: > 5 min. varende anfald.
- Etableret status epilepticus: Mindst 30 min. varende epileptisk anfald eller flere tilbagevendende anfald, uden at barnet kommer til bevidsthed mellem anfaldene.
- Refraktær status epilepticus: Intet vedvarende respons på 3 eller flere anti-epileptiske medikamenter og over 60 min. varighed.
Feberkramper defineres som:
- kramper hos et barn med tp > 38 grader og ingen anden kendt ætiologi til kramperne
Baggrund
Kramper er et hyppigt symptom hos børn. Den hyppigste ætiologi er feberkramper.
Man inddeler feberkramper i
- Simple feberkramper: Enkeltstående, kortvarige, generaliserede tonisk/kloniske, evt. atoniske krampetilfælde, samt
- Komplekse feberkramper: Langvarige anfald > 15 min. fokale anfald, gentagne anfald indenfor 24 timer eller anfald efterfulgt af forbigående parese (Todds parese).
Den medikamentelle antikonvulsive behandling af feberkramper svarer til behandling af kramper med anden ætiologi. Man skal dog ved feberkramper specifikt udrede for årsag til feber og aktivt sænke barnets temperatur ved at afklæde barnet og eventuelt give antipyretisk medicin (paracetamol eller ibuprofen). Specielt ved langvarige anfald skal meningitis mistænkes og behandling for dette overvejes. Lumbalpunktur er kontraindiceret ved status epilepticus og behandling af meningitis startes uden forudgående lumbalpunktur.
Status epilepticus ses hos tidligere raske børn, ved feberkramper og hos patienter med kendt epilepsi og/eller kronisk eller akut neurologisk sygdom, fx. meningitis/encefalitis eller traume.
Diagnosen non-konvulsiv status epilepticus kræver EEG undersøgelse og behandlingen bør varetages eller vejledes af pædiatrisk neurologisk ekspertise.
Konvulsiv status epilepticus er en potentielt livstruende tilstand, hvor risikoen for hjerneskade er proportional med tilstandens varighed. Tilstanden skal derfor behandles aggressivt.
Tilgang til konvulsiv status epilepticus
- Stabilisering
- A: Sikring af frie luftveje.
- B: Ilttilskud på maske og sugning efter behov. Ventilation oftest kun mulig efter sedation og anfaldsbehandling.
- C: Behandling efter vanlige retningslinier. Obs. hypotension og arytmi efter antiepileptika.
- Diagnostik
- Man skal altid forsøge at finde tilgrundliggende ætiologi og behandle afhængigt af sådan
- Specifikke blodprøver:
- Blodsukker, syre/base, Ca++, Mg++, se-koncentration af antiepileptica.
- Medikamentel behandling:
- Se næste afsnit
Medikamentel behandling af kramper og status epilepticus hos børn
Behandlingsalgoritmen er opdelt i 2 afsnit for henholdsvis:
- hospital med pædiatrisk anæstesiologisk service
- hospital uden pædiatrisk anæstesiologisk service
Baggrunden for dette er, at man ønsker at bryde konvulsiv status epilepticus så hurtigt som muligt, og dette gøres ved tidlig behandling med bolus og infusion af midazolam. Imidlertid indebærer dette ofte behov for intubation. På hospitaler uden pædiatrisk anæstesiologisk service vurderes risikoen ved intubation specielt hos mindre børn at retfærdiggøre udvidet medikamentel behandling før midazolam-infusion.
Præparatet levetiracetam (Keppra®) er valgt som tredje medikament trods beskeden videnskabelig dokumentation for dets effekt ved pædiatrisk konvulsiv status epilepticus. Baggrunden for dette er, at præparatet har meget få bivirkninger og interaktioner. Alternativet fosfenytoin, som har dokumenteret effekt ved konvulsiv status epilepticus, er forbundet med risiko for arytmi, og der er også i DK beskrevet dødsfald ved indgift af fosfenytoin. Dette præparat foreslås derfor kun anvendt på afdelinger med højt specialiseret funktion i neuropædiatri.
Algoritmerne er gældende uanset præhospital behandling, hvis barnet har kramper ved ankomst til hospital. Hvis der er givet benzodiazepin præhospitalt, gives kun midazolam én gang, før der gives valproat.
IV/IO adgang etableres så hurtigt som muligt.
Ilttilskud gives og respiration støttes efter behov.
På hospital uden pædiatrisk anæstesiologisk funktion
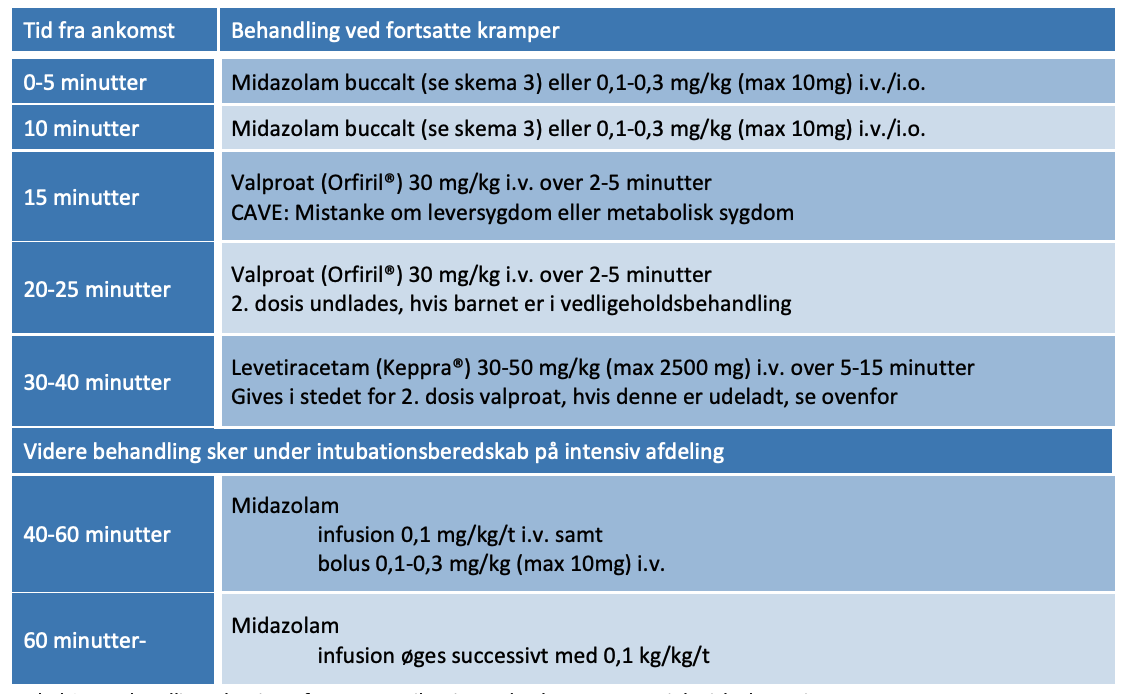
Tabel 9.1. Behandlingsalgoritme for status epilepticus uden børneanæstesiologisk ekspertise
Supplerende terapi:
Følgende præparater kan forsøges, helst efter konference med neuropædiater:
- Phenobarbital (Fenemal®) 20 mg/kg (max 1000 mg) i.v. infunderet over 5-10 min.
- Fosfenytoin (Pro-Epanutin®) 15-20 PÆ/kg (max 1000 PÆ) i.v. infunderet over 5-10 min. (max 3 mg/kg/min) NB: Fosfenytoin er forbundet med risiko for livstruende arytmi. Indgift skal ske under EKG-monitorering.
- Pyridoxin: Hos børn under to år uden kendt ætiologi skal pyridoxin 100-200 mg i.m. overvejes.
Refraktær status: Ved refraktær status bør koma induceres efter 60-90 min. og barnet skal så intuberes og ventileres, hvis det ikke allerede er sket. Koma induceres med:
- Propofol, bolus 1-3 mg/kg i.v.
ELLER
- Thiomebumal, bolus 3-5 mg/kg i.v.
Vedligeholdes eventuelt af:
- Propofol, infusion 1-4 mg/kg/time i max 24 timer
Dette suppleres med analgetika og relaksantia efter lokal retningslinie. Barnet skal, så snart det er muligt, overføres til hospital med pædiatrisk intensiv funktion og om muligt kontinuerligt EEG monitoreres.
På hospital med pædiatrisk anæstesiologisk funktion

Tabel 9.2: Medikamentel behandling af status epilepticus med børneanæstesiologisk ekspertise
Supplerende terapi
Følgende præparater kan forsøges, helst efter konference med neuropædiater:
- Levetiracetam (Keppra®) 30-50 mg/kg (max 2500 mg) i.v. over 5-15 min.
- Phenobarbital (Fenemal®) 20 mg/kg (max 1000 mg) i.v. infunderet over 5-10 min.
- Fosfenytoin (Pro-Epanutin®) 15-20 PÆ/kg (max 1000 PÆ) i.v. infunderet over 5-10 min. (max 3 mg/kg/min) NB: Fosfenytoin er forbundet med risiko for livstruende arytmi. Indgift skal ske med EKG monitorering.
- Pyridoxin: Hos børn under to år uden kendt ætiologi skal pyridoxin 100-200 mg i.m. overvejes.
Barnet skal, så snart det er muligt, overføres til hospital med pædiatrisk intensiv funktion og om muligt kontinuerlig EEG monitorering.
Buccal midazolam (Buccolam®)
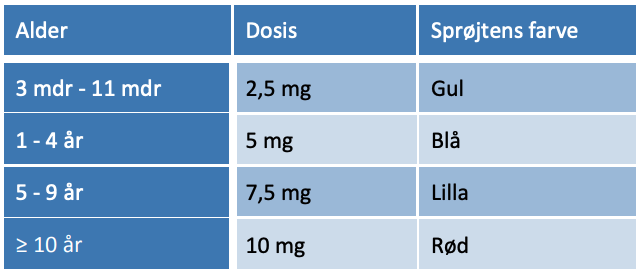
Tabel 9.3. Dosering af buccal midazolam i form af Buccolam®
Dosis er den samme ved brug af andre præparater, fx Epistatus®.
Referencer
Der henvises til referencelisten219–222.
REFERENCER
- Sundhedsstyrelsen. Specialevejledning for anæstesiologi af 21. juni 2013. (2013). at <http://www.sst.dk/~/media/Planlaegning og kvalitet/Specialeplanlaegning/Specialevejledninger_2010/Specialevejledning – an%C3%A6stesiologi – 210613.ashx>
- National Sundheds-IT. Sproglige & terminologiske retningslinjer for oversættelse og revision af SNOMED-termer , i tre dele. (2011). at <http://www.ssi.dk/Sundhedsdataogit/National Sundheds-it/TerminologiOgKlassifikationer/SNOmedCT/~/media/Indhold/DK – dansk/Sundhedsdata og it/NationalSundhedsIt/Terminologi/SCT/20110113_SprogligeRetningslinjer.ashx>
- International Health Terminology Standards Development Organisation. at <http://www.ihtsdo.org/>
- Mendeley. at <http://www.mendeley.com/>
- Children’s Acute Transport Service (London). at <http://site.cats.nhs.uk/>
- Embrace (Sheffield Children’s, UK). at <http://www.sheffieldchildrens.nhs.uk/refer-to-us/embrace/>
- The North West and North Wales Transport Service. at <http://www.nwts.nhs.uk/>
- Paeditric and Infant Critical Care Transport Service (Leicester, UK). at <http://www.piccts.co.uk/>
- The Scottish Paediatric Intensive Care Transport Service. at <http://www.paedsretrieval.com/>
- South Thames Retrieval Service (London). at <http://www.strs.nhs.uk/homepage.aspx>
- Southampton Oxford Retrieval Team (UK). at <http://www.sort.nhs.uk/home.aspx>
- Newborn and Pediatric Emergency Transport Service (New South Wales, Australia). at <http://www.nets.org.au/>
- Victorian Paediatric Emergency Transport Service. at <http://www.rch.org.au/pets/>
- Jarden, R. J. & Quirke, S. Improving safety and documentation in intrahospital transport: development of an intrahospital transport tool for critically ill patients. Intensive Crit. Care Nurs. 26, 101–7 (2010).
- Choi, H. K. et al. A before- and after-intervention trial for reducing unexpected events during the intrahospital transport of emergency patients. Am. J. Emerg. Med. 30, 1433–40 (2012).
- Nakayama, D. K. et al. Quality improvement and patient care checklists in intrahospital transfers involving pediatric surgery patients. J. Pediatr. Surg. 47, 112–8 (2012).
- Intensive Care Society. Guidelines for the transport of the critically ill adult (3rd Edition 2011). (2011). at <http://www.ics.ac.uk/EasysiteWeb/getresource.axd?AssetID=482&type=full&servicetype=Attachment>
- Weiser, T. G. et al. Perspectives in quality: designing the WHO Surgical Safety Checklist. Int. J. Qual. Health Care 22, 365–70 (2010).
- Hales, B., Terblanche, M., Fowler, R. & Sibbald, W. Development of medical checklists for improved quality of patient care. Int. J. Qual. Health Care 20, 22–30 (2008).
- Department of Health. The acutely or critically sick or injured child in the district general hospital – a team response. (2006). at <http://www.rcoa.ac.uk/system/files/PUB_ACSIC.pdf>
- Bingham, R. & Wilkinson, K. Association of Paediatric Anaesthetists of Great Britain and Ireland: Recommended paediatric resuscitation training for non-training grade anaesthetists. (2010). at <http://www.apagbi.org.uk/sites/default/files/images/june2010PEDIResusFINAL.pdf>
- American Academy of Pediatrics (committee on pediatric emergency medicine), American College of Emergency Physicians (pediatric committee) & Emergency Nurses Associatrion (pediatric comittee). Joint policy statement–guidelines for care of children in the emergency department. Pediatrics 124, 1233–43 (2009).
- Royal College of Paediatrics and Child Health – Intercollegiate Committee. Standards for Children and Young People in Emergency Care Settings.
- Richmond, S. & Wyllie, J. European Resuscitation Council Guidelines for Resuscitation 2010 Section 7. Resuscitation of babies at birth. Resuscitation 81, 1389–99 (2010).
- Biarent, D. et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 6. Paediatric life support. Resuscitation 81, 1364–88 (2010).
- Universities of Leeds and Leicester. Paediatric Intensive Care Audit Network Annual Report 2010-12 (published September 2013). at <http://www.picanet.org.uk/Audit/Annual-Reporting/PICANet_Annual_Report_2013_Tables_and_Figures.pdf>
- Sundhedsstyrelsen. Specialevejledning for pædiatri af 31. oktober 2013. (2013). at <http://www.sst.dk/~/media/Planlaegning og kvalitet/Specialeplanlaegning/Specialevejledninger_2010/Specialevejledning – p%C3%A6diatri – 311013.ashx>
- Dansk Intensiv Database, årsrapport 2010. 1–59 (2010). at <http://www.did1.dk/upl/9153/DIDrsrapport2010.pdf>
- Danmarks Statistik. Befolkningen-1-1-2013-efter-foedselsaar-og-maaned. at <http://www.dst.dk/ext/677595832/0/befolkning/Befolkningen-1-1-2013-efter-foedselsaar-og-maaned–xls>
- Dansk Intensiv Database. Årsrapport 2012. (2013).
- Britto, J., Nadel, S., Maconochie, I., Levin, M. & Habibi, P. Morbidity and severity of illness during interhospital transfer: impact of a specialised paediatric retrieval team. BMJ 311, 836–9 (1995).
- Barry, P. W. & Ralston, C. Adverse events occurring during interhospital transfer of the critically ill. Arch. Dis. Child. 71, 8–11 (1994).
- White, M., Weir, P. M., Garland, L., Edees, S. & Henderson, a. J. Outcome of critically ill children before and after the establishment of a pediatric retrieval service as a component of a national strategy for pediatric intensive care. Pediatr. Crit. Care Med. 3, 255–260 (2002).
- Sharples, a., O’Neill, M. & Dearlove, O. Impact of specialised paediatric retrieval teams. Children are still transferred by non-specialist teams. BMJ 312, 120–1 (1996).
- Hatherill, M., Waggie, Z., Reynolds, L. & Argent, A. Transport of critically ill children in a resource-limited setting. Intensive Care Med. 29, 1547–54 (2003).
- Ramnarayan, P. et al. Effect of specialist retrieval teams on outcomes in children admitted to paediatric intensive care units in England and Wales: a retrospective cohort study. Lancet 376, 698–704 (2010).
- Edge, W. E., Kanter, R. K., Weigle, C. G. & Walsh, R. F. Reduction of morbidity in interhospital transport by specialized pediatric staff. Crit. Care Med. 22, 1186–91 (1994).
- Orr, R. a et al. Pediatric specialized transport teams are associated with improved outcomes. Pediatrics 124, 40–8 (2009).
- McPherson, M. L. & Graf, J. M. Speed isn’t everything in pediatric medical transport. Pediatrics 124, 381–3 (2009).
- Ramnarayan, P. & Polke, E. The state of paediatric intensive care retrieval in Britain. Arch. Dis. Child. 97, 145–9 (2012).
- Paediatric intensive care society. Standards for the care of critically ill children 4th ed. (2010). at <http://www.ukpics.org.uk/documents/PICS_standards.pdf>
- Fortune, P.-M. & Playfor, S. Transporting critically ill children. Anaesth. Intensive Care Med. 10, 510–513 (2009).
- Dingeman, R. S., Mitchell, E. a, Meyer, E. C. & Curley, M. a Q. Parent presence during complex invasive procedures and cardiopulmonary resuscitation: a systematic review of the literature. Pediatrics 120, 842–54 (2007).
- Gold, K. J., Gorenflo, D. W., Schwenk, T. L. & Bratton, S. L. Physician experience with family presence during cardiopulmonary resuscitation in children. Pediatr. Crit. Care Med. 7, 428–33 (2006).
- Davies, J., Tibby, S. M. & Murdoch, I. a. Should parents accompany critically ill children during inter-hospital transport? Arch. Dis. Child. 90, 1270–3 (2005).
- Bredahl, P., Lomholt, M., Larsen, C. F. & Gätke, M. R. [Parental presence during treatment of injured and acutely ill children]. Ugeskr. Laeger 173, 2403–7 (2011).
- Droogh, J. M. et al. Inter-hospital transport of critically ill patients; expect surprises. Crit. Care 16, R26 (2012).
- Britto, J., Nadel, S., Maconochie, I., Levin, M. & Habibi, P. Morbidity and severity of illness during interhospital transfer: impact of a specialised paediatric retrieval team. BMJ 311, 836–9 (1995).
- Flabouris, a, Runciman, W. B. & Levings, B. Incidents during out-of-hospital patient transportation. Anaesth. Intensive Care 34, 228–36 (2006).
- King, B. R. & Woodward, G. A. Pediatric critical care transport–the safety of the journey: a five-year review of vehicular collisions involving pediatric and neonatal transport teams. Prehosp. Emerg. Care 6, 449–54
- Lampariello, S. et al. Stabilisation of critically ill children at the district general hospital prior to intensive care retrieval: a snapshot of current practice. Arch. Dis. Child. 95, 681–5 (2010).
- Lim, M. T. C. & Ratnavel, N. A prospective review of adverse events during interhospital transfers of neonates by a dedicated neonatal transfer service. Pediatr. Crit. Care Med. 9, 289–93 (2008).
- Lutman, D., Montgomery, M., Ramnarayan, P. & Petros, a. Ambulance and aeromedical accident rates during emergency retrieval in Great Britain. Emerg. Med. J. 25, 301–2 (2008).
- DS/EN 1789 + A1:2010. at <http://webshop.ds.dk/product/M247941/dsen-1789-a12010.aspx>
- Society, P. intensive care. Appendices to the standards for the care of critically ill children 4th edition. 1–62 (2010). at <http://www.ukpics.org.uk/documents/PICS Appx 4th Edn V2 20100707.pdf>
- American Academy of Pediatrics et al. Guidelines for Care of Children in the Emergency Department. (2009). at <http://www.childrensnational.org/files/PDF/EMSC/PubRes/ED_Preparedness_Checklist.pdf>
- Hinkelbein, J., Floss, F., Denz, C. & Krieter, H. Accuracy and precision of three different methods to determine Pco2 (Paco2 vs. Petco2 vs. Ptcco2) during interhospital ground transport of critically ill and ventilated adults. J. Trauma 65, 10–8 (2008).
- Dräger Medical GmbH. Oxylog 3000 manual (dokument 9037492-da, udgave 11-2010-09). at
- Dräger Medical GmbH. Brugsanvisning Oxylog 3000 plus (dokument 5705317-da udgave 3-2010-09). at
- Kochanek, P. M. et al. Guidelines for the acute medical management of severe traumatic brain injury in infants, children, and adolescents–second edition. Pediatr. Crit. Care Med. 13 Suppl 1, S1–82 (2012).
- Engelhardt, T. & Weiss, M. A child with a difficult airway: what do I do next? Curr. Opin. Anaesthesiol. 25, 326–32 (2012).
- Weiss, M. & Engelhardt, T. Proposal for the management of the unexpected difficult pediatric airway. Paediatr. Anaesth. 20, 454–64 (2010).
- Frova, G. et al. Recommendations for airway control and difficult airway management in paediatric patients. Minerva Anestesiol. 72, 723–48 (2006).
- Henneberg, S. W. & Hansen, T. G. Børneanæstesi. 288 (FADL, 2008).
- Nishisaki, A. et al. Evaluation of multidisciplinary simulation training on clinical performance and team behavior during tracheal intubation procedures in a pediatric intensive care unit. Pediatr. Crit. Care Med. 12, 406–14 (2011).
- Nishisaki, A., Turner, D. a, Brown, C. a, Walls, R. M. & Nadkarni, V. M. A National Emergency Airway Registry for children: landscape of tracheal intubation in 15 PICUs. Crit. Care Med. 41, 874–85 (2013).
- Heinrich, S. et al. Incidence and predictors of difficult laryngoscopy in 11,219 pediatric anesthesia procedures. Paediatr. Anaesth. 22, 729–36 (2012).
- Sims, C. & von Ungern-Sternberg, B. S. The normal and the challenging pediatric airway. Paediatr. Anaesth. 22, 521–6 (2012).
- Xue, F. S. et al. Study of the safe threshold of apneic period in children during anesthesia induction. J. Clin. Anesth. 8, 568–74 (1996).
- Gencorelli, F. J., Fields, R. G. & Litman, R. S. Complications during rapid sequence induction of general anesthesia in children: a benchmark study. Paediatr. Anaesth. 20, 421–4 (2010).
- Szekely, S. M., Runciman, W. B., Webb, R. K. & Ludbrook, G. L. Crisis management during anaesthesia: desaturation. Qual. Saf. Health Care 14, e6 (2005).
- Nishisaki, A. et al. Characterization of tracheal intubation process of care and safety outcomes in a tertiary pediatric intensive care unit. Pediatr. Crit. Care Med. 13, e5–10 (2012).
- Jensen, a G. et al. Scandinavian clinical practice guidelines on general anaesthesia for emergency situations. Acta Anaesthesiol. Scand. 54, 922–50 (2010).
- Cheng, C. a Y., Aun, C. S. T. & Gin, T. Comparison of rocuronium and suxamethonium for rapid tracheal intubation in children. Paediatr. Anaesth. 12, 140–5 (2002).
- Jones, P., Dauger, S. & Peters, M. J. Bradycardia during critical care intubation: mechanisms, significance and atropine. Arch. Dis. Child. 97, 139–44 (2012).
- Jones, P. et al. The effect of atropine on rhythm and conduction disturbances during 322 critical care intubations. Pediatr. Crit. Care Med. 14, e289–97 (2013).
- Shaffner, D. H. The continuing controversy about the use of atropine before laryngoscopy and tracheal intubation in children. Pediatr. Crit. Care Med. 14, 651–3 (2013).
- Brierley, J. et al. Clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock: 2007 update from the American College of Critical Care Medicine. Crit. Care Med. 37, 666–88 (2009).
- Weiss, M., Dullenkopf, a, Fischer, J. E., Keller, C. & Gerber, a C. Prospective randomized controlled multi-centre trial of cuffed or uncuffed endotracheal tubes in small children. Br. J. Anaesth. 103, 867–73 (2009).
- Taylor, C., Subaiya, L. & Corsino, D. Pediatric cuffed endotracheal tubes: an evolution of care. Ochsner J. 11, 52–6 (2011).
- Spence, K. & Barr, P. Nasal versus oral intubation for mechanical ventilation of newborn infants. Cochrane database Syst. Rev. CD000948 (2000). doi:10.1002/14651858.CD000948
- Bille, A. B., Holm-knudsen, R., Lefort, M. & Afshari, A. Optisk og videoassisteret laryngoskopi ved vanskelige luftveje hos børn. 119–122 (2012).
- Holm-Knudsen, R. J., Rasmussen, L. S., Charabi, B., Bøttger, M. & Kristensen, M. S. Emergency airway access in children–transtracheal cannulas and tracheotomy assessed in a porcine model. Paediatr. Anaesth. 22, 1159–65 (2012).
- Weiss, M., Schwarz, U., Dillier, C., Fischer, J. & Gerber, a C. Use of the intubating laryngeal mask in children: an evaluation using video-endoscopic monitoring. Eur. J. Anaesthesiol. 18, 739–44 (2001).
- Holm-Knudsen, R. The difficult pediatric airway–a review of new devices for indirect laryngoscopy in children younger than two years of age. Paediatr. Anaesth. 21, 98–103 (2011).
- Association of Paediatric Anaesthetists, Royal College of Anaesthetists & Difficult Airway Society. Difficult mask ventilation (MV) – during routine induction of anaesthesia in a child aged 1 to 8 years. (2012). at <http://www.apagbi.org.uk/sites/default/files/images/APA1-DiffMaskVent-FINAL.pdf>
- Association of Paediatric Anaesthetists, Difficult Airway Society & Royal College of Anaesthetists. Unanticipated difficult tracheal intubation – during routine induction of anaesthesia in a child aged 1-8 years. (2012). at <http://www.apagbi.org.uk/sites/default/files/images/APA2-UnantDiffTracInt-FINAL.pdf>
- Association of Paediatric Anaesthetists, Difficult Airway Society & Royal College of Anaesthetists. Cannot intubate and cannot ventilate (CICV) in a paralysed anaesthetised child aged 1 to 8 years. (2012). at <http://www.apagbi.org.uk/sites/default/files/images/APA3-CICV-FINAL.pdf>
- Coté, C. J. & Hartnick, C. J. Pediatric transtracheal and cricothyrotomy airway devices for emergency use: which are appropriate for infants and children? Paediatr. Anaesth. 19 Suppl 1, 66–76 (2009).
- Bratton, S. L. et al. Critical care for pediatric asthma: wide care variability and challenges for study. Pediatr. Crit. Care Med. 13, 407–14 (2012).
- Krishnan, V. et al. Mortality in patients hospitalized for asthma exacerbations in the United States. Am. J. Respir. Crit. Care Med. 174, 633–8 (2006).
- Fitzgerald, M. et al. Global strategy for asthma management and prevention © 2012. (2012). at <http://www.ginasthma.org/local/uploads/files/GINA_Report_March13.pdf>
- British Thoracic Society & Scottish Intercollegiate Guidelines Network. British Guideline on the Management of Asthma. A national clinical guideline. 151 (2012). at <http://www.brit-thoracic.org.uk/Portals/0/Guidelines/AsthmaGuidelines/sign101 Jan 2012.pdf>
- Pedersen, S. E. et al. Global strategy for the diagnosis and management of asthma in children 5 years and younger. Pediatr. Pulmonol. 46, 1–17 (2011).
- Program, P. Expert Panel Report 3 (EPR-3): Guidelines for the Diagnosis and Management of Asthma-Summary Report 2007. J. Allergy Clin. Immunol. 120, S94–138 (2007).
- Hung, C. H., Hua, Y. M., Lee, M. Y., Tsai, Y. G. & Yang, K. D. Evaluation of different nebulized bronchodilators on clinical efficacy and hypokalemia in asthmatic children. Acta Paediatr. Taiwan 42, 287–90
- Ciarallo, L., Sauer, A. H. & Shannon, M. W. Intravenous magnesium therapy for moderate to severe pediatric asthma: results of a randomized, placebo-controlled trial. J. Pediatr. 129, 809–14 (1996).
- Fesmire, F. M. Intravenous magnesium for acute asthma. Ann. Emerg. Med. 22, 616–7; author reply 618–9 (1993).
- Torres, S. et al. Effectiveness of magnesium sulfate as initial treatment of acute severe asthma in children, conducted in a tertiary-level university hospital: a randomized, controlled trial. Arch. Argent. Pediatr. 110, 291–6 (2012).
- Cheuk, D. K. L., Chau, T. C. H. & Lee, S. L. A meta-analysis on intravenous magnesium sulphate for treating acute asthma. Arch. Dis. Child. 90, 74–7 (2005).
- Shann, F. Intravenous salbutamol. Pediatr. Crit. Care Med. 4, 128; author reply 128–9 (2003).
- Walsh, S. A., Paget, R. I. & Ramnarayan, P. Salbutamol usage and lactic acidosis in acute severe asthma. Pediatr. Crit. Care Med. 14, 116–7 (2013).
- Travers, A. H., Milan, S. J., Jones, A. P., Camargo, C. A. & Rowe, B. H. Addition of intravenous beta(2)-agonists to inhaled beta(2)-agonists for acute asthma. Cochrane database Syst. Rev. 12, CD010179 (2012).
- Browne, G. J. & Lam, L. T. Single-dose intravenous salbutamol bolus for managing children with acute severe asthma in the emergency department:Reanalysis of data. Pediatr. Crit. Care Med. 3, 117–123 (2002).
- Bogie, A. L., Towne, D., Luckett, P. M., Abramo, T. J. & Wiebe, R. a. Comparison of intravenous terbutaline versus normal saline in pediatric patients on continuous high-dose nebulized albuterol for status asthmaticus. Pediatr. Emerg. Care 23, 355–61 (2007).
- Ream, R. S. et al. Efficacy of IV theophylline in children with severe status asthmaticus. Chest 119, 1480–8 (2001)¨
- D’Avila, R. S., Piva, J. P., Marostica, P. J. C. & Amantea, S. L. Early administration of two intravenous bolus of aminophylline added to the standard treatment of children with acute asthma. Respir. Med. 102, 156–61 (2008).
- Øymar, K. & Halvorsen, T. Emergency presentation and management of acute severe asthma in children. Scand. J. Trauma. Resusc. Emerg. Med. 17, 40 (2009).
- Sellers, W. F. S. Inhaled and intravenous treatment in acute severe and life-threatening asthma. Br. J. Anaesth. 110, 183–90 (2013).
- Jat, K. R. & Chawla, D. Ketamine for management of acute exacerbations of asthma in children. Cochrane database Syst. Rev. 11, CD009293 (2012).
- Youssef-Ahmed, M. Z., Silver, P., Nimkoff, L. & Sagy, M. Continuous infusion of ketamine in mechanically ventilated children with refractory bronchospasm. Intensive Care Med. 22, 972–6 (1996).
- Maggi, J. C., Nussbaum, E., Babbitt, C., Maggi, F. E. & Randhawa, I. Pediatric fiberoptic bronchoscopy as adjunctive therapy in acute asthma with respiratory failure. Pediatr. Pulmonol. 47, 1180–4 (2012).
- Mayordomo-Colunga, J. et al. Predictive factors of non invasive ventilation failure in critically ill children: a prospective epidemiological study. Intensive Care Med. 35, 527–36 (2009).
- Dahl, R. & Bjermer, L. Nordic consensus report on asthma management. Nordic Asthma Consensus Group. Respir. Med. 94, 299–327 (2000).
- Oddo, M., Feihl, F., Schaller, M.-D. & Perret, C. Management of mechanical ventilation in acute severe asthma: practical aspects. Intensive Care Med. 32, 501–10 (2006).
- Rubin, B. K. & Pohanka, V. Beyond the guidelines: fatal and near-fatal asthma. Paediatr. Respir. Rev. 13, 106–11 (2012).
- Oh’s Intensive Care Medicine. 1292 (Butterworth-Heinemann, 2008).
- Meert, K. L., McCaulley, L. & Sarnaik, A. P. Mechanism of lactic acidosis in children with acute severe asthma. Pediatr. Crit. Care Med. 13, 28–31 (2012).
- Schroeder, A. R. et al. Apnea in children hospitalized with bronchiolitis. Pediatrics 132, e1194–201 (2013).
- Scottish Intercollegiate Guideline Network. Bronchiolitis in children. A national clinical guideline. 46 (2006). at <http://www.sign.ac.uk/pdf/sign91.pdf>
- Poets, C. F. When do infants need additional inspired oxygen? A review of the current literature. Pediatr. Pulmonol. 26, 424–8 (1998).
- Nagakumar, P. & Doull, I. Current therapy for bronchiolitis. Arch. Dis. Child. 97, 827–30 (2012).
- Teshome, G., Gattu, R. & Brown, R. Acute bronchiolitis. Pediatr. Clin. North Am. 60, 1019–34 (2013).
- Liet, J.-M. et al. Noninvasive therapy with helium-oxygen for severe bronchiolitis. J. Pediatr. 147, 812–7 (2005).
- Hollman, G. et al. Helium-oxygen improves Clinical Asthma Scores in children with acute bronchiolitis. Crit. Care Med. 26, 1731–6 (1998).
- Liet, J.-M., Ducruet, T., Gupta, V. & Cambonie, G. Heliox inhalation therapy for bronchiolitis in infants. Cochrane database Syst. Rev. CD006915 (2010). doi:10.1002/14651858.CD006915.pub2
- Zhang, L., Mendoza-Sassi, R. A., Wainwright, C. & Klassen, T. P. Nebulised hypertonic saline solution for acute bronchiolitis in infants. Cochrane database Syst. Rev. 7, CD006458 (2013).
- Village, E. G. & American Academy of Pediatrics – Subcommittee on Diagnosis and Management of Bronchiolitis. Diagnosis and management of bronchiolitis. Pediatrics 118, 1774–93 (2006).
- Eber, E. Treatment of acute viral bronchiolitis. Open Microbiol. J. 5, 159–64 (2011).
- Hartling, L. et al. Epinephrine for bronchiolitis. Cochrane database Syst. Rev. CD003123 (2011). doi:10.1002/14651858.CD003123.pub3
- Gadomski, A. M. & Brower, M. Bronchodilators for bronchiolitis. Cochrane database Syst. Rev. CD001266 (2010). doi:10.1002/14651858.CD001266.pub2
- Rodrigo, G. J. & Rodrigo, C. Elevated plasma lactate level associated with high dose inhaled albuterol therapy in acute severe asthma. Emerg. Med. J. 22, 404–8 (2005).
- Everard, M. L. et al. Anticholinergic drugs for wheeze in children under the age of two years. Cochrane database Syst. Rev. CD001279 (2005). doi:10.1002/14651858.CD001279.pub2
- Cade, a et al. Randomised placebo controlled trial of nebulised corticosteroids in acute respiratory syncytial viral bronchiolitis. Arch. Dis. Child. 82, 126–30 (2000).
- Wong, J. Y., Moon, S., Beardsmore, C., O’Callaghan, C. & Simpson, H. No objective benefit from steroids inhaled via a spacer in infants recovering from bronchiolitis. Eur. Respir. J. 15, 388–94 (2000).
- Fernandes, R. M. et al. Glucocorticoids for acute viral bronchiolitis in infants and young children. Cochrane database Syst. Rev. 6, CD004878 (2013).
- Davison, C., Ventre, K. M., Luchetti, M. & Randolph, A. G. Efficacy of interventions for bronchiolitis in critically ill infants: a systematic review and meta-analysis. Pediatr. Crit. Care Med. 5, 482–9 (2004).
- Markovitz, B. P. & Randolph, A. G. Corticosteroids for the prevention of reintubation and postextubation stridor in pediatric patients: A meta-analysis. Pediatr. Crit. Care Med. 3, 223–226 (2002).
- Khemani, R. G., Randolph, A. & Markovitz, B. Corticosteroids for the prevention and treatment of post-extubation stridor in neonates, children and adults. Cochrane database Syst. Rev. CD001000 (2009). doi:10.1002/14651858.CD001000.pub3
- Ventre, K., Haroon, M. & Davison, C. Surfactant therapy for bronchiolitis in critically ill infants. Cochrane database Syst. Rev. CD005150 (2006). doi:10.1002/14651858.CD005150.pub2
- Jat, K. R. & Chawla, D. Surfactant therapy for bronchiolitis in critically ill infants. Cochrane database Syst. Rev. 9, CD009194 (2012).
- Enriquez, A., Chu, I.-W., Mellis, C. & Lin, W.-Y. Nebulised deoxyribonuclease for viral bronchiolitis in children younger than 24 months. Cochrane database Syst. Rev. 11, CD008395 (2012).
- Tobias, J. D. Caffeine in the treatment of apnea associated with respiratory syncytial virus infection in neonates and infants. South. Med. J. 93, 294–6 (2000).
- Westley, C. R., Cotton, E. K. & Brooks, J. G. Nebulized racemic epinephrine by IPPB for the treatment of croup: a double-blind study. Am. J. Dis. Child. 132, 484–7 (1978).
- Everard, M. L. Acute bronchiolitis and croup. Pediatr. Clin. North Am. 56, 119–33, x–xi (2009).
- Vorwerk, C. & Coats, T. Heliox for croup in children ( Review ). (2010).
- Kline-Krammes, S. et al. Heliox in children with croup: a strategy to hasten improvement. Air Med. J. 31, 131–7
- Bjornson, C. et al. Nebulized epinephrine for croup in children. Cochrane database Syst. Rev. CD006619 (2011). doi:10.1002/14651858.CD006619.pub2
- Bjornson, C. et al. Nebulized epinephrine for croup in children ( Review ) Nebulized epinephrine for croup in children. (2013). doi:10.1002/14651858.CD006619.pub3.Copyright
- Toward Optimized Practice. Guideline for the diagnosis and management of croup. 2008 update. (2008). at <http://www.topalbertadoctors.org/download/252/croup_guideline.pdf>
- Bjornson, C. L. & Johnson, D. W. Croup. Lancet 371, 329–39 (2008).
- Russell, K. F., Liang, Y., O’Gorman, K., Johnson, D. W. & Klassen, T. P. Glucocorticoids for croup. Cochrane database Syst. Rev. CD001955 (2011). doi:10.1002/14651858.CD001955.pub3
- Santschi, M. et al. Acute lung injury in children: therapeutic practice and feasibility of international clinical trials. Pediatr. Crit. Care Med. 11, 681–9 (2010).
- Cheifetz, I. M. Management of acute lung injury: sharing data between adults and children. Respir. Care 56, 1258–68; discussion 1268–72 (2011).
- [No authors listed]. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N. Engl. J. Med. 342, 1301–8 (2000).
- Hatch and Sumner’s Textbook of Paediatric Anaesthesia. (Hodder Arnold).
- Fleming, S. et al. Normal ranges of heart rate and respiratory rate in children from birth to 18 years of age: a systematic review of observational studies. Lancet 377, 1011–8 (2011).
- Kendirli, T. et al. Mechanical ventilation in children. Turk. J. Pediatr. 48, 323–7 (2006).
- Magnay, A. R. Recent advances in intubation and mechanical ventilation. Paediatr. Respir. Rev. 2, 184–94 (2001).
- Farias, J. a et al. Mechanical ventilation in pediatric intensive care units during the season for acute lower respiratory infection: a multicenter study. Pediatr. Crit. Care Med. 13, 158–64 (2012).
- Marraro, G. A. Practical guidelines for mechanical ventilation. at <http://www.pediatriconcall.com/fordoctor/diseasesandcondition/pediatric_emergencies/mechanical_ventilation.asp>
- Albuali, W. H. et al. Have changes in ventilation practice improved outcome in children with acute lung injury? Pediatr. Crit. Care Med. 8, 324–30 (2007).
- Miller, M. P. & Sagy, M. Pressure characteristics of mechanical ventilation and incidence of pneumothorax before and after the implementation of protective lung strategies in the management of pediatric patients with severe ARDS. Chest 134, 969–73 (2008).
- Rotta, A. T. & Steinhorn, D. M. Is permissive hypercapnia a beneficial strategy for pediatric acute lung injury? Respir. Care Clin. N. Am. 12, 371–87 (2006).
- Spinella, P. C. & Priestley, M. a. Damage control mechanical ventilation: ventilator induced lung injury and lung protective strategies in children. J. Trauma 62, S82–3 (2007).
- Abdelsalam, M. & Cheifetz, I. M. Goal-directed therapy for severely hypoxic patients with acute respiratory distress syndrome: permissive hypoxemia. Respir. Care 55, 1483–90 (2010).
- Halbertsma, F. J. J. & van der Hoeven, J. G. Lung recruitment during mechanical positive pressure ventilation in the PICU: what can be learned from the literature? Anaesthesia 60, 779–90 (2005).
- Kheir, J. N. et al. Comparison of 2 lung recruitment strategies in children with acute lung injury. Respir. Care 58, 1280–90 (2013).
- Cruces, P., Donoso, A., Valenzuela, J. & Díaz, F. Respiratory and hemodynamic effects of a stepwise lung recruitment maneuver in pediatric ARDS: a feasibility study. Pediatr. Pulmonol. 48, 1135–43 (2013).
- Newth, C. J. L. et al. Weaning and extubation readiness in pediatric patients. Pediatr. Crit. Care Med. 10, 1–11 (2009).
- Jouvet, P. et al. Weaning children from mechanical ventilation with a computer-driven system (closed-loop protocol): a pilot study. Pediatr. Crit. Care Med. 8, 425–32 (2007).
- Principi, T. et al. Complications of mechanical ventilation in the pediatric population. Pediatr. Pulmonol. 457, 452–457 (2010).
- Bigham, M. T. et al. Ventilator-associated pneumonia in the pediatric intensive care unit: characterizing the problem and implementing a sustainable solution. J. Pediatr. 154, 582–587.e2 (2009).
- Marohn, K. & Panisello, J. M. Noninvasive ventilation in pediatric intensive care. Curr. Opin. Pediatr. 25, 290–6 (2013).
- Curley, M. A. Q. et al. Effect of prone positioning on clinical outcomes in children with acute lung injury: a randomized controlled trial. JAMA 294, 229–37 (2005).
- Yehya, N. et al. High frequency oscillation and airway pressure release ventilation in pediatric respiratory failure. Pediatr. Pulmonol. 1–9 (2013). doi:10.1002/ppul.22853
- Liu, L. et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000. Lancet 379, 2151–61 (2012).
- Watson, R. S. et al. The epidemiology of severe sepsis in children in the United States. Am. J. Respir. Crit. Care Med. 167, 695–701 (2003).
- Wolfler, A., Silvani, P., Musicco, M., Antonelli, M. & Salvo, I. Incidence of and mortality due to sepsis, severe sepsis and septic shock in Italian Pediatric Intensive Care Units: a prospective national survey. Intensive Care Med. 34, 1690–7 (2008).
- Shime, N. et al. Incidence and risk factors for mortality in paediatric severe sepsis: results from the national paediatric intensive care registry in Japan. Intensive Care Med. 38, 1191–7 (2012).
- Kutko, M. C. et al. Mortality rates in pediatric septic shock with and without multiple organ system failure. Pediatr. Crit. Care Med. 4, 333–7 (2003).
- De Oliveira, C. F. et al. ACCM/PALS haemodynamic support guidelines for paediatric septic shock: an outcomes comparison with and without monitoring central venous oxygen saturation. Intensive Care Med. 34, 1065–75 (2008)
- Ingels, H. et al. Impact of pneumococcal vaccination in Denmark during the first 3 years after PCV introduction in the childhood immunization programme. Vaccine 30, 3944–50 (2012).
- Hviid, A. & Melbye, M. Impact of routine vaccination with a conjugate Haemophilus influenzae type b vaccine. Vaccine 22, 378–82 (2004).
- Ceneviva, G., Paschall, J. A., Maffei, F. & Carcillo, J. A. Hemodynamic support in fluid-refractory pediatric septic shock. Pediatrics 102, e19 (1998).
- Goldstein, B., Giroir, B. & Randolph, A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr. Crit. Care Med. 6, 2–8 (2005).
- Dellinger, R. P. et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 39, 165–228 (2013).
- Sundhedsstyrelsen. Vejledning om blodtransfusion. at <http://sundhedsstyrelsen.dk/publ/publ2007/EFT/blodtransfusion/vejl_blodtransfusion.pdf>
- Martí-Carvajal, A. J., Solà, I., Lathyris, D. & Cardona, A. F. Human recombinant activated protein C for severe sepsis. Cochrane database Syst. Rev. 3, CD004388 (2012).
- Schiffmann, H. et al. Assessment of cardiac output, intravascular volume status, and extravascular lung water by transpulmonary indicator dilution in critically ill neonates and infants. J. Cardiothorac. Vasc. Anesth. 16, 592–7 (2002).
- Wong, H. R. & Dalton, H. J. The PICU perspective on monitoring hemodynamics and oxygen transport. Pediatr. Crit. Care Med. 12, S66–8 (2011).
- Spenceley, N., MacLaren, G., Kissoon, N. & Macrae, D. J. Monitoring in pediatric cardiac critical care: a worldwide perspective. Pediatr. Crit. Care Med. 12, S76–80 (2011).
- Kreymann, K. G., de Heer, G., Nierhaus, A. & Kluge, S. Use of polyclonal immunoglobulins as adjunctive therapy for sepsis or septic shock. Crit. Care Med. 35, 2677–85 (2007).
- El-Nawawy, A., El-Kinany, H., Hamdy El-Sayed, M. & Boshra, N. Intravenous polyclonal immunoglobulin administration to sepsis syndrome patients: a prospective study in a pediatric intensive care unit. J. Trop. Pediatr. 51, 271–8 (2005).
- Monagle, P. et al. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 141, e737S–801S (2012).
- Lindsay, C. a et al. Pharmacokinetics and pharmacodynamics of milrinone lactate in pediatric patients with septic shock. J. Pediatr. 132, 329–34 (1998).
- Barton, P. et al. Hemodynamic effects of i.v. milrinone lactate in pediatric patients with septic shock. A prospective, double-blinded, randomized, placebo-controlled, interventional study. Chest 109, 1302–12 (1996).
- Meyer, S., Gortner, L., Brown, K. & Abdul-Khaliq, H. The role of milrinone in children with cardiovascular compromise: review of the literature. Wien. Med. Wochenschr. 161, 184–91 (2011).
- De Luca, L., Colucci, W. S., Nieminen, M. S., Massie, B. M. & Gheorghiade, M. Evidence-based use of levosimendan in different clinical settings. Eur. Heart J. 27, 1908–20 (2006).
- Maitland, K. et al. Mortality after fluid bolus in African children with severe infection. N. Engl. J. Med. 364, 2483–95 (2011).
- Perner, A. et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N. Engl. J. Med. 367, 124–34 (2012).
- McKinnon, R. P. & Wildsmith, J. a. Histaminoid reactions in anaesthesia. Br. J. Anaesth. 74, 217–28 (1995).
- Playfor, S. et al. Consensus guidelines on sedation and analgesia in critically ill children. Intensive Care Med. 32, 1125–36 (2006).
- Welzing, L. et al. Remifentanil-induced tolerance, withdrawal or hyperalgesia in infants: a randomized controlled trial. RAPIP trial: remifentanil-based analgesia and sedation of paediatric intensive care patients. Neonatology 104, 34–41 (2013).
- pro.medicin.dk. at <pro.medicin.dk>
- Vet, N. J. et al. Optimal sedation in pediatric intensive care patients: a systematic review. Intensive Care Med. 39, 1524–34 (2013).
- Strøm, T., Martinussen, T. & Toft, P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial. Lancet 375, 475–80 (2010).
- Deeter, K. H. et al. Successful implementation of a pediatric sedation protocol for mechanically ventilated patients. Crit. Care Med. 39, 683–8 (2011).
- Lloyd-Thomas, A. R. & Booker, P. D. Infusion of midazolam in paediatric patients after cardiac surgery. Br. J. Anaesth. 58, 1109–15 (1986).
- Silvasi, D. L., Rosen, D. A. & Rosen, K. R. Continuous intravenous midazolam infusion for sedation in the pediatric intensive care unit. Anesth. Analg. 67, 286–8 (1988).
- Ambrose, C. et al. Intravenous clonidine infusion in critically ill children: dose-dependent sedative effects and cardiovascular stability. Br. J. Anaesth. 84, 794–6 (2000).
- Tobias, J. D. Dexmedetomidine: applications in pediatric critical care and pediatric anesthesiology. Pediatr. Crit. Care Med. 8, 115–31 (2007).
- Carroll, C. L. et al. Use of dexmedetomidine for sedation of children hospitalized in the intensive care unit. J. Hosp. Med. 3, 142–7 (2008).
- Phan, H. & Nahata, M. C. Clinical uses of dexmedetomidine in pediatric patients. Paediatr. Drugs 10, 49–69 (2008).
- Vasile, B., Rasulo, F., Candiani, A. & Latronico, N. The pathophysiology of propofol infusion syndrome: a simple name for a complex syndrome. Intensive Care Med. 29, 1417–25 (2003).
- Zaccheo, M. M. & Bucher, D. H. Propofol infusion syndrome: a rare complication with potentially fatal results. Crit. Care Nurse 28, 18–26; quiz 27 (2008).
- Tobias, J. D. Sedation and analgesia in paediatric intensive care units: a guide to drug selection and use. Paediatr. Drugs 1, 109–26 (1999).
- Parkinson, L. et al. A randomized controlled trial of sedation in the critically ill. Paediatr. Anaesth. 7, 405–10 (1997).
- Lee, J., Huh, L., Korn, P. & Farrell, K. Guideline for the management of convulsive status epilepticus in infants and children. B. C. Med. J. 53, 279–285 (2011).
- Friedman, J. Emergency management of the paediatric patient with generalized convulsive status epilepticus. Paediatr. Child Health 16, 91–104 (2011).
- Brophy, G. M. et al. Guidelines for the evaluation and management of status epilepticus. Neurocrit. Care 17, 3–23 (2012).
- Abend, N. S., Monk, H. M., Licht, D. J. & Dlugos, D. J. Intravenous levetiracetam in critically ill children with status epilepticus or acute repetitive seizures. Pediatr. Crit. Care Med. 10, 505–10 (2009).
Indholdsfortegenelse
