RETNINGSLINJEN ER UDARBEJDET AF:
Dansk Selskab for Trombose og Hæmos
Redaktionsgruppe
» Overlæge Jørn Dalsgaard Nielsen
Videncenter for Antikoagulant Behandling
Bispebjerg og Frederiksberg Hospitaler
E-mail: joern.dalsgaard.nielsen.01@regionh.dk
» Ledende overlæge, dr.med., Steen Elkjær Husted
Medicinsk afdeling Hospitalsenheden Vest
Gl. Landevej 61, 7400 Herning
Lægaardsvej 12, 7500 Holstebro
E-mail: steehust@rm.dk
» Ledende overlæge, ph.d., Anna-Marie Münster
Klinisk Biokemisk Afdeling, Hospitalsenheden Vest
Gl. Landevej 61, 7400 Herning
Lægaardsvej 12, 7500 Holstebro
E-mail: anmuns@rm.dk
I høring
Behandlingsvejledningen er sendt i høring hos 20 videnskabelige selskaber. Fra nedenstående selskaber har vi modtaget konstruktive forslag, som er indarbejdet i denne 3. reviderede udgave af vejledningen. Selskaberne har været repræsenteret ved:
Dansk Cardiologisk Selskab
Axel Brandes
Dansk Selskab for Gastroenterologi og Hepatologi
Bo Søndergaard
Dansk Karkirurgisk Selskab
Nikolaj Eldrup
Dansk Kirurgisk Selskab
Hans B Rahr
Dansk Lungemedicinsk selskab
Elisabeth Bendstrup
Dansk Neurokirurgisk Selskab
Morten Ziebell
Dansk Ortopædisk Selskab
Ole Ovesen og Henrik Palm
Dansk Radiologisk Selskab
Bo Nyhuus, Søren Torp Pedersen og Hans Henrik Torp Madsen
Dansk Selskab for Anæstesiologi og Intensiv Medicin
Jakob Stensballe
Dansk Selskab for Gynækologi og Obstetrik
Helle Vibeke Clausen og Jannie Dalby Salvig
Dansk Thoraxkirurgisk Selskab
Thomas Decker Christensen
Dansk Selskab for Klinisk Immunologi
Sisse Rye Ostrowski
Dansk Selskab for Otolaryngologi, hoved og halskirurgi
Tejs Ehlers Klug
Dansk Selskab for Plastik- og Rekonstruktionskirurgi
Liselotte Ebbesen
Dansk Urologisk Selskab
Bettina Nørby og Claus Dahl
Dansk Selskab for Klinisk Biokemi
Anne-Mette Hvas
Forkortelser
Indledning
Kommissorium og redaktionsgruppens sammensætning
Dansk Selskab for Trombose og Hæmostase etablerede i 2006 en arbejdsgruppe repræsenterende talrige videnskabelige selskaber med det kommisorium at formulere nationale retningslinjer for håndtering af antitrombotisk behandling i forbindelse med invasive procedurer. Målet med retningslinjerne var, ”at opnå den lavest mulige incidens af letale og invaliderende hæmostaserelaterede komplikationer ved forskellige invasive procedurer på patienter i forskellige typer antitrombotisk behandling for forskellige former for tromboserisiko”. Retningslinjerne blev publiceret i januar 2007 (1;1), revideret første gang i 2011, og nu med samme kommisorium, en 3. udgave. DSTH’s bestyrelse har udpeget den tidligere redaktionsgruppe bestående af overlæge Jørn Dalsgaard Nielsen, Videncenter for Antikoagulant Behandling, Bispebjerg og Frederiksberg Hospitaler, ledende overlæge, dr. med. Steen Husted, Medicinsk afdeling, Hospitalsenheden Vest samt ledende overlæge, ph.d., Anna-Marie Münster, Klinisk Biokemisk afdeling, Hospitalsenheden Vest.
Redaktionsgruppen har også denne gang besluttet at indbyde og involvere interesserede videnskabelige selskaber, og revisionen har været udsendt til høring i de angivne videnskabelige selskaber (se side 3) og er gjort tilgængelig på Dansk Selskab for Trombose og Hæmostases hjemmeside www.dsth.dk.
Dansk selskab for Trombose og Hæmostase og redaktionsgruppen takker alle de deltagende selskaber, deres repræsentanter og medlemmerne for et værdifuldt samarbejde omkring udarbejdelsen af disse retningslinjer for varetagelse af den perioperative regulering af antitrombotisk behandling.
Ændringer siden sidste version
» Nye retningslinjer for heparin-bridging. H-B medfører øget blødningsrisiko og ingen reduktion i incidensen af tromboemboliske komplikationer hos patienter med ikkehøj tromboserisiko.
» Revideret afsnit om præoperativ vurdering af risiko for perioperativ blødning og tromboemboli.
» Revideret afnit om forholdsregler ved neuroaksial blokade.
» Ændringer i oversigt over antitrombotiske midler. Udgået: Drotrecogin alfa (aktiveret), Xigris®. Tirofiban, Aggrestat®. Nye: Apixaban, Eliquis®. Edoxaban, Lixiana®. Idaricizumab, Praxbind®. Cangrelor, Kengrexal®.
» Nye erfaringer med indgreb under opretholdt eller let nedreguleret VKA-behandling.
» Perioperativ håndtering af apixaban og edoxaban.
» Brug af idarucizumab til ophævelse af den antikoagulante virkning af dabigatran.
» Brug af CHA2DS2-VASc-score til vurdering af embolirisiko ved atrieflimren.
Baggrund
Antallet af patienter i antitrombotisk behandling har gennem de sidste år været stigende. I 2014 var der i Danmark ifølge Sundhedsdatastyrelsen i primærsektoren 526.147 patienter i behandling med midler mod blodpropper (ATC-gruppe B). Langt de fleste, 424.568 patienter, er i antitrombotisk behandling med trombocythæmmere, mens 89.959 patienter er i antikoagulant behandling med vitamin K-antagonister (VKA) og 45.672 patienter i non-VKA orale antikoagulantia (NOAK). Sammenlignet med 2008 er dette en stigning på 9% i antal personer i behandling med antitrombotiske lægemidler. Stigningen ses gennem de sidste 4 år hovedsagelig på forbruget af NOAK, hvorimod forbruget af trombocythæmmere er faldet og VKA stagneret (personlig kommunikation, Sundhedsdatastyrelsen 2015).
Det betyder, at omkring 8% af den danske befolkning er i antitrombotisk behandling. Der er en høj grad af evidens for effekten af de antitrombotiske midler i forhold til progression af trombose samt primær og sekundær profylakse af tromboembolisk sygdom (Trombokardiologirapporten, tabel 1) (2). Derfor opstår der også ofte et dilemma, når patienter i antitrombotisk behandling skal have foretaget et invasivt eller operativt indgreb, idet pausering eller ændret intensitet kan øge risikoen for udvikling eller progression af trombose og tromboemboliske komplikationer, mens fortsættelse af den antitrombotiske behandling kan medføre en øget risiko for blødning. Forud for ethvert indgreb må den overordnede risiko for blødning således vurderes og balanceres mod risikoen for trombose.
Risikoen for blødning afspejles blandt andet ved:
» Patientens blødningskarakteristika. Patienter med hæmoragisk diatese (f.eks. hæmofili, von Willebrands sygdom, trombocytopati/-peni) eller patienter med tidligere blødning, apopleksi, anæmi, nedsat nyrefunktion eller høj alder har alle en høj blødningsrisiko.
» Typen og intensiteten af den antitrombotiske behandling.
» Det specifikke invasive indgreb/kirurgiske traume.
Risikoen for trombose afhænger blandt andet af:
» Indikationen for den antitrombotiske behandling (f.eks.høj tromboserisiko ved mekanisk mitralklap eller nylig arteriel eller venøs tromboembolisk sygdom).
» Patientens co-morbiditet og alder.
» Det specifikke invasive indgreb/kirurgiske traume. Ved større indgreb, og ved cancerkirurgi, er der på grund af en kraftigere aktivering af det hæmostatiske system en større risiko for tromboemboliske komplikationer (3;4).
Det betyder, at der for den individuelle patient, må risikostratificeres i forhold til patientrelaterede risikofaktorer, den antitrombotiske terapi og det invasive indgreb. Ønskes den antitrombotiske behandling pauseret grundet høj risiko for blødning, skal tidspunktet for pausering og genoptagelse af den antitrombotiske behandling planlægges, og det skal ved høj risiko for trombose overvejes, om der er behov for at erstatte den antitrombotiske behandling med en alternativ overlappende antikoagulerende behandling. Disse overvejelser vedrørende den perioperative regulering af den antitrombotiske behandling kan være vanskelige og vil ofte kræve et tæt samarbejde mellem kolleger fra forskellige specialer.
Vi har i denne vejledning forsøgt at skabe en oversigt over tilgængelig viden på området og angive så klare retningslinjer som muligt, men selv om perioperativ regulering af antitrombotisk behandling er en daglig og almindelig forekommende udfordring, er evidensen på området under udvikling, men stadig begrænset. Der er flere forbehold, som bør anføres:
» Antallet af randomiserede studier er stadig begrænset. De fleste anbefalinger bygger på resultater af observationelle studier med få patienter. Der er dog nyligt tilkommet et vigtigt randomiseret heparin-bridging studie på patienter med relativt lav risiko for trombose (5), der ligesom observationelle studier viser en øget hyppighed af blødning ved anvendelse af “bridging” til patienter med ikke-høj tromboserisiko (6). Det understreger vigtigheden af individuel risikostratificering, og selekteret indsats i forhold til høj-risiko patienter for trombose, da nødvendigheden af “bridging” intervention under warfarinpause hos disse patienter stadig er uafklaret. Retningslinjerne for perioperative procedurer har derfor, med undtagelser i forhold til specifikke indgreb under opretholdt warfarinbehandling, stadig mere baggrund i traditioner end medicinsk evidens.
» Den perioperative blødningsrisiko kan være vanskelig at vurdere, da man i de foreliggende studier har defineret blødningskomplikationer på forskellig vis. En større grad af harmonisering nationalt og internationalt, til gavn for tolkning af data i klinisk praksis, er dog fremkommet i litteraturen gennem de sidste 4-5 år.
» Der savnes studier, hvor man separat har vurderet betydningen af patientrelaterede, behandlingsrelaterede og procedurerelaterede risikofaktorer. Studier er undervejs. Inden for kardiologien er den patientrelaterede blødningsrisiko evalueret præ-operativt via HAS-BLED score i et mindre kardiologisk studie blandt patienter i længerevarende oral antikoagulationsbehandling, hvor der tilbydes bridging-terapi under invasive indgreb (hjertekateterisation, pacemakerimplantation, kirurgi). En HAS-BLED score ≥3 fandtes forbundet med en signifikant øget risiko for blødning hos disse patienter (7).
» Den tromboemboliske risiko er typisk estimeret udfra den årlige tromboemboliske (TE)-risikorate. Denne kan være overestimeret, idet der er fundet lavere TE-event rater i prospektive observationelle studier. Omvendt har TE-risikogrupper været dårligt defineret, og mange af højrisiko-patienterne har været ekskluderet.
» Tidligere har der i litteraturen ikke været en éntydig definition af bridging-terapi. Gennem årene har man i de forskellige studier anvendt forskellig ”timing” og forskellige doser af henholdsvis ufraktioneret heparin og LMH (terapidoser versus profylaksedoser) (8-11). Efter den sidste opdatering af perioperativ håndtering af antitrombotisk behandling i ACCP guideline (12), er der fremkommet en større grad af ensartethed vedrørende de anvendte bridging-regimer både internationalt og nationalt, i særlig grad i kraft af DSTH’s bridging applikation.
Siden sidste version af PRAB er der tilkommet nye og lærerige data specielt i forhold til patienter med ikke-høj risiko for trombose, men generelt mangler vi stadig randomiserede undersøgelser, samt studier som valideret stratificerer patientrisiko og procedurerelateret risiko i forhold til trombose og blødning. Indtil da må vi nøjes med teoretiske overvejelser baseret på kendt og estimeret TE-risiko ved aktuel indikation og procedure vurderet i forhold til estimeret blødningsrisiko relateret til procedure og patient. På trods af disse forbehold er der mange gode grunde til at udarbejde en vejledning som opsummerer og formidler den tilgængelige viden om perioperativ regulering af antitrombotisk behandling, fordi:
» Patienter med høj risiko for trombose jævnligt udsættes for unødig risiko for tromboemboliske komplikationer under pause med antitrombotiske behandling ved indgreb, hvor der kun er ubetydelig blødningsrisiko.
» Patienter med lav risiko for trombose udsættes for “overbehandling” med bridging terapi og øget risiko for blødning, under pause med oral antitrombotisk behandling, ved indgreb hvor der kun er ubetydelig tromboserisiko.
» Ensartede retningslinjer for perioperativ regulering af antitrombotisk behandling vil betyde ensartet information vedrørende perioperativ regulering af antitrombotisk behandling inden for alle specialer og større patienttryghed i forhold til behandlingen.
» Kendskabet til anvendelse af topiske midler til forebyggelse og behandling af blødning i forbindelse med indgreb på patienter i antitrombotisk behandling bør øges.
» Kendskabet til individuel risikostratifikation bør øges, således at patienter med høj tromboserisiko erkendes og behandles perioperativt med antikoagulerende behandling.
» Konsensus for anvendelse af ”bridging” terapi bør opnås. Specielt hvad angår patientgruppe (høj tromboserisiko), dosering og ”timing” af heparinadministrationen, så man undgår, at den tromboseprofylaktiske gevinst fører til en uacceptabel stigning i postoperative blødningskomplikationer.
» Nye antitrombotiske midler er blevet introduceret og flere er på vej. På nuværende tidspunkt findes kun antidot (idarucizumab) for den direkte trombinhæmmer dabigatran etexilat (Pradaxa®). Antidot for Xa-hæmmerne og ticagrelor er under udvikling, men endnu ikke tilgængelig. Fælles for de nye orale antikoagulantia (dabigatran etexilat, rivaroxaban, apixaban, edoxaban) er, at erfaringer vedrørende monitorering og behandling af overdosering er mangelfuld.
Denne vejledning bygger i videst muligt omfang på evidensbaseret viden. Der findes dog fortsat en række situationer, hvor ”bedste kliniske skøn” må anvendes på grund af inkonsistente undersøgelsesresultater eller utilstrækkelig evidensbaseret praksis. Den kliniske hverdag kan således byde på situationer, hvor den behandlende læge har argumenter for at afvige fra de nærværende rekommandationer, idet enhver patientbehandling og procedure er underlagt en individuel risikovurdering. I vejledningen har redaktionen i samarbejde med et stort antal læger fra forskellige specialer søgt at samle den bedst mulige tilgængelige viden integreret med klinikerens ekspertise om perioperativ regulering af antitrombotisk behandling.

Præoperativ risikovurdering
Tromboembolisk risiko
Ved hæmostatisk balance forstås ligevægten mellem pro- og antitrombotiske mekanismer i kredsløbet hos raske personer. Hvis der opstår trombose, gives antitrombotisk behandling for at standse den trombotiske proces. Mens de naturlige antitrombotiske mekanismer afspiller deres virkning lokalt, hvor trombedannelse finder sted, har antitrombotisk behandling en systemisk virkning, som derfor ikke blot stopper trombedannelsen, men også medfører øget blødningstendens. Afvejningen mellem tromboserisiko og blødningsrisiko udgør en central del ved stillingtagen til, om et lægemiddel, som medfører øget blødningsrisiko, bør seponeres før en planlagt invasiv procedure.
Ved enhver invasiv procedure er der en risiko for blødningskomplikationer. Risikoen afhænger dels af procedurens art og dels af patientrelaterede faktorer, dvs. medfødt eller erhvervet blødningstendens, herunder antitrombotisk behandling. Tilsvarende afhænger tromboserisikoen ved invasive procedurer også af indgrebets art og patientrelaterede faktorer (figur 1).
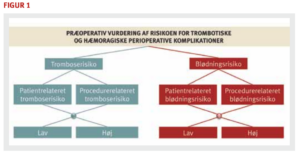
Den præoperative vurdering af risikoen for vaskulære komplikationer ved en invasiv procedure består i en samlet vurdering af patientrelaterede og procedurerelaterede risici for henholdsvis trombose og blødning. Hos patienter i antitrombotisk behandling vil seponering af den antitrombotiske behandling inden indgrebet resultere i øget tromboserisiko, men omvendt kan opretholdelse af behandling indebære øget blødningsrisiko. Hvis den antitrombotiske behandling seponeres inden et indgreb kan der være indikation for tromboseprofylakse med lavmolekylært heparin i forbindelse med indgrebet. I nogle tilfælde kan indgreb foretages under opretholdt eller kortvarig nedregulering af antitrombotisk behandling. I kapitel 3 findes en oversigt over situationer, hvor dette er muligt.
Patientrelateret risiko for tromboemboliske komplikationer
De almindeligste indikationer for kronisk antitrombotisk behandling er aterotrombotisk sygdom (ATE), atrieflimren/flagren (AF), hjerteklapproteser og venøs tromboembolisk sygdom (VTE). I det følgende gives en oversigt over risikoen for tromboemboliske komplikationer ved disse tilstande under og uden for antitrombotisk behandling.
Aterosklerotiske og -trombotiske sygdomme
De aterotrombotiske sygdomme omfatter følgende hovedgrupper:
Iskæmiske cerebrovaskulære sygdomme:
» Transitorisk cerebral iskæmi (TCI)
» Iskæmisk apopleksi
Iskæmiske hjertesygdomme:
» Akut koronart syndrom
– ST-elevations myokardieinfarkt
– Non-ST-elevations myokardieinfarkt
– Ustabil angina pectoris
» Kronisk iskæmisk hjertesygdom
Perifer aterotrombose:
» Claudicatio intermittens
» Underekstremitetsiskæmi med hvilesmerter
» Akut svær underekstremitetsiskæmi
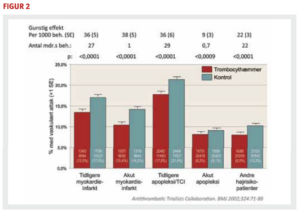
Som antitrombotisk profylakse ved disse sygdomme anvendes som monoterapi eller i forskellige kombinationer acetylsalicylsyre (ASA), dipyridamol, clopidogrel, prasugrel og ticagrelor. I Antithrombotic Trialists metaanalyse omfattende 135.640 patienter i behandling med trombocythæmmere fortrinsvis ASA, fandt man en incidens af vaskulære attakker (vaskulær død, non-letalt myokardieinfarkt og non-letalt cerebralt infarkt) på 10,7% hos patienter i trombocythæmmende behandling mod 13,2% blandt placebobehandlede patienter, svarende til en reduktion i odds ratio på 22% ± 4 (SE) (figur 2) (13). Risikoreduktionen var til stede i alle patientgrupper, men mindre blandt patienter med akut apopleksi (8,2% versus 9,1%) end i de øvrige patientgrupper. Ved akut koronart syndrom (AKS) foretages ofte revaskularisering i form af enten perkutan koronar intervention (PCI) med anlæggelse af stent eller koronar bypass operation (CABG). Ved PCI anvendes forskellige stenttyper: BMS (bare metal stent) og DES (drug-eluting stent), hvoraf der er flere fabrikater. DES frigør et stof, som modvirker restenose, men derved også hæmmer endotelialisering af stenten. Der anbefales ved anvendelse af PCI med stent altid behandling med både ASA livslangt og et thienopyridinpræparat (clopidogrel eller prasugrel) eller ticagrelor, som gives i minimum 1 og 3-6 måneder for henholdsvis BMS og DES (afhængig af DES type, blødningsrisiko, stabil CAD eller AKS) (14-16). Ved insufficient behandlingslængde efter stentning er risikoen for stenttrombose meget høj, og mortaliteten ved en sådan komplikation nærmer sig 50% (17). Ved akut koronart syndrom anbefales behandling med ASA livslangt og 12 måneder for ADP-receptor blokkerende stof, hvoraf ticagrelor primært anbefales. Behandling ud over 12 måneder med kombination af ASA og ticagrelor kan anbefales til visse høj trombogene patienter (18).
Ved TCI og aterotrombotisk apopleksi er standardbehandlingen enten kombinationen ASA og dipyridamol eller clopidogrel monoterapi. Førstevalg aktuelt er nu clopidogrel. I udvalgte tilfælde med ustabile patienter anbefales en kombination af ASA og clopidogrel i op til 3 måneder.
Patienter med perifer aterosklerose behandles med ASA eller clopidogrel: der er præference for clopidogrel, som har vist større effektivitet end ASA (19).
På grund af den betydeligt øgede risiko for blødning anvendes kun undtagelsesvis kombinationsbehandling med flere antitrombotika. I korte perioder kan der være behov for både dual trombocythæmning og oral antikoagulation, men hos den stabiliserede patient kan monoterapi med oral antikoagulation være den optimale langtidsbehandling (19;20). I forbindelse med operationer og procedurer hos patienter i behandling med trombocythæmmere overvejes dels risikoen for blødning ved fortsat behandling og risikoen for aterotrombotiske komplikationer ved kortere eller længere tids pause med behandling før indgrebet. Drejer det sig om elektive indgreb med høj blødningsrisiko, bør man altid overveje udsættelse, indtil tromboserisikoen under pause med den trombocythæmmende behandling er acceptabel.
Kortvarig pause (‹14 dage) i behandling med dual trombocythæmmer undtagelsesvis inden for 30 dage hos patienter behandlet med perkutan koronar intervention (PCI) har ikke vist øget tromboembolirisiko i en større prospektiv observationel undersøgelse (21). Eisenberg et al. har analyseret 161 tilfælde af stenttrombose opstået ›30 dage efter PCI og implantation af DES (22). Patienter, som ophørte med både ASA og ADP-receptorhæmmer fik stenttrombose efter gennemsnitlig 7 dage, mens patienter, som fortsatte med ASA udviklede trombose efter gennemsnitlig 122 dage, heraf 6% inden for de første 10 dage. Forfatterne konkluderede, at kortvarig pausering af en ADP-receptorhæmmer mere end 30 dage efter PCI og DES-implantation i forbindelse med et uopsætteligt kirurgisk indgreb er relativt sikkert, såfremt patienten fortsætter med ASA.

Atrieflimren/atrieflagren
Patienter med AF har en øget risiko for systemiske emboliske komplikationer, oftest i form af cerebrale embolier. Atrieflimren er således en uafhængig risikofaktor for apopleksi, og ved atrieflimren er risikoen for apopleksi gennemsnitlig øget 5 gange. Embolirisikoen ved AF er bl.a. beskrevet i de fælles amerikanske og europæiske guidelines for behandling af patienter med AF og i den danske Trombokardiologirapport (23;24). Embolirisikoen ved atrieflimren afhænger af tilstedeværelsen af forskellige risikofaktorer. Følgende faktorer er kendte risikofaktorer ved atrieflimren og øger embolirisikoen:
» Tidligere TCI eller iskæmisk apopleksi
» Hypertension
» Stigende alder ›75 år
» Klinisk hjertesvigt eller moderat til svær venstre ventrikel dysfunktion ved ekkokardiografi (EF ‹35%)
» Diabetes mellitus
» Vaskulær sygdom
» Alder 65-74 år
» Kvinder
Flere kliniske studier har vist, at kvindeligt køn medfører en let øget risiko for tromboemboli. Hvis kvindeligt køn er eneste risikofaktor undlades antitrombotisk behandling (23). Baseret på de tilstedeværende risikofaktorer er der anvendt forskellige risikostratifikationsmodeller for inddeling af atrieflimrenpatienter i:
» Højrisikogruppe, TE-risiko ≥10% p.a.
» Lavrisikogruppe, TE-risiko ‹1% p.a.
Der er publiceret flere risikostratifikationsmodeller, men til de mest anvendte hører CHADS2-score (Cardiac failure: 1 point, Hypertension: 1 point, Age ≥75 y: 1 point, Diabetes: 1 point, Stroke: 2 point) og CHA2DS2-VASc, som mere sikkert definerer patienter med lav TE-risiko. Tabel 1 viser de to scoringssystemer og TE-risiko ved score 0-2.
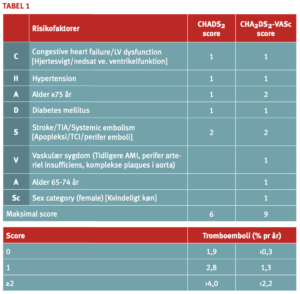
Embolirisiko vurderes ud fra CHA2DS2-VASc score på henholdsvis ›1, 1 og 0, hvor CHA2DS2-VASc score score på ≥1 hos mænd og ›1 hos kvinder indicerer antikoagulans behandling. En CHA2DS2-VASc score score på 0 og 1 for kvinder medfører ingen antikoagulansbehandling (23).
Antikoagulant behandling ved atrieflimren:
Talrige undersøgelser har dokumenteret at velreguleret antikoagulansbehandling med VKA (TTI≥70%) eller NOAK markant reducerer risikoen for apopleksi og systemisk tromboemboli uden at risikoen for blødning overstiger den tromboemboliske gevinst (25). Behandling med ASA er ikke længere en accepteret behandling, idet både VKAog NOAK-behandling er ASA overlegen i forhold til reduktion af apopleksi, og der kan forventes samme blødningsrisiko med ASA (23;26).
Hjerteklapproteser
Trombotiske komplikationer ved hjerteklapproteser omfatter dels systemiske embolier, oftest cerebrale, og dels klaptromboser, som kan medføre akut indsættende hjerteinsufficiens og pludselig død. Hjerteklapproteser inddeles i mekaniske og biologiske klapper. De mekaniske hjerteklapper kræver livslang antikoagulansbehandling med VKA, gerne som selvstyret AK-behandling (27). Ved mekaniske hjerteklapprotese i mitralposition suppleres VKA med ASA-behandling, hvilket også suppleres til VKA ved mekanisk aortaprotese hos patienter med tidligere emboli, atrieflimren eller anden øget embolirisiko (28). De biologiske hjerteklapper behandles med ASA, men VKA-behandling kan dog anvendes ved biologisk mitralprotese eller mitralplastik i 3 måneder. Perkutan aortaklapimplantation (TAVI) overvejes ved klinisk signifikant nativ aortastenose eller degeneret biologisk aortaklapprotese, og behandles med både ASA og clopidogrel i 3 måneder, hvorefter der fortsættes med monoterapi, oftest ASA. Alternativt til clopidogrel kan prasugrel eller ticagrelor anvendes. Ved anvendelse af Stentless biologisk klap (freestyle) er der ikke behov for antitrombotisk behandling.
Mekaniske hjerteklapproteser
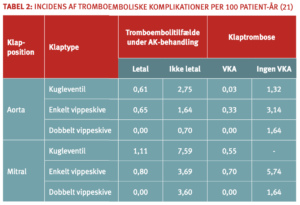
Hyppigheden af trombotiske komplikationer afhænger af klappens position og type (29;30). Embolirisikoen er over dobbelt så høj hos patienter med mitralklapprotese som hos patienter med aortaklapprotese, men incidensen af tromboemboliske tilfælde varierer betydeligt fra studie til studie (31;32).
Den teknologiske udvikling inden for produktionen af hjerteklapproteser har medført en væsentlig reduktion af embolirisikoen. Embolirisikoen er over dobbelt så høj hos patienter med ældre mekaniske klapproteser af typen Starr-Edwards kugleprotese som hos patienter med nyere mekaniske klapproteser med dobbelt vippeskive (fx St. Jude Medical og Carbomedics). Patienter med mekaniske klapproteser af typen enkelt vippeskive (fx BjörkShiley, Omnicarbon og Medtronic Hall) udgør en intermediær risikogruppe (Tabel 2). Langt de fleste mekaniske hjerteklapper, der implanteres i Danmark, er af den to-fligede type.
I en retrospektiv dansk undersøgelse af 694 voksne patienter, der fik foretaget aortaklapudskiftning med St Jude-klappen i årene 1980-1993 var kun 12% af dødsfaldene (0,6%/patientår) relateret til klappen (33). Incidensen af embolier var 1,18%/patientår, mens klaptrombose sås hos 2 patienter, der var ude af AK-behandling (0,04%/ patientår). Antikoagulansrelateret blødning forekom hos 2,24%/patientår.
I et nyere svensk prospektivt studie, hvor man i en observationsperiode på 10 år fulgte 400 patienter med indsat mekanisk aortaklap, fandtes en incidens af TE-tilfælde på 4,8%/ patientår og en antikoagulationsbetinget blødningsincidens på 8,5%/patientår (34).
Kombinationsterapi med ASA anbefales hos patienter med mekaniske mitralklapproteser, idet dette har vist sig at medføre en nedsat vaskulær mortalitet uden signifikant øget risiko for livstruende blødning. Hvis kombinationsbehandling med ASA og VKA skal anvendes til patienter med mekanisk aortaklapprotese, skal indikationen nøje overvejes i forhold til blødningsrisikoen.
I et randomiseret studie (RE-ALIGN) om mekanisk klapptotese er dabigatran-etexilat undersøgt over for warfarin, og der blev fundet en højere blødnings- og tromboserisiko for dabigatran-etexilat, hvorfor studiet blev afbrudt (35).
Biologiske hjerteklapproteser
Embolirisikoen efter indsættelse af en biologisk hjerteklapprotese, særligt i aortapostion, er lav (36;37). Dette er vigtigt i forhold til risikoen for blødning ved eventuel antitrombotisk behandling. Ofte vælges biologiske hjerteklapper netop til patienter, som har kontraindikationer for antikoagulerende behandling, eller hvor god kvalitet af VKA-behandlingen ikke kan forventes opnået, samt til ældre patienter (≥65 år) (38). Aortaposition: Embolirisikoen er lavest i aortaposition, og derfor kræver den biologiske aortaprotese, aorta-homograft og rørprotese ingen VKA-behandling, men blot antitrombotisk behandling med ASA 75 mg x 1 dagligt i 3 måneder, såfremt ingen anden indikation for VKA-behandling foreligger.
Mitralposition: Embolirisikoen er højst ved mitralklapposition (mitralprotese, mitralplastik), ca 5%, og højst de første 3 måneder efter operationen (32). I denne periode anbefales behandling med VKA (38). Tre måneder efter operationen ophører VKA-behandlingen, medmindre patienten har atrieflimren eller andre indikationer for fortsat VKA-behandling. Alternativt kan 3 måneders behandling med ASA 75 mg x 1 dagligt anvendes, såfremt der er kontraindikationer for VKA-behandling, eller patienten ikke ønsker VKA-behandling. De nye stentless biologiske klapper (Freestyle) kræver ingen opfølgende antitrombotisk behandling.
Stentklapper
Kateterbaseret klap (TAVI), som indsættes i aortaostiet ved svær stenose uden sternotomi og tilbydes patienter, som findes uegnet til konventionel operation på grund af betydende komorbiditet, glasaorta, høj alder eller tidligere hjertekirurgi (27). Den antitrombotiske behandling er omdiskuteret, men undersøges aktuelt. Der anbefales livslang ASA og i periode på 3-12 måneder clopidogrel eller alternativt prasugrel eller ticagrelor.
Venøs tromboembolisk sygdom (VTE)
Dyb venetrombose (DVT) opstår oftest i underekstremiteterne som følge af øget koagulationsaktivitet og langsomt venøst flow. Begge dele optræder i den per- og postoperative periode, og større kirurgi er da også en velkendt årsag til DVT og eventuel ledsagende lungeemboli (LE). Mindre venøse trombedannelser er ofte asymptomatiske og selvlimiterende. Almindeligvis giver venetromboser først symptomer, når de okkluderer venen. Der er derfor betydelig forskel på incidensen af symptomatisk DVT og billeddiagnostisk påvist DVT, der typisk ses ca 10 gange hyppigere. Tilsvarende er små LE ofte asymptomatiske og selvlimiterende.
Risikoen for postoperativ VTE er faldet gradvis i løbet af de seneste årtier i takt med indførelse af mere skånsom anæstesi og kirurgi og hurtigere mobilisering af patienterne (39;40). Da tromboseprofylakse i sin tid blev introduceret, var effektmålet at reducere forekomsten af DVT, som kunne påvises ved flebografi eller øget optagelse af radioaktivt fibrinogen. Erkendelsen af, at mange partielt okkluderende tromber svinder spontant, har ændret fokus til at begrænse brugen og varigheden af tromboseprofylakse til overvejende kun at omfatte patienter, hvor der skønnes at være en ikke ubetydelig risiko for symptomatisk VTE.
Tidligere VTE øger i betydelig grad risikoen for postoperativ VTE, især hvis det drejer sig om VTE inden for de seneste måneder. Risikoen for spontant recidiv af DVT ved ophør med antikoagulansbehandling efter 12 uger eller mere er ca. 15% pr.år (41). Ved ophør med behandling efter 6 uger er den initiale recidivrisiko ca. dobbelt så høj. Mangelfuld rekanalisering af tromboserede dybe vener i underekstremiteterne under antikoagulansbehandling er forbundet med øget risiko for recidiv ved behandlingsophør og øget risiko for udvikling af posttrombotisk syndrom (42). Patientens alder er en anden vigtig faktor, idet incidensen af VTE fordobles for hvert 10. leveår (40). Cancer er ledsaget af øget risiko for VTE. Det gælder især højmaligne former af pancreas- og ventrikelcancer samt maligne gliomer. VTE-risikoen er yderligere forøget i forbindelse med kemoterapi (43).
Ved trombofili forstås medfødte eller erhvervede hæmostaseforstyrrelser, der medfører øget koagulationsaktivitet og dermed øget risiko for tromboembolisk sygdom. De hyppigst forekommende af disse trombosedisponerende faktorer er forbundet med en så beskeden øget tromboserisiko, at de er uden praktisk betydning for vurderingen af postoperativ tromboserisiko. Det drejer sig om heterozygot faktor V Leiden mutation, protrombinvariant G20210A og blodtype non-0 (A, B eller AB). Trombofili, som skyldes mangel på de naturlige antikoagulantia antitrombin, protein C og protein S, er generelt forbundet med en højere VTE-risiko, men der er for hver af nævnte antikoagulantia beskrevet talrige mutationer, som har vidt forskellig indflydelse på den antikoagulante funktion. I de fleste tilfælde kan niveauet af den målte plasmaaktivitet af det defekte antikoagulans bruges ved vurdering af tromboserisikoen. En vigtig undtagelse er den type antitrombinmutationer, der medfører nedsat heparinbindingsevne. Det er den hyppigste form for antitrombinmangel, og disse mutationer har i modsætning til en række andre mutationer i antitrombin kun ringe betydning for VTE-risikoen. Ved arvelig trombofili bør oplysning om familiær forekomst af VTE bør indgå i vurderingen af patientens tromboserisiko.
Antifosfolipidantistoffer (APA) er fosfolipidbindende autoantistoffer, som ved kompleksdannelse med membranproteiner kan forårsage trombocytaggregation og endotelskade og derved forårsage trombose eller abort (antifosfolipidsyndrom: APS). APA kan påvises som lupusantikoagulans (LA), anticardiolipinantistoffer (ACA, IgG og IgM) og anti-β2 – glykoprotein-1 (anti-B2GP1, IgG og IgM). Af de tre analyser er LA bedst korreleret til tromboserisiko. Højest risiko ses ved positivt udfald af alle tre analyser (triple-positiv APA) (44).
D-dimer er en biomarkør for fibrindannelse og -nedbrydning. Normal D-dimer bruges ofte til at afkræfte mistanke om VTE. Forhøjet D-dimer kan have mange årsager, fx kirurgi/traume, VTE, cancer, infektion og høj alder (45). Flere undersøgelser tyder på, at forhøjet D-dimer kan anvendes prognostisk til vurdering af risikoen for postoperativ VTE (45-47). Et væsentligt problem er imidlertid, at D–dimer kan bestemmes med mange forskellige metoder, der giver vidt forskellige resultater.
Scoringssystemer
Der er udviklet en række scoringssystemer til vurdering af VTE-risiko hos patienter med akut medicinsk sygdom og onkologiske patienter i kemoterapi. Scoringssystemerne har ikke været anvendt på patienter, som får foretaget kirurgisk indgreb, men algoritmerne kan anvendes til at give et skøn over patienternes præoperative VTE-risiko.
På baggrund af data vedrørende 15.156 medicinske patienter i det amerikanskcanadiske registerstudie International Medical Prevention Registry on Venous Thromboembolism (IMPROVE) har man udarbejdet et scoringssystem til vurdering af VTErisiko (48). Scoringssystemet er siden blevet valideret i en anden stor undersøgelse (VTE-VALOURR), hvor der ved 41.486 indlæggelser af 28.744 patienter påvistes 1240 tilfælde af VTE (49). Scoringssystemet betegnes IMPROVE-VTE eller med det mnemotekniske akronym ImPACT-ILL (Im-mobilisation, Previous VTE, Age ›60 years, Cancer, known Thrombophilia, ICU/CCU stay, and Lower Limb paralysis) og omfatter følgende patientkarakteristika:
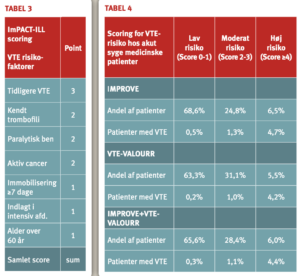
Med det betydelige antal undersøgte patienter og den gode overensstemmelse mellem resultaterne af IMPROVE og VTE-VALOURR må scoringssystemet betragtes som et vigtigt værktøj til at identificere patienter med høj VTE-risiko.
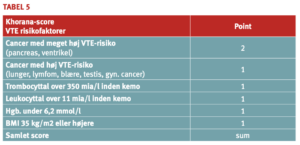
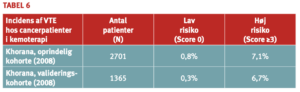
Hos cancerpatienter spiller typen af cancer og celletal i blodet en væsentlig rolle for VTE-risikoen. Khorana et al. har på baggrund af data fra 4.066 cancerpatienter, hvoraf 2,2% udviklede VTE, udarbejdet en algoritme til vurdering af patienternes tromboserisiko (50). Algoritmen blev udarbejdet på data fra 2/3 af patienterne og valideret på den sidste tredjedel. De opstillede følgende scoringssystem:
Der fandtes god overensstemmelse mellem resultaterne i deriveringskohorten og valideringskohorten:
Andre har i senere undersøgelser foreslået, at maligne gliomer skal medregnes til cancertyper med meget høj VTE-risiko, og det er endvidere foreslået, at behandling med cis-platin eler gemcitabin skal give et ekstra point (51-53). Nogle har anbefalet, at Ddimer indgår i vurderingen (46;51).

Procedurerelateret risiko for tromboemboliske komplikationer
Som nævnt vil større indgreb medføre en kraftig aktivering af det hæmostatiske system. Kirurgi, hvor man anbefaler tromboseprofylakse anses for at være høj risiko (eks. abdominalcancerkirurgi, ortopædkirurgiske indgreb på især hofte, pelvis eller underekstremiteter), mens Lav risiko er indgreb, hvor tromboseprofylakse normalt ikke anvendes (eks. ambulante mindre kirurgiske indgreb (‹1 times varighed) på mobile patienter (27).
Blødningsrisiko
Patientrelateret risiko for blødningskomplikationer
Klinisk vurdering af patienten
Blødningsrisikoen vurderes bedst ved indhentning af blødningsanamnese og objektiv undersøgelse af patienten. Ved anamnesen spørges til a) tidligere hud- og slimhindeblødninger, b) familiær anamnese, c) uventet blødning ved tidligere indgreb. Anamnese og objektiv undersøgelse kan ikke erstattes af screening for blødningstendens ved hjælp af koagulationsanalyser.
Blødningsanamnese
Spørg om:
» Familiær blødningstendens
» Spontane muskel- eller ledblødninger
» Abnorm tendens til ”blå mærker”
» Langvarig blødning fra sår
» Næseblod ›10 minutter trods kompression
» Menoragi førende til blodmangel
» Langvarig blødning efter tandekstraktion
» Langvarig blødning efter fødsel
» Påfaldende blødning efter kirurgi
» Forekomst af transfusionskrævende blødning
» Kendt lever- eller nyresygdom
» Blødning fra mave-tarmkanal
» Hæmaturi
» Pågående behandling med antitrombotiske midler
Objektiv undersøgelse
Undersøg for:
» Petekkier
» Purpura
» Tegn på muskel- eller ledblødning
» Anæmi eller andre tegn på blødning
» Hepatosplenomegali
Talrige undersøgelser har vist, at udbyttet ved præoperativ screening for blødningstendens ved bestemmelse af trombocyttal, APTT og INR er yderst ringe (54). Kun få procent af patienterne har abnorme analyseresultater, og afvigelserne fra referenceintervallet er oftest så ringe, at der ikke kan påvises korrelation mellem afvigelserne og hyppigheden af blødningskomplikationer.
Man kan indvende, at en screening, som kun omfatter trombocyttal, APTT og INR, er insufficient, da den fx. ikke vil kunne påvise blødningstendens, som skyldes nedsat trombocytfunktion. Indtil ca 1990 blev bestemmelse af kapillærblødningstiden anset for en vigtig analyse ved præoperativ screening for blødningstendens. Forlænget kapillærblødningstid var årsag til utallige præoperative trombocyttransfusioner, indtil man i løbet af 1990erne indså, at effekten af disse transfusioner ikke kunne dokumenteres videnskabeligt (55). Der er manglende korrelation mellem kapillærblødningstid og perioperativ blødning. Det anbefales, at screening med koagulationsanalyser kun foretages på patienter, hvor der anamnestisk eller objektivt findes mistanke om blødningstendens.
Hæmostasescreening og tolkning af analyseresultater
Hvis blødningsanamnese eller objektiv undersøgelse giver mistanke om øget blødningstendens, søges denne karakteriseret ved analyser til screening for hæmostaseforstyrrelser. Hæmostasescreening omfatter typisk bestemmelse af nogle eller alle af følgende analyser: B-Trombocytter, aktiveret partiel tromboplastintid (APTT), INR, og P-fibrinogen.
Tolkning af analyseresultater
» Svære forstyrrelser med påvirkning af samtlige parametre skyldes sædvanligvis enten fejl, fortynding eller forbrug. Resultatet kan være en fejl på grund af koageldannelse i blodprøveglasset. Fortynding ses hos multitransfunderede og efter ekstrakorporal cirkulation. Ukompenseret højt forbrug af hæmostasekomponenter ses ved dissemineret intravaskulær koagulation (DIC), herunder svær sepsis. Ved DIC vil der typisk være væsentlig forhøjelse af D-dimér og tegn på multiorgansvigt.
» Isoleret forlængelse af APTT kan skyldes heparinbehandling, men kan også skyldes medfødt mangel på en koagulationsfaktor (arvelig hæmofili) eller antistofdannelse mod en koagulationsfaktor (erhvervet hæmofili). Antistofdannelse ses sjældent, men kan være årsag til meget vanskeligt traktable blødninger. Ses fortrinsvis ved autoimmun sygdom, cancer og graviditet. Isoleret forlængelse af APTT kan også skyldes fosfolipidbindende antistoffer (lupusantikoagulans: LA). Patienter med LA har ikke blødningstendens, men derimod øget tromboserisiko. Uforklaret forlænget APTT bør konfereres med en koagulationsekspert. Terapeutiske doser af lavmolekylære hepariner, fondaparinux og NOAK medfører typisk let forlængelse af APTT.
» Forhøjet INR og APTT ses under behandling med VKA. Det samme ses ved leverdysfunktion, hvor der endvidere kan være nedsat antitrombin og eventuelt trombocytopeni. Dette kan også forekomme hos patienter i behandling med NOAK.
» Nedsat fibrinogen og forhøjet D-dimér kan være tegn på høj fibrinolyseaktivitet, som kan skyldes fibrinolysebehandling, større traume eller kirurgi inden for de seneste timer, dissekerende aortaaneurisme, placentaløsning eller en plasminogenaktivatorproducerende tumor. TEG/ROTEM kan anvendes til kvantitering af fibrinolyseaktiviteten.
» Isoleret trombocytopeni kan have talrige årsager. I den akutte fase er det vigtigt at få afklaret, om trombocytopenien er induceret af heparin eller anden medicin, som da straks bør seponeres, eller om trombocytopenien skyldes øget trombocytaggregation (ses ved DIC og trombotisk trombocytopenisk purpura (TTP)), hvor trombocyttransfusion helst skal undgås. Pseudotrombocytopeni kan ligeledes forekomme. Pseudotrombocytopeni er et in vitro fænomen. Trombocytterne agglutinerer in vitro i det EDTA-stabiliserede blod, men sjældent i citratblod, hvorfor man ved mistanke om psedotrombocytopeni bør bekræfte dette ved at gentage målingen i citratblod eller påvisning af trombocytaggregater ved mikroskopi af blodet. Trombocytopeni hos perioperativ patient bør konfereres med hæmatolog.
Overfor er nævnt de almindeligste årsager til hæmostaseforstyrrelser. Til de sjældne årsager hører de medfødte koagulopatier. Her er patienterne i langt de fleste tilfælde bekendt med diagnosen og tilknyttet et af de danske hæmofilicentre (Rigshospitalet eller Århus Universitetshospital).
Som nævnt i indledningen af afsnittet er blødningsanamnese vigtig, da normal hæmostasescreening ikke udelukker væsentlig blødningstendens. Påvisning af disse blødningstilstande kræver specialanalyser og /eller anvendelse af billeddiagnostiske metoder.
Øget blødningstendens trods normal hæmostasescreening
» Trombocytopatier (Glanzmann, Bernard-Soulier, mv) giver hud- og slimhindeblødninger i form af petekkier og ekkymoser. De medfødte trombocytopatier er sjældne. Ved svær uræmi ses ofte trombocytdysfunktion, som svinder efter dialyse. Langt de fleste tilfælde af trombocytopati skyldes behandling med trombocytfunktionshæmmende midler. Hvis der er normalt trombocyttal, og de kliniske symptomer tyder på trombocytopati, kan specifikke undersøgelser (bl.a. trombocytaggregationstest, TEG/ROTEM, immunhistokemiske undersøgelser og flowcytometriske undersøgelser) fastslå arten af trombocytopatien.
» Mild von Willebrand’s sygdom kan medføre blødningstendens, selv om almindelig hæmostasescreening er normal. I middelsvære og svære tilfælde er APTT forlænget på grund af nedsat faktor VIII. Ved mistanke om vWF-mangel kan specikke undersøgelser foretages i laboratorier på mange større hospitaler, og evt. behandling konfereres med de danske hæmofilicentre (Rigshospitalet eller Århus Universitetshospital, Skejby) Bemærk, at patienter med blodtype 0 gennemsnitlig har lavere vWF end patienter med blodtype A, B og AB.
» Vaskulære sygdomme som angiodysplasi og hereditær teleangiektasi kan være ledsaget af blødningstendens. Diagnosen stilles ved objektiv undersøgelse og billediagnostiske metoder.
» Ekstravaskulære sygdomme som Marfan’s syndrom, skørbug og primær amyloidose kan forårsage blødningstendens på grund af mangelfuld ekstravaskulær aktivering af hæmostasesystemet eller inaktivering af koagulationsfaktorer.
» Faktor XIII-mangel afsløres ikke ved hæmostasescreeningen, men er ekstremt sjælden (1 per 3 mio). FXIII-aktiviteten kan analyseres direkte.
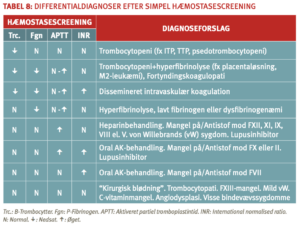
Kommentarer til skemaet
Ved dissemineret intravaskulær koagulation er fibrinogen ofte nedsat, men kan dog være normal. Ved VKA-behandling vil både APTT og INR sædvanligvis være øget. Ved behandling med NOAK kan APTT og INR være øget eller normale Lupusantikoagulans medfører ofte forlænget APTT, sjældent forhøjet INR og ikke blødningstendens, men derimod trombosetendens (44). APTT ikke forlænget ved mild von Willebrand’s sygdom, hvor FVIII kun er lidt nedsat. Ved sværere tilfælde med lav FVIII er APTT forlænget.
Hæmostasescreening med trombelastografi (TEG) eller trombolastometri (ROTEM)
TEG og ROTEM er navnene på to instrumenter, der benyttes som viskoelastiske hæmostase analyser (VHA). TEG/ROTEM er på mange måder ens og overensstemmende selv om normalværdier er forskellige, men i klinisk praksis anvendes oftest den ene eller den anden. Analyserne gennemføres på fuldblod, giver resultater inden for 10-15 min og er de foretrukne hæmostatiske analyser til transfusionsmedicinske behandling af blødende patienter. Når koagulationsprocessen begynder, dannes fibrinstrenge, der øger modstanden mellem pind og kop. Med tiltagende fibrindannelse og trombocytaggregation i koppen øges koaglets fasthed og dermed også modstanden mellem pind og kop. Apparatet måler de fysiske/viskoelastiske egenskaber, og resultatet registreres både som værdier og grafisk som en kurve, der beskriver koageldannelse og nebrydning (figur 3).
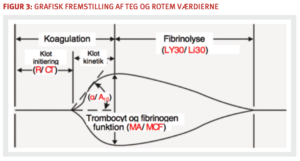
Koagulationsinitieringen (tiden til et koagel begynder at dannes målt ved de første fibrinstrenge) vurderes ved variablen R i TEG® (reaktionstid) henholdsvis CT i ROTEM® (clotting tid), koagelstyrkens hastighed ved Angle(α) henholdsvis A10, den maksimale koagelstyrke ved MA (maximum amplitude) henholdsvis MCF (maximum clot firmness), samt hvor hurtig koaglet opløses (LY30/Li30; hyperfibrinolyse efter 30 min).
VHA kan udføres patientnært, centralt i laboratorium eller blodbank eller decentralt med central overvågning, og har vist sig egnet ved blødning og transfusionsbehandling, hvor hurtigt analysesvar har stor betydning, og hvor anvendelse af plasma eller trombocytkoncentrat overvejes. TEG/ROTEM har vist at kunne reducere blødning, transfusionsbehov, komplikationer samt muligvis mortalitet i forskellige perioperative patienter. Derudover har VHA den fordel at de ved heparinase-analysen kan fjerne hepariner og vurdere fuldblodshæmostasen derunder. VHA metoden bør anvendes efter standardiserede protokoller og validerede algoritmer.
TEG/ROTEM kan betragtes som en fuldblodkoagulationstid, hvor man endvidere får oplysninger om koagelstyrken. Fuldblodskoagulationstid er på grund af høj analyseusikkerhed i dag erstattet af APTT. Ved TEG/ROTEM-analyse med tilsat koagulationsaktivator er ændringer i R og CT korreleret til ændringer i APTT. Parameteren Angle er korreleret til trombindannelseshastigheden. Langsom trombindannelse fører typisk til dannelse af et svagt koagel. MA og MCF er korreleret til fibrinogenkoncentration og trombocytfunktion. Nedsat MA og MCF kan således enten skyldes lavt fibrinogenniveau/funktion eller lavt trombocyttal/-funktion, og hvilken af de to kan bestemmes ved at supplere med fibrinogenanalyse (funktionel fibrinogen i TEG, FIBTEM i ROTEM) som blokerer trombocytternes funktion i koageldannelsen. LY30 og Li30 giver et mål for fibrinolyseaktiviteten og kan anvendes til påvisning af hyperfibrinolyse ved fx obstetriske katastrofer, hypo-/reperfusionsiskæmi og store traumer m.v.
Trombocytfunktionshæmmende lægemidler og TEG/ROTEM
MA og MCF kan i standardudførelse af TEG/ROTEM ikke anvendes til vurdering af effekten af trombocythæmmende lægemidler (fx acetylsalicylsyre eller ADP-receptorhæmmere (clopidogrel, prasugrel, ticagrelor)). TEG/ROTEM standardanalysen kan suppleres med en Platelet Mapping test, hvor man ved tilsætning af trombocytaggregationsagonister kan få en vurdering af trombocytfunktionen. Følsomheden for ADPreceptorhæmmere er dog relativt beskeden. Alternativt kan trombocytaggregationsmetoderne Multiplate Analyzer eller VerifyNow P2Y12 Assay anvendes (56).
Koagulationshæmmende lægemidler og TEG/ROTEM
R og CT tid er følsom for de fleste koagulationshæmmende lægemidler og medfører forlængelse, dog således at de ikke sikkert detekterer VKA-effekt (hvor INR er den bedste analyse). NOAK kan detekteres med TEG/ROTEM, således at dabigatran påvirker R og CT tid med forlængelse (57), og de orale faktor Xa-hæmmere påvirker ACT med forlængelse i rapid TEG analysen, som er en særlig TEG-analyse, der anvender en kombination af vævsfaktor og kaolin som aktivator (58). En normal TEG/ROTEM udelukker dog ikke tilstedeværelse af NOAK (59).
Procedurerelateret risiko for blødningskomplikationer
Den procedurerelaterede risiko for blødningskomplikationer afhænger af interventionens art. Høj blødningsrisiko må forudses ved akutte operationer, operation i rigt vaskulariseret væv, (re)operation i områder med talrige adhærencer og operation i svær hypotermi. Som eksempler på kirurgiske indgreb, hvor der må forventes høj blødningsrisiko, kan nævnes større canceroperationer, prostata- og blærekirurgi, rekonstruktiv plastikkirurgi, koronar bypass operation, hjerteklapoperationer, intrakranielle og rygkirurgiske indgreb, aortakirurgi, perifer arteriel kirurgi og større ortopædkirurgi. Her skal perioperativ antitrombotisk behandling administreres med forsigtighed. Det gælder også ved polypektomi i colon (særligt ved bredbasede polypper) og nyrebiopsi.

Prognose ved postoperative tromboemboliske og hæmoragiske komplikationer
Prognosen ved hæmostaserelaterede postoperative komplikationer afhænger i væsentlig grad af komplikationens art. Alvorligst er arterielle TE komplikationer, hvor risikoen for død eller varig invaliditet er omkring seks gange højere end ved venøse TE komplikationer (60). Større blødningskomplikationer kan kræve reoperation og forlænge det postoperative forløb, men fører sjældnere til død og varig invaliditet end TE komplikationer. Den postoperative blødning forsinker dog genoptagelsen af den antitrombotiske terapi, og udsætter derfor patienterne for en øget risiko for tromboemboli (6;11). Dette er især af betydning for patienter med iskæmisk hjertesygdom hvor talrige studier har bekræftet, at patienter med blødningskomplikationer har særlig høj mortalitetsrisiko. Stenttrombose er en alvorlig komplikation, der ofte præsenterer sig som STEMI og/eller pludselig død (61).

Generelle retningslinjer for regulering af antitrombotisk behandling ved invasive procedurer
Pausering og neutralisering af antitrombotiske midler inden invasive procedurer
Principperne for håndtering af antitrombotisk behandling i forbindelse med invasive procedurer er illustreret i tabel 9.

Selv om principperne er enkle, kan det i praksis være vanskeligt at klassificere en given patient i antitrombotisk behandling, bl. a. fordi indgrebets blødningsrisiko afhænger af typen af antitrombotisk behandling. Trombocythæmmende behandling kan fx medføre store problemer ved neurokirurgiske og plastikkirurgiske indgreb, hvor siveblødning fra sårflader kan være ødelæggende for resultatet, mens behandlingen medfører langt mindre problemer ved fx fjernelse af tarmpolypper. Ved antikoagulansbehandling anses intestinal polypektomi derimod for en højrisikoprocedure. Ved transbronkial biopsi er der omvendt kun intermediær blødningsrisiko ved antikoagulansbehandling, men særdeles høj blødningsrisiko ved trombocythæmmende behandling med clopidogrel, ticagrelor og presugrel. Disse forhold er beskrevet nærmere sidst i vejledningen og nævnes blot her for at påpege, at vurdering af blødningsrisikoen ved indgreb under antitrombotisk behandling kræver kendskab til både den basale blødningsrisiko ved indgrebet og den ændring i blødningsrisikoen, som forskellige antitrombotiske midler kan medføre.
Hos patienter med lav blodproprisiko er den nærliggende løsning blot at holde pause med den antitrombotiske behandling. Pausering af behandlingen vil altid medføre stigning i tromboserisikoen. Der er derfor behov for, at vi de kommende år skaffer os øget viden om hvilke indgreb, der kan udføres sikkert uden pausering af behandlingen.
Patienter med høj blodproprisiko udgør den største udfordring. Her er det i høj grad vigtigt, at få skabt klarhed over, hvilke indgreb der kan foretages under fortsat antitrombotisk behandling. Et særligt problem er indgreb med relativt høj blødningsrisiko på patienter med meget høj tromboserisiko. Det kan dreje sig om patienter med recidiverende tromboemboliske tilfælde, nylig tromboemboli eller nyligt indsat koronar stent. Hos disse patienter bør man typisk vælge at fortsætte den antitrombotiske behandling, men den endelige beslutning om nødvendigheden af indgrebet og håndtering af den antitrombotiske behandling bør træffes ved konference mellem lægerne, der skal foretage indgrebet, og lægerne, som er ansvarlig for den antitrombotiske behandling, samt eventuelt en koagulationsekspert. Hvis man beslutter at udføre indgrebet under fortsat behandling, er det vigtigt, at indgrebet foretages så skånsomt som muligt med omhyggelig hæmostase, eventuelt sikret ved anvendelse af topiske hæmostasemidler. Brug af systemiske hæmostasemidler bør undgås, da man herved øger tromboserisikoen.
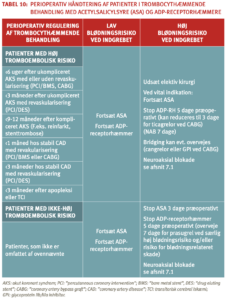
Hvis patienter med høj tromboserisiko skal have foretaget et indgreb, hvor høj blødningsrisiko nødvendiggør pausering af den antitrombotiske behandling, bør pausen være så kort som muligt og kun omfatte de midler, som væsentligt bidrager til blødningsrisikoen. Hos patienter, som får acetylsalicylsyre (ASA) og en ADP-receptorhæmmer til forebyggelse af arteriel trombose, kan man fx overveje kun at pausere ADP-receptorhæmmeren, da ASA ofte kun påvirker blødningsrisikoen beskedent (Tabel 10).
Pausering af trombocythæmmere ved invasive procedurer
Ved pausering i behandling med trombocythæmmere kan anvendes vanlig tromboseprofylakse i relation til det operative indlæg og fortsætte indtil hæmostasen er tilfredsstillende og behandlingen med trombocythæmmere kan genoptages (start vedligeholdelsesdosis). Pausen med trombocythæmmere forud for indgrebet varierer fra 3 dage for ASA til 7 dage for prasugrel (i relation til særlig høj blødningsrisiko) (Tabel 10). Hos patienter med særlig høj tromboserisiko kan i udvalgte tilfælde (CABG) overveje at anvende cangrelor eller GPI i pausen med ADP-receptorhæmmeren, men effekt og sikkerhed heraf er endnu utilstrækkelig dokumenteret (62;63). Anvendelse af lavmolekylært heparin (LMH) til bridging ved pause med trombocythæmmere er ikke indiceret (64).
Pausering af VKA ved invasive procedurer med og uden heparin-bridging
Når VKA-behandling afbrydes forud for et indgreb, stiger patientens risiko for tromboemboli (TE) gradvis til ubehandlet niveau i takt med, at den antikoagulante effekt svinder. I sidste halvdel af 1900-tallet var VKA eneste form for oral AK-behandling, og monitorering af behandlingen var langt mere usikker end i dag, hvor alle bruger INR. På grund af den usikre monitorering var det almindelig praksis at holde pause med VKA i fem dage eller mere inden kirurgi for at sikre god hæmostase ved indgrebet. Under den lange pause udviklede nogle patienter tromboemboliske komplikationer. Nogle steder begyndte man derfor at udfylde VKA-pausen med heparin, da det har en hurtigt indsættende virkning og også elimineres relativt hurtigt. I 1997 publicerede Kearon & Hirsh en statusartikel, hvor de ud fra beregnede risici for postoperativ TE og blødning anbefalede brug af heparin iv. eller sc. som ’heparin bridging’ (H-B) perioperativt under VKA-pause til patienter med høj tromboserisiko (65).
Idéen med H-B syntes indlysende rigtig, og heparin bridging er siden taget i brug i afdelinger verden over. Dette er sket, uden at der har foreligget randomiserede undersøgelser til belysning af effekt og sikkerhed ved H-B. Der er siden 2001 publiceret en række kohorteundersøgelser, og i 2012 publicerede Siegal et al. en meta-analyse af disse i alt 34 studier. Meta-analysen tydede på, at H-B medfører hyppigere blødningskomplikationer (66). Odds ratio for alle typer blødningskomplikationer ved H-B var 5,4 (95% CI 3,00-9,74) og for større blødningskomplikationer 3,6 (95% CI 1,27-4,08). TE forekom blandt bridgede patienter hos 0,9% (95% CI 0,0-3,45) og hos 0,6% (95% CI 0,0-1,2%) af ikke-bridgede patienter. Forfatterne konkluderede, at undersøgelserne ikke gav holdepunkt for, at en i forvejen lav risiko for TE blev yderligere reduceret ved anvendelse af H-B. Da H-B syntes at medføre en signifikant stigning i risikoen for perioperativ blødning, advarede forfatterne mod brug af H-B til patienter uden høj tromboserisiko, specielt H-B i terapeutisk dosering ved procedurer med høj blødningsrisiko. Siden meta-analysen er der publiceret resultater af andre observationelle studier, der støtter meta-analysens resultater.
I et retrospektivt kohortestudie sammenlignede Clark et al. incidensen af blødning og recidiv af venøs tromboemboli (VTE) hos 1178 VTE-patienter, der holdt pause med warfarinbehandling i forbindelse med invasive procedurer udført med og uden anvendelse af H-B (67). Dosering af heparin ved H-B er ikke specificeret. Klinisk relevant blødning inden for 30 dage efter indgrebet opstod hos 15/555 (2,7%) bridgede patienter og hos 2/1257 (0,2%) ikke-bridgede patienter (hazard ratio 17,2; 95%CI 3,9- 75,1). Der var ingen signifikant forskel på incidensen af recidiv af VTE (0% vs. 0,2%).
I det prospektive amerikanske registerstudie The Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF) har man undersøgt incidensen af TE og blødning hos 2200 patienter, som fik afbrudt warfarin-behandling i forbindelse med forskellige kirurgiske indgreb, bl.a. hjertekaterisation, ablation, endoskopi, hjertekirurgi, kirurgi, implantationer og tandindgreb (68). H-B i warfarin pausen blev givet i form af lavmolekylært heparin (73%), ufraktioneret heparin (15%) eller fondaparinux (1,1%) før, under eller efter den anvendte procedure. H-B blev foretaget hos 24% af patienterne. Hos bridgede patienter forekom der signifikant hyppigere blødning (5,0% versus 1,3%; justeret OR 3,84, 95% CI 2,07-7,14) og nominelt hyppigere tromboemboliske tilfælde (4,6% versus 2,5%; justeret OR 1,62, 95% CI 0,95-2,78). I RE-LY-studiet, hvor man i en prospektiv, randomiseret, åben undersøgelse sammenlignede effekten af warfarin og dabigatranetexilat ved non-valvulær atrieflimren, har man i en subgruppeanalyse opgjort hyppigheden af tromboemboliske og hæmoragiske komplikationer hos 1415 warfarinbehandlede patienter, der fik pauseret deres behandling i forbindelse med invasive procedurer (69). H-B blev foretaget hos 27% af patienterne med terapeutisk, intermediær eller profylaktisk dosis af LMH. Middel CHA2DS2-VASc score var i begge grupper 3,6. Middel HAS-BLED score var 1,4 i H-B-gruppen og 1,3 i gruppen, som ikke fik H-B. Patienterne, som fik H-B, havde både signifikant flere større blødningskomplikationer (Odds ratio 4,62, 95% CI 2,45-8,72) og flere TE tilfælde (Odds ratio 6,39, 95% CI 1,64-24,8).
Efter talrige observationelle studier kom så omsider i august 2015 resultaterne af den første randomiserede, placebokontrollerede, dobbeltblinde undersøgelse af effekt og sikkerhed ved H-B i forbindelse med perioperativ pause med warfarin: BRIDGE-studiet (5). 1884 patienter i VKA-behandling for atrieflimren blev ved perioperativ pausering af behandlingen randomiseret til bridging med dalteparin 100 IE/kg eller placebo givet subkutant 2 gange dgl. fra 3 dage før proceduren til 24 timer før proceduren og derefter i 5-10 dage efter proceduren. Patienter med mekanisk hjerteklapprotese eller tidligere apopleksi indgik ikke i studiet. Warfarin blev stoppet 5 dage før proceduren og genoptaget inden for 24 timer efter proceduren. Dalteparin eller placebo blev genoptaget inden for 24 timer efter indgreb med lav blødningsrisiko og 48-72 timer efter indgreb med høj blødningsrisiko. 69% af patienterne blev vurderet til at have lav risiko for blødning. Middel CHADS2-score var blandt bridgede patienter 2,4 ± 1,07 (SD) og blandt ikke-bridgede patienter 2,3 ± 1,03 (SD). De almindeligste indgreb var gastrointestinal (44%), cardiothorakal (17%) og ortopædisk (9%) kirurgi. Patienterne blev fulgt i 30-37 dage postoperativt. Resultaterne fremgår af tabel 11.

BRIDGE-studiet viser som de tidligere ikke-randomiserede undersøgelser, at H-B medfører en signifikant stigning i incidensen af blødningskomplikationer, uden at der opnås et fald i incidensen af tromboemboliske komplikationer. Der er derfor grund til at revurdere rationalet for H-B. Den øgede hyppighed af blødningskomplikationer kan være årsagen til, at der ikke opnår et fald i hyppigheden af trombomboliske komplikationer, men tværtimod en tendens til øget forekomst af TE, idet blødning ofte vil føre til, at al antikoagulant behandling afbrydes.
Risikoen for postoperative tromboemboliske komplikationer er faldet betydeligt i løbet af de sidste årtier. Det skyldes mange forhold, bl.a. bedre præoperativ forberedelse af patienten, mere skånsom anæstesi og kirurgi, anvendelse af tromboseprofylakse og hurtig mobilisering. Patienter i antikoagulansbehandling har ved seponering af deres behandling en højere risiko for TE end andre, og kirurgi kan øge risikoen yderligere. De foreliggende studier af H-B viser imidlertid, at TE-risikoen oftest kun er omkring 1% og dermed betydeligt lavere end risikoen for større blødningskomplikationer, hvis der anvendes H-B med terapeutisk dosering af ufraktioneret eller lavmolekylært heparin. H-B i terapeutisk dosering bør kun overvejes ved kirurgi på patienter med særlig høj risiko for TE, fx patienter med mitralklapprotese. Det er dog fortsat uvist, om man her vil opnå reduktion af TE-risikoen. Det igangværende randomiserede, placebokontrollerede studie PERIOP-2 (ClinicalTrials.gov Identifier: NCT00432796), som forventes afsluttet i 2017, vil forhåbentlig kunne give oplysninger herom. Indtil da må man mane til forsigtighed med anvendelse af H-B i terapeutisk dosering. Specielt er det vigtig at undgå høj plasmakoncentration af heparin tæt på tidspunktet for indgrebet, dvs. sidste præoperative dosis gives mindst 18-24 timer præoperativt, og postoperativt genoptages behandling tidligst 6-12 timer efter indgrebet og da med profylaksedosis. Først når der 2 eller flere dage postoperativt findes god hæmostase, optrappes dosis gradvis til terapeutisk dosering. H-B i terapeutisk dosering er de senere år anvendt i alt for stort omfang. Patienter med let til moderat øget risiko for TE bør kun have H-B i profylaksedosis postoperativt. Alternativt kan H-B helt undgås, hvis indgrebet foretages under opretholdt eller kortvarigt nedreguleret VKA-behandling. Et stigende antal undersøgelser viser, at selv større operationer kan foretages under opretholdt VKA-behandling, såfremt man sikrer, at INR ligger i passende niveau.
I kapitel 5 præsenteres retningslinjer for regulering af VKA-behandling ved forskellige indgreb og aktuelle retningslinjer for anvendelse af heparin-bridging.
Pausering af NOAK-behandling ved invasive procedurer
NOAK-behandling pauseres efter samme principper som for VKA med vurdering af tromboembolirisiko og blødningsrisiko ved indgreb, men der anvendes ikke ”heparinbridging” på grund af den relativt hurtige elimination af NOAK og hurtigt indsættende effekt ved genoptagelse af behandlingen.
Postoperativ dosering af antitrombotiske midler
Dosering af antitrombotiske midler er særlig kritisk fra operationsdøgnet til 2. postoperative dag, idet det er i denne periode de fleste blødningskomplikationer forekommer (70). Det er derfor specielt vigtigt i denne periode, at holde øje med dosis og administrationstidspunkter for ordinerede antitrombotiske midler, ligesom det er vigtigt at sikre tilstrækkelige intervaller mellem indgift af antitrombotiske midler og anlæggelse/fjernelse af epiduralkateter.
Doseringsplan for perioperativ regulering af antitrombotisk behandling
For alle patienter i antitrombotisk behandling bør der inden en invasiv procedure udarbejdes en plan for eventuel regulering af den antitrombotiske behandling før og efter indgrebet. Planen indføres i patientens journal
Behandling af perioperativ blødning hos patienter i antitrombotisk behandling
Akut, ukontrollabel blødning
Antitrombotisk behandling pauseres. Symptomatisk behandling i henhold til ABCprincippet. Ved hypovolæmi erstattes det tabte blodvolumen med balancerede blodkomponenter. Behandlingen iværksættes tidligst muligt (71;72).
» Voksne: – Erytrocytter: plasma : trombocytter i forholdet 3:3:1.
» Børn op til 40 kg: – 20 ml erytrocytter: 20 ml plasma : 10 ml trombocytter per kilo kropsvægt.
Find årsagen til blødningen (se afsnit 4.3) og stop blødningen, hvilket ofte vil kræve kirurgisk intervention. Søg rådgivning hos lokal blødnings-/koagulationsekspertise, men uden at forsinke den livreddende transfusionsbehandling. Monitorér hæmoglobin og hæmostaseparametre og overvej at reversere effekt af eventuelle antitrombotiske lægemidler ud fra svar på monitorering og rådgivning (se afsnit 4.4).
Kontrollabel blødning (blødning uden kredsløbssvigt)
Den antitrombotiske behandling pauseres under hensyntagen til den oprindelige indikation, og dennes tyngde. Ved alvorlig blødning overvejes muligheder for reversering. Find årsagen til blødningen og stop blødningen ved kompression, kirurgisk intervention eller evt. med reverserende midler eller topisk elle universelt virkende hæmostatika (se afsnit 4.5)
En eventuel transfusionstrategi afhænger af patientens kliniske tilstands samt hæmostasemonitoreringen. Anvend TEG/ROTEM som beskrevet ovenfor til monitoreringen af hæmostasen når transfusion af trombocytter og plasma overvejes. Følg op på interventionen og genovervej behandlingsstrategien i forhold til patientens kliniske tilstand og hæmostasemonitoreringen.
Behandling med SAG M (erytrocytkoncentrat) 1 portion overvejes ved individuel klinisk vurdering og/eller ved kliniske symptomer på anæmi hos indlagte kredsløbsstabile patienter når:
- Hæmoglobinkoncentration ‹4,3 mmol/l hos patienter uden hjertesygdom
- Hæmoglobinkoncentration ‹5,0 mmol/l hos patienter med kronisk hjertesygdom
- Hæmoglobinkoncentration ‹5,6 mmol/l hos patienter med akut koronart syndrom eller livstruende blødning.
Transfusion med plasma:
» Behandling i henhold til hæmostasemonitorering (se afsnit 4.4)
Ved vedvarende blødning hos voksne, hvor svar på hæmostasemonitorering ikke kan afventes, og hvor der klinisk vurderes at være en koagulationsdefekt, behandles voksne efter eksempelvis 4 SAGM med erytrocytter og plasma i forholdet 1:1.
Transfusion med trombocytkoncentrat (fra 4 donorer):
» Behandling i henhold til hæmostasemonitorering (se afsnit 4.4)
Ved vedvarende blødning hos voksne, hvor svar på hæmostasemonitorering ikke kan afventes, og hvor der klinisk vurderes at være en trombocytfunktionsdefekt, behandles voksne efter cirka 10 SAGM og plasma transfusioner med trombocytkoncentrat i forholdet, erytrocytter:plasma:trombocytter 5:5:1, indtil hæmostase opnås.
Blødningens årsag
1.Præoperativt eksisterende blødningstendens (tidligere problemer med blødning?)
2. Medikamentelt induceret blødning (har patienten nyligt fået antitrombotisk middel?)
3.Procedurerelateret blødning (blodfortynding, fx ved ekstrakorporal cirkulation?)
4.Traumatisk blødning (”kirurgisk blødning”? Blødning fra kontusioner?)
Ad 1. Mange patienter med mild von Willebrands sygdom, mild hæmofili eller mild trombocytopati accepterer deres lette blødningstendens og har aldrig søgt læge herfor. Ofte bliver blødningstendensen derfor først et reelt problem i forbindelse med en operation eller fødsel. Ved disse milde blødersygdomme vil behandling med desmopressin ofte kunne bringe blødningen i ro. Om muligt bør behandlingsplan lægges i samarbejde med et af landets hæmofilicentre før operation. Hvis dette ikke har været muligt, bør udredning og behandling konfereres med koagulationsekspert.
Ad 2. Behandling med antitrombotiske midler er en hyppig årsag til perioperativ blødning. Mistanke om medikamentelt induceret blødning kan som regel afklares ved gennemgang af patientens medicinforbrug de sidste dage. Enkelte NSAID-midler med lang halveringstid kan medføre trombocythæmning i op til 2 uger. Behandling med ADP-receptorhæmmerne clopidogrel, prasugrel og ticagrelor kan give svære blødningsproblemer ved akut, uopsættelig kirurgi. Effekten af hæmmerne kan ikke vurderes ved rutinemæssig hæmostasescreening eller trombelastografi, men kan påvises ved ADP-induceret trombocytaggregationsundersøgelse. Den kliniske værdi af trombocytaggregationsundersøgelser er dog uafklaret (73;74).
Livstruende blødning som følge af trombocythæmning kan forsøges behandlet med trombocytkoncentrat (2-4 stk hos voksne), desmopressin 0,3 µg/kg iv. over 20 minutter og tranexamsyre 30 mg/kg iv. som bolus over 5 minutter (75). Desmopressin kan gives 2 gange daglig, men den antidiuretiske effekt bør haves in mente, og hæmostatiske effekt består kun i få døgn. Ved alvorlig blødning kan man supplere med trombocytkoncentrat, men effekten er ringe, så længe trombocythæmmerne og aktive metabolitter findes i blodet (halveringstid for hovedmetabolitter af clopidogrel, prasugrel og ticagrelor: ca 8 timer).
Behandling af blødning i forbindelse med brug af antikoagulantia eller fibrinolytika er omtalt under de enkelte midler.
Ad 3. Blødning på grund af fortyndingskoagulopati kan ses ved ekstrakorporal cirkulation, eller hvis massiv blødning er behandlet med infusion af store mængder krystalloider og kolloider. Hvis standardbehandling med SAG M, FFP og trombocytkoncentrat har utilstrækkelig virkning på blødningen, bør der foretages hæmostasemonitorering med TEG/ROTEM eller konventionelle koagulationsanalyser, inklusive P-fibrinogen. Ved lavt P-fibrinogen gives fibrinogenkoncentrat eller cryopræcipitat (se afsnit 4.4).
Ad 4. Ved postoperativ blødning bør overvejes om der er tale om en generel hæmostasedefekt, eller en fortsat kirurgisk blødning. Der udføres hæmostasemonitorering (konventionelle laboratorieanalyser og/eller TEG/ROTEM) med henblik på målstyret behandling med blodkomponenter og hæmostatika med henblik på at normalisere hæmostasen og reducere blødning, samt støtte og fremskynde den kirurgiske kontrol af blødning. Blødning fra flere foci (operationssår, indstiksteder, hudblødninger el. lign.) taler for en generel hæmostasedefekt. Ved blødning isoleret fra et sted (fx operationssår) taler normal hæmostasescreening for, at det drejer sig om en kirurgisk blødning.
Hæmostasemonitorering
TEG/ROTEM benyttes efterhånden mange steder til hæmostasemonitorering ved kirurgisk eller traumeinduceret blødning (se afsnit 2.2.1.2). Den oplagte fordel ved TEG/ ROTEM er, at man hurtigt får et resultat, da analysen kan udføres patientnært og på fuldblod. Analysen kan give god vejledning i valg af blodkomponenter til patienter med stort transfusionsbehov på grund af svært blodtab.
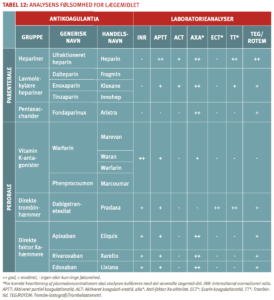
Til henholdvis detektion og monitorering af effekten af forskellige antikoagulantia anvendes én eller flere af følgende koagulationsanalyser:
» International normaliseret ratio (INR) ved VKA-behandling
» Aktiveret partiel tromboplastintid (APTT) ved heparininfusion
» Aktiveret koagulationstid (ACT), anvendes ved høje heparinkoncentrationer
» Anti-faktor Xa ved behandling med faktor Xa-hæmmere
» Ecarin koagulationstid (ECT) ved behandling med dabigatran-etexilat
» Trombintid (TT) ved behandling med dabigatran-etexilat, meget følsom for heparin.
Tabel 12 viser en oversigt over analysernes følsomhed for forskellige antikoagulantia.

Hæmostatika
Flere randomiserende studier samt metanalyse af studier har vist, at liberal transfusionsstrategi i modsætningen til en restriktiv strategi ikke har nogen gavnlig effekt, men tværtimod er forbundet med en øget risiko for blandt andet infektioner og en øget dødelighed (76-79). Der er derfor god patientsikkerhed i, at tænke sig godt om i forhold til patientens kliniske situation og afstemme transfusionstrategien for den individuelle patient i forhold til det aktuelle behov. At tænke langsigtet, og ikke kun på en her og nu situation i forhold til patientbehandlingen. I det følgende gives en supplerende oversigt over lægemidler, som også kan anvendes til reduktion af transfusionsbehov og den perioperativ blødning.
Midler til topisk anvendelse
» Gelatinesvamp (Spongostan®)
» Kollagenprodukter (TachoSil®)
» Oxycellulosegaze (Surgicel®)
» Adrenalongaze (Stryphnon®)
» Vævsklæber (Tisseel® Duo Quick, Evicel®, Quixil®)
Anvendelse af topiske midler til opnåelse af hæmostase bør altid overvejes hos patienter med kendt blødningstendens.
Desmopressin
Syntetisk vasopressinanalog, som via virkning på endotelcellerne øger koncentrationen af von Willebrand faktor og faktor VIII i blodet (80). Herved fremmes koagulation og trombocytfunktion. Bruges perioperativt hos patienter med mild von Willebrands sygdom og ved mild hæmofili. Desmopressin kan også reducere blødningstiden hos patienter med uræmi, levercirrose og trombocytfunktionsdefekter samt hos patienter i behandling med trombocythæmmende lægemidler. Da det virker væskeretinerende, bør det ikke anvendes til patienter med hjerteinsufficiens.
Dosering: Desmopressin gives enten parenteralt (0,3 µg/kg i.v) eller som næsespray (150 µg i hvert næsebor) (81), ofte forudgået af behandling med fibrinolysehæmmer (tranexamsyre). I løbet af 30-60 minutter stiger von Willebrand faktor og faktor VIII til 2-6 gange udgangsniveauet. Effekten holder sig i 8-12 timer. Effekten kan forlænges ved administration hver 12. time, men på grund af væskeretinering og risiko for hyponatriæmi bør behandlingen højest gives i 2 døgn medmindre diuretika behandling iværksættes.
Tranexamsyre
Tranexamsyre (Cyklokapron®) kan ved sin fibrinolysehæmmende virkning bidrage til stabilisering af dannede koagler. Akut behandling tranexamsyre nedsætter mortaliteten hos traumepatienter med blødning ledsaget af kredsløbssvigt (82). Det er endvidere vist, at tranexamsyre har en transfusionsbesparende effekt ved hjertekirurgi, levertransplantationskirurgi og hofte- og knækirurgi (83-85). Effekten er tydelig ved præoperativ administration af tranexamsyre, men noget tvivlsom ved behandling af postoperativ blødning. I årevis har der været mistanke om, at tranexamsyre øger risikoen for tromboemboliske komplikationer, men der findes ikke holdepunkter herfor i litteraturen. Tranexamsyre er et vigtigt hæmostatisk middel ved mundkirurgi og tandekstraktion, hvor midlet anvendes til mundskylning (86).
Dosering: Ved blødning gives inj tranexamsyre 10-30 mg/kg i.v. som bolus. En enkelt dosis kan være tilstrækkeligt, dog ses effekt af gentagen dosis eller infusion under indgreb som leverresektion og stor rygkirurgi Halveringstiden er ca 2 timer ved normal nyrefunktion. Hvis behandlingen videreføres, gives 10 mg/kg med 6-8 timers interval. (S-kreatinin 120-250 µmol/l: 12 timers interval. S-kreatinin 250-500 µmol/l: 24 timers interval). Til mundskylning anvendes en 5% opløsning. Munden skylles i 2-3 minutter forsigtigt, så dannede koagler ikke løsnes – med en blanding af 5 ml inj. tranexamsyre 100 mg/ ml og 5 ml vand 4-6 gange daglig i 2-3 dage.
Fibrinogenkoncentrat
Hypofibrinogenæmi kan ses hos patienter med livstruende blødning i forbindelse med svære traumer, kirurgi og post partum. Ofte er høj fibrinolyseaktivitet en medvirkende årsag til den lave fibrinogenkoncentration. Høj plasmakoncentration af fibrinnedbrydningsproduktet D-dimer (›4 mg/l) tyder på hyperfibrinolyse, og blødning bør da initialt behandles med tranexamsyre. TEG/ROTEM kan anvendes til specifik påvisning af hyperfibrinolyse. Til patienter med moderat blødning og P-fibrinogen ›3 µmol/l vil transfusion af friskfrosset plasma 15-30 ml/kg sædvanligvis kunne bringe blødningen til ophør. Ved svær blødning hos patienter med P-fibrinogen lavere end 3-5 µmol/l anbefales infusion af fibrinogenkoncentrat (Riastap) (87).
Dosis af fibrinogen kan udregnes efter følgende formel:
Dosis (mg) = [Målniveau (µmol/l) – Målt konc. (µmol/l)] x Legemsvægt (kg) x 20. Almindelig initialdosis til voksne er 2-4 gram fibrinogen i.v. Videre dosering bør konfereres med en koagulations-/blødningsekspert. Cryopræcipitat pool 2,5-5 ml/kg kan overvejes som erstatning for fibrinogenkoncentrat.
Protrombinkomplekskoncentrat
Protrombinkomplekskoncentrater (PCC) er plasmaderiverede koncentrater af vitamin K-afhængige koagulationsfaktorer. PCC anvendes til akut reversering af behandling med VKA. Anvendelsen af PCC er beskrevet i afsnit 5.1.2 om reversering af behandling med VKA. I Danmark anvendes Octaplex, som indeholder koagulationsfaktorerne II, VII, IX og X samt protein C og S i en ikke-aktiveret form.
Infusion af PCC i en dosis på 25-50 IE/kg kan i nogen grad reducere den antikoagulante virkning af de orale faktor Xa-hæmmere (88;89). Der foreligger dog endnu ikke studier, der dokumenterer den kliniske effekt heraf (90).
Aktiveret protrombinkomplekskoncentrat
Det aktiverede protrombinkomplekspræparat FEIBA® er et plasmaderiveret koncentrat af aktiverede vitamin K-afhængige koagulationsfaktorer. Den registrerede indikation er forebyggelse og behandling af blødning hos patienter med faktor VIII-inhibitor. Den anbefalede dosering er her 50-10 enh/kg legemsvægt med 12 timers interval. FEIBA® har været foreslået som antidot ved ukontrolleret NOAK-relateret blødning (91). Selv ved den foreslåede lavere dosis på 30-50 enh/kg må man dog forvente en uacceptabel høj tromboserisiko, når midlet anvendes til patienter med en i forvejen øget tromboserisiko. FEIBA® bør derfor ikke anvendes til behandling af NOAK-relateret blødning, før der foreligger flere undersøgelser af sikkerheden ved anvendelsen (specialistopgave).
Rekombinant faktor VIIa (rFVIIa)
Rekombinant faktor VIIa (NovoSeven®) blev oprindeligt lanceret til behandling af hæmofilipatienter, der har udviklet antistoffer mod faktor VIII eller IX. Her har behandlingen slående effekt og anvendes i dag rutinemæssigt.
Med rFVIIa er det muligt at opnå fibrindannelse uden medvirken af faktorerne i det interne koagulationssystem. Efter intravenøs injektion bindes rFVIIa til aktiverede trombocytter, hvor faktor X aktiveres, hvilket efterfølgende fører til dannelse af trombin og fibrin. Da aktiverede trombocytter i blodkarrene overvejende findes tæt på karskader, vil trombin- og fibrindannelse være koncentreret i områder med karskader. De senere år er der publiceret en række kasuistiske meddelelser, hvor rFVIIa har været anvendt ved behandling af massiv blødning i forbindelse med svære traumer, kirurgi, post partum blødning, leversvigt mv. Mange har berettet om mirakuløs hæmostatisk virkning, men de få foreliggende randomiserede undersøgelser har overvejende givet skuffende resultater (92). Der er desuden rapporteret øget risiko for tromboemboliske tilfælde ved anvendelse af rFVIIa uden for indikation, særligt hos ældre patienter (93). rFVIIa er et potent hæmostatisk middel, men indikationerne for dets anvendelse, ud over de oprindeligt registrerede, er endnu ikke afklarede, og den optimale dosering diskuteres fortsat.
Ved livstruende blødning, som ikke responderer på behandling med blodkomponentterapi, kan rFVIIa i særlige tilfælde (bør konfereres med en koagulationsekspert) anvendes i forsøg på at opnå hæmostase under forudsætning af, at P-fibrinogen er ›5 µmol/l og B-trombocytter er ›50 mia/l. Hvis ikke det er tilfældet, bør disse hæmostasekomponenter substitueres. Denne behandling ligger uden for produktets indikationsområde.
Dosering: Initialt gives rFVIIa 20-120 µg/kg. Plasmahalveringstiden er ca 3 timer. Doseringen og anvendelsen bør altid konfereres med en koagulationsekspert.
Rekombinant faktor VIII, Rekombinant faktor IX og von Willebrand faktor koncentrat
Anvendes i behandlingen af patienter med kendt blødersygdom. Specialistopgave.
Antitrombotiske midler
Vitamin-K-antagonister (VKA)
Tabel 13 viser en oversigt over antitrombotiske midler inddelt efter angrebspunkt i det hæmostatiske system. I apendiks sidst i rapporten gives en kort beskrivelse af de enkelte midler med fokus på:
» Blødningsrisiko ved anvendelse af midlerne i forbindelse med invasive procedurer
» Naturlig elimination og mulighed for fremskyndet neutralisering af effekten
» Rekommandationer for håndtering af behandling ved elektive og akutte procedurer


Risiko for blødningskomplikationer under behandling med VKA
Ved vitamin-K-antagonist behandlingen er der et snævert terapeutisk interval mellem den ønskede antitrombotiske effekt og potentiel alvorlig blødningskomplikation (figur 4). Aktivitetsbestemmelser af koagulationsfaktorerne II, VII og X er derfor nødvendig ved kontrol af antitrombotisk behandling med VKA. Virkningen af VKA på blodets koagulation, kan undersøges ved standardiseret protrombintidsbestemmelse (ÍNR).
Analysen protrombintid (PT) blev introduceret i 1930’erne, og baserer sig på en måling af, hvor mange sekunder citratplasma er om at koagulere efter tilsætning af vævstromboplastin og kalcium. I Skandinavien har man benyttet en modifikation af PT-metoden beskrevet af Owren (94), hvor PT bestemmes i overskud af faktor V og fibrinogen, sådan at analysen kun er følsom for ændringer faktorerne II, VII og X. Graden af antikoagulation blev målt som forlængelse af koagulationstiden udtrykt i % aktivitet eller fraktion aktivitet. Analysen var ikke standardiseret og resultatet var afhængig af forskellige analyseprincipper og metoder (95). For at forbedre disse forhold rekommanderede WHO indførelse af en international skala til vurdering af intensiteten af antitrombotisk behandling med VKA, den standardiserede PT-bestemmelse (International Normalized ratio (INR)) (96). INR er defineret som den protrombintids-ratio, man ville få, hvis WHO’s reference-tromboplastin havde været anvendt til bestemmelse af forholdet mellem patientens og normale personers gennemsnitlige protrombintid udtrykt i sekunder. INR-modellen standardiserer det protrombintidresultat, der opnås ved anvendelse af et lokalt tromboplastin og lokal metodik. INR beregnes således:
INR = (PT(patient) / PT(normal))ISI
ISI repræsenterer International Sensititvity Index og er et mål for et givet tromboplastins følsomhed for nedsættelse af aktiviteten af de K-vitamin-afhængige koagulationsfaktorer. De seneste års undersøgelser tyder på, at risikoen for blødning ved indgreb på patienter i behandling med VKA ikke er så høj, som tidligere antaget. Årsagen hertil er, at indførelse af INR til monitorering af behandlingen, har betydet, at man har fået et sikrere mål for blødningsrisikoen, og at man for patienter med hjerteklapproteser og patienter med lupusantikoagulans har nedreguleret det rekommanderede terapeutiske INR-niveau. Selv om AKbehandling har eksisteret i over 60 år, har vi altså først inden for de sidste 10-15 år haft god mulighed for at vurdere blødningsrisikoen ved forskellige behandlingsintensiteter.

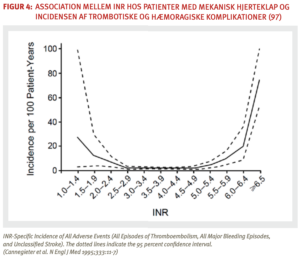
Flere undersøgelser viser, at blødningskomplikationerne ved VKA-behandling i høj grad påvirkes af intensiteten af VKA-behandlingen, tid i terapeutisk INR-niveau, specifikke patientkarakteristika, mulitfarmaci og interaktioner:
» INR 2 – 3 lavest risiko for komplikationer (trombose/blødning)
» Dramatisk stigning i blødningsrisiko ved INR ›4,5-5
» Fordoblet stigning i intrakraniel blødning for hver gang INR stiger med 1
» Variation i INR er associeret med en øget frekvens af blødninger uafhængig af mean INR
» Patientkarakteristika som øger blødningsrisikoen: Alder ≥75år, tidligere apopleksi og blødning, hypertension, cancer, påvirket nyrefunktion, anæmi
I et case-control-studie af Hylek et al. blev INR-niveau hos 121 patienter, der fik intrakraniel blødning under warfarinbehandling, sammenlignet med en kontrolgruppe af patienter i AK-behandling uden intrakraniel blødning (98). INR op til 4,0 var ikke forbundet med øget risiko for intracerebral blødning (odds ratio: 1,2. 95% konfidensinterval: 0,6-2,1) eller subdural blødning (odds ratio: 1,0. 95% konfidensinterval: 0,4-2,3). Ved INR ›4,0 var risikoen derimod klart øget: intracerebral blødning (odds ratio: 3,6. 95% konfidensinterval: 1,7-7,5), subdural blødning (odds ratio: 7,4. 95% konfidensinterval: 2,9-18,9).
I en anden amerikansk retrospektiv kohorteundersøgelse omfattende 928 patienter med 1332 blødningskomplikationer i løbet af 1950 patientår fandtes tilsvarende øget blødningsrisiko ved PT-ratio ›2,0 (svarende til INR ›4,0): odds ratio 3,0. 95% konfidensinterval: 1,9-4,7, men ingen øget blødningsrisiko ved PT-ratio svarende til INR ‹4,0: odds ratio 1,3. 95% konfidensinterval: 0,8-2,1 (99).
I den prospektive italienske kohorteundersøgelse ISCOAT, omfattende 2745 patienter i AK-behandling, blev der registreret 153 blødningskomplikationer: 5 letale (0,25 per 100 patientår), 23 major (1,1 per 100 patientår) og 125 minor (6,2 per 100 patientår) (100). Opgjort efter INR-niveau fandtes følgende hyppigheder af blødningskomplikationer per 100 patientår: INR ‹2,0: 7,7. INR 2,0-2,9: 4,8. INR 3,0-4,4: 9,5. INR 4,5-6,9: 40,5. INR ›7,0: 200. Undersøgelsen viser således, at AK-behandling kan medføre betydelig øget blødningsrisiko, men først ved INR ›4,5.
Cannegieter et al. publicerede i 1995 resultaterne af en opgørelse fra fire hollandske AK-klinikker vedrørende tromboemboliske og hæmoragiske komplikationer ved AKbehandling af patienter med mekaniske hjerteklapper (97). Opgørelsen omfattede 1608 patienter, som var fulgt i 6475 patientår. Intrakranielle og spinale blødninger forekom hos 36 patienter (0,57 per 100 patientår) og større ekstrakranielle blødninger sås hos 128 (2,1 per 100 patientår). Laveste hyppighed af komplikationer sås ved INR-værdier mellem 2,5 og 4,9 (se figur 4). Ved INR mellem 5,0 og 5,5 steg komplikationshyppigheden til 4,8 per 100 patientår, og ved INR ›6,5 til 75 per 100 patientår.
Segal et al. publicerede i 2000 en meta-analyse af randomiserede studier af effekt og sikkerhed ved brug af antitrombotiske midler hos patienter med atrieflimren (101). Warfarin (n = 1.204) var mere effektivt end placebo (n = 1.211) til at forhindre cerebrale embolier (Odds ratio: 0,30. 95% konfidensinterval: 0,19-0,48). Warfarin medførte tendens til øget blødning, men ingen signifikant stigning i incidensen af blødningskomplikationer: (Odds ratio: 1,90. 95% konfidensinterval: 0,89-4,24). Odds ratio for blødningskomplikationer varierede fra 1,0 (95% konfidensinterval: 0,25-4,07) i SPAF I undersøgelsen, hvor kun 5% af INR-målingerne lå over terapeutisk niveau, til 5,22 (95% konfidensinterval: 0,60-45) i CAFA studiet, hvor 17% af INR-målingerne var over terapeutisk niveau. Vægtet middeltal for incidens af cerebral emboli var blandt warfarinbehandlede 14 per 1.000 patientår og blandt placebobehandlede 44 per 1.000 patientår. Vægtet middeltal for incidens af blødningskomplikationer var blandt warfarinbehandlede 13 per 1.000 patientår og blandt placebobehandlede 7 per 1.000 patientår.
I Leiden Anticoagulation Clinic registrerede man i perioden 1994-98 57 blødningskomplikationer blandt 603 patienter, der havde fået foretaget invasive procedurer (70). Man havde inden intervention typisk stilet efter fald i INR til ‹2,0 under pauseret behandling, men mange patienter havde højere INR på interventionsdagen (spændvidde: 1,2-4,9, middel INR 2,2). Patienterne blev i nested case-control design sammenlignet med AK-patienter, som havde fået foretaget samme indgreb uden blødningskomplikation. Der fandtes ingen indflydelse af INR på hyppigheden af blødningskomplikationer hos patienterne, sandsynligvis fordi kun få patienter havde INR ›4,0.
Flere patientrelaterede forhold som tidligere blødning, tidligere apopleksi, anæmi, nyreinsufficiens, hypertension og høj alder er forbundet med en øget risiko for blødning ved VKA-behandling. I forhold til disse patientkarakteristika er den stærkeste prediktor for større blødning en tidligere blødningskomplikation (100;102-104).
Litteraturen giver ikke éntydige data om, hvorvidt høj alder er en risikofaktor for blødning ved VKA-behandling. Nogle studier har vist, at høj-kvalitets VKA-behandling til ældre patienter ikke medfører en øget risiko for blødning (105;106), men en nylig meta-analyse omfattende ›1900 patienter med AF fandt en fordoblet risiko for større blødning ved alder ›75 år (1,8 per 100 patientår ‹75 år, 3,2 per 100 patientår ›75 år). Disse data blev understøttet af resultaterne fra Torn et al fra ”Leiden Anticoagulation Clinic” hvor mere end 4200 patienter blev undersøgt, og hvor risikoen for blødning steg fra 1,5/100 patientår hos patienter ‹60 år til 4,2/100 patientår hos patienter › 80 år (70). Antallet af intrakranielle blødninger ser derudover også til at stige med stigende alder (98;107).
Der foreligger efterhånden omfattende dokumentation for, at en række forskellige indgreb kan foretages sikkert med INR i terapeutisk niveau (INR 2-3) (se tabel 11). Når man ved de fleste øvrige indgreb kræver subterapeutisk INR, må det skyldes videreførelse af restriktive holdninger fra tiden inden indførelse af INR. Dengang blev patienter i USA og andre steder, hvor man anvendte kaninhjernetromboplastin til bestemmelse af PT-ratio, behandlet til et PT-ratio-niveau på 2 svarende til INR på 4-5, og indgreb under aktiv behandling medførte derfor hyppigt blødningskomplikationer. Da der ved de fleste invasive procedurer endnu ikke er foretaget undersøgelse af sikkerheden ved udførelse af indgrebet under AK-behandling med INR i terapeutisk niveau, må det indtil videre anbefales, at stile mod subterapeutisk INR-niveau i forbindelse med indgrebet, men i betragtning af den manglende evidens for øget blødningsrisiko ved INR i terapeutisk niveau anses det for acceptabelt at foretage indgreb i terapeutisk INR-niveau, medmindre indgrebet er forbundet med kendt øget risiko for invaliderende eller letal blødning.
I forhold til akut operation har Torn et al vist, at blødningsrisikoen for patienter med INR-værdi ‹3,0 ikke er større end hos patienter, som ikke er i VKA-behandling (70). Det er også vigtigt at understrege, at blødning som oftest kan behandles, mens muligheden for ukompliceret udgang efter tromboemboli er betydeligt mindre.
Blødningsrisikoen ved invasive procedurer på patienter i AK-behandling kan inddeles i 3 klasser:
» Indgreb med lav risiko for blødningskomplikation
Herved forstås indgreb, hvor der er evidens for, at AK-behandling med INR i terapeutisk niveau ikke medfører øget blødning.
» Indgreb med høj risiko for blødningskomplikation eller med kendt øget risiko for invaliderende/livstruende blødning
Klassen omfatter neuroaksial blokade, dybe biopsier med grov kanyle, endoskopiske højrisikoprocedurer og operation i rigt vaskulariseret eller inflammeret væv.
» Indgreb med intermediær risiko for blødningskomplikation
er indgreb, som ikke falder ind under de to foran nævnte klasser
Indgreb med lav risiko for blødningskomplikationer
Kataraktoperation
Katz et al. registrerede i en prospektiv kohorteundersøgelse alle tilfælde af blødningskomplikationer og tromboemboliske komplikationer i forbindelse med 19.283 kataraktoperationer (108). 4% af patienterne var i behandling med warfarin og 24% fik acetylsalicylsyre. 72% af de warfarinbehandlede og 77% af de acetylsalicylsyrebehandlede patienter fik foretaget operation uden pausering af den antitrombotiske behandling. Hyppigheden af blødning var i alle grupperne ‹1% og uafhængig af om patienterne havde holdt pause med den antitrombotiske behandling.
Flere mindre undersøgelser har vist tilsvarende lav risiko for blødning ved kataraktoperation under AK-behandling i terapeutisk niveau (109-111), og en nyere større undersøgelse på 203 patienter fandt en risiko for blødning på 0% (0 ud af 203 patienter i terapeutisk VKA-behandling) (9).
Mundhulekirurgi og tandekstraktion
Der er efterhånden talrige undersøgelser, der viser, at tandekstraktion og mindre mundkirurgiske indgreb kan foretages uden pausering af AK-behandling (86;112- 121). Hæmostase kan i næsten alle tilfælde sikres ved brug af topiske midler, herunder brug af tamponer vædet med tranexamsyre eller mundskylning med en 5% tranexamsyreopløsning.
Kutan kirurgi
En mindre, prospektiv undersøgelse omhandlende kutan kirurgi på 32 patienter i trombocythæmmende og/eller antikoagulerende behandling med warfarin fandt, at der ikke var signifikant forskel i komplikationshyppigheden hos de patienter, som var i behandling med antitrombotika, og de patienter som ikke var i behandling (122). I en tidligere publiceret meta-analyse inkluderende 6 studier og 1373 patienter (472 i behandling med ASA, 122 i behanding med warfarin og 779 kontroller) blev det anført, at der fandtes en øget risiko for alvorlig komplikation (hæmatom, blødning som kompromitterer såret, blødning som kræver intervention) hos patienter i VKA-behandling sammenlignet med aspiringruppen (5,7% VKA-gruppen vs 1,3% aspirin-gruppen) (123). Hvis man vurderer de enkelte studier og sammenligner blødningskomplikationerne i VKA-gruppen med kontrolgruppen, som ingen antitrombotisk behandling fik, ses imidlertidig ingen forskel i to studier (124;125), flere blødninger i kontrolgruppen i et studie (126), flere alvorlige blødninger i et studie (5/21 vs 0/44 (127), og flere mindre blødningskomplikationer (12/47 vs 3/49) (128), i det sidste studie. I dette sidstnævnte studie fandtes 3 ud af 12 blødningskomplikationer ved INR ‹3,5 og 9 ud af de 12 blødningskomplikationer ved INR ≥3,5. I de øvrige studier er INR-værdierne i forbindelse med det invasive indgreb ikke angivet.
Tidligere har Alcalay et al. ved en gennemgang af 14 artikler om dermatologisk kirurgi på patienter i antitrombotisk behandling (129) fundet en øget blødningstendens ved hudkirurgi i en tyrkisk undersøgelse, men i de øvrige studier fandtes ingen øget blødningstendens hos patienter i AK-behandling. Forfatterne så også i deres egen kohorteundersøgelse, som omfattede 68 patienter i warfarinbehandling, ingen signifikant blødning i forbindelse med hudkirurgi.
Bunick et al har i en nylig publiceret oversigt vedrørende blødningskomplikationer i dermatologisk kirurgi (130). På baggrund af den tilgrundliggende evidens, og risikobenefit ratioen i forhold til kutan kirurgi, anbefaler de generelt, at såvel trombocythæmmere og VKA-behandling fortsættes i forbindelse med kutan kirurgi. De peger på, at behandling kun pauseres i de tilfælde, hvor ASA administreres som primær profylakse, NSAID som smertestillende og hos patienter, som er i VKA-behandling, hvor det kirurgiske indgreb er stort og komplekst. I sidstnævnte tilfælde dog primært for at sikre sig, at der ikke er tale om supraterapeutiske INR-værdier.
Pacemakerimplantation
I en undersøgelse omfattende 1025 konsekutive patienter, som fik implanteret pacemaker eller ICD-enhed, var 470 i aktiv AK-behandling (middel-INR 2,6; spændvidde 1,5-6,9), mens 555 patienter havde INR mellem 0,9 og 1,4 (middel-INR 1,1) (131). Der var ingen forskel på hyppigheden af blødningskomplikationer i de to grupper. Tilsvarende fandt Goldstein et al. blandt 150 patienter, der fik foretaget pacemakerimplantation, ikke højere incidens af blødningskomplikationer hos 37 patienter i aktiv AK-behandling end hos de øvrige patienter (132).
I en nyere undersøgelse af 459 konsekutive patienter i warfarin behandling fik 222 implanteret pacemaker eller en defibrillator under kontinuerlig AK-behandling (mean INR 2,57±0,49), 123 patienter fik foretaget implantation efter pause i AK behandlingen 3-5 dage (mean INR 1,33 ±0,20) og heparin-bridging (enoxaparin terapidoser) og 114 patienter fik foretaget implantation efter 3-5 dages pause i AK-behandling uden alternativ antikoagulerende terapi. Patienterne, som fortsatte med AK-behandlingen, havde en lavere incidens af hæmatomer i pacemakerlommen og et kortere hospitalsophold end de øvrige to grupper (133).
Hos høj-risikopatienter med mekaniske hjerteklapper fandtes øget risiko for hæmatomer i pacemakerlommen (131), når AK-behandling blev pauseret mindre end 3 dage før implantationen og blev kombineret med postoperativ anvendelse af LMH. Anvendelsen af ”dual therapy” med trombocythæmmere, og kombinationen af warfarin og trombocythæmmer ser ligeledes ud til at øge risikoen for hæmatom efter pacemaker implantation (134).
Et nyligt større studie af Birnie et al. inkluderede 681 patienter med en årlig TE-risiko ≥ 5%, og randomiserede til enten fortsat VKA-behandling eller heparin-bridging. Det primære endepunkt var signifikant hæmatom og fandtes i 3,5% (12 ud af 343) af patienterne i VKA-behandling og 16% (54 ud af 338) af patienterne i heparin-bridging (p‹0.001). Ingen forskel fandtes i TE-komplikationer (135). De lidt ældre internationale ACCP retningslinjer anbefalede tilbage i 2008 at pausere VKA-behandlingen kortvarigt før proceduren, men de nye studier (135-137) lægger op til at anbefale en fortsættelse af VKA-behandlingen hos patienter med årlig TE-risiko på ≥ 5%. Hos patienter med TErisiko ‹5% kan en kortvarig pause (3-4 dage uden heparin-bridging) før kirurgi overvejes, hvis man ikke ønsker at fortsætte VKA-behandlingen under proceduren (138).
Ledpunktur
De første prospektive studier af ledpunktur på 32 patienter i AK-behandling, hvor middel INR var 2,6 (spændvidde: 1,5-4,3), medførte ingen blødningskomplikationer (139;140). Det samme fandt Dunn og Turpie, da de undersøgte blødningskomplikationerne hos patienter i VKA-behandling i forbindelse med artroskopi (0 ud af 32 patienter) (9). Disse fund understøttes også af et nyligt retrospektivt studie på 514 antikoagulerede patienter. Ialt blev der gennemført 640 artrocenteser og ledinjektioner, 456 procedurer ved INR 2,0 eller højere, og 184 procedurer ved INR ‹2.0. Både tidlige og sene blødningskomplikationer blev registreret. Der forekom kun ét tilfælde af tidlig signifikant klinisk blødning i den antikoagulerede gruppe (141).
Knoglemarvsbiopsi
Der findes ingen undersøgelser af hyppigheden af blødningskomplikationer hos patienter, der får foretaget knoglemarvsbiopsi under aktiv AK-behandling. I Bain’s opgørelse af hyppigheden af komplikationer ved 19.332 knoglemarvsbiopsier i UK i 2002 var kun 1 af 14 patienter med blødningskomplikation i AK-behandling, mens man hos de øvrige patienter mistænkte defekt trombocytfunktion som udløsende eller medvirkende årsag til blødningen (142). Tre år senere blev resultaterne konfirmeret af Bain i et prospektivt studie (143).
I en spørgeskemaundersøgelse foretaget af The Australian Society on Thrombosis and Haemostasis og the Hematology Society of Australia and New Zealand svarede 13%, at de foretog biopsi uafhængig af INR-niveauet, mens 51% krævede, at INR ikke var over terapeutisk niveau (144).
Prostatabiopsi og -resektion
Chowdhury et al. har i en nylig prospektiv undersøgelse af patienter til prostatabiopsi (8-10 biopsier per patient) på mistanke om prostatakræft inkluderet 902 konsekutive patienter (145). Otte-og-tres patienter var i warfarin behandling, 216 i lav-dosis ASA og een patient var i kombinations behandling med ASA og warfarin behandling. De resterende 617 patienter fik ingen antitrombotisk behandling.
Der blev ikke konstateret alvorlige blødningskomplikationer i nogen af grupperne 10 dage efter interventionen, vurderet ud fra tilbageleverede spørgeskemaer. Der fandtes en lidt øget risiko for mindre blødninger i ASA-gruppen sammenlignet med de to andre grupper, men ingen øget blødningsrisiko under warfarin behandling sammenlignet med ingen antikoagulerende behandling. Kingston et al havde i 1995 udført en tilsvarende undersøgelse af 1022 patienter, som fik foretaget transrectal ultralydvejledt prostatabiopsi, og man fandt ingen øget blødning hos 49 patienter, som var i aktiv warfarinbehandling (146).
Transuretral laserablation af prostata blev foretaget på 20 warfarinbehandlede patienter (præoperativ INR, middel: 2,6, spændvidde:1,19-5,25). Tre patienter fik transfusionskrævende hæmaturi, men man konkluderede, at VKA-behandling kan opretholdes ved laserablation af prostata i modsætning til operativ TUR-P (146). Svaghederne ved de ovennævnte studier er ikke-randomiseret design, og at alvorlige og livstruende blødninger underkendes på grund af for få patienter i antikoagulerende behandling i studierne og underestimering af alvorlighedsgraden hos patienterne, måske særligt i warfaringruppen, som er vant til at leve med en lidt øget blødningstendens. På bagrund af svaghederne ved de foreliggende studier anbefaler det Canadiske selskab for urologi i 2010, at antikoagulerende behandling pauseres i forbindelse med prostatabiopsi. VKA 4-5 dage før indgreb og ASA, clopidogrel og ticlodipin 7-14 dage før biopsi (147). Chowdhury’s nyligt publicerede undersøgelse, som inkluderer mange biopsier per patient, understøtter dog de tidligere studier, og derfor finder vi, at der på nuværende tidspunkt er konsistente data, til fordel for prostatabiopsi under fortsat VKA-behandling. I forhold til ASA viser også seneste undersøgelse en let øget risiko for mindre blødning, og derfor kan 3 dages pause overvejes for de patienter hvor den TE-risiko er lav (‹5%). Erfaringer med clopidogrel, ticagrelor og prasugrel savnes, men de generelle erfaringer understøtter forventningerne om øget risiko for blødning, og derfor anbefales 5 dages pause forud for proceduren. For patienter med absolut indikation for trombocythæmmende behandling (bl.a. nyligt coronar-stentede patienter) anbefales fortsat behandling.
Endoskopiske lavrisikoprocedurer
Der foreligger få, mindre, prospektive, kontrollerede undersøgelser af blødningsrisikoen ved endoskopiske procedurer på patienter i antikoagulationsbehandling, som viser at fortsættelse af VKA behandling periendoskopisk er forbundet med lav blødningsrisiko (148), og at patienter i fortsat VKA-behandling havde en øget risiko for blødning ved polypektomi og sfinkterotomi (149;150). Forholdsreglerne er dog stadig i det væsentlige baseret på ekspertvurderinger (151). Der foreligger retningslinjer fra the American Society for Gastrointestinal Endoscopy og British Society of Gastorenterology. I disse skelner man mellem endoskopiske højrisiko- og lavrisikoprocedurer (152;153). Se endvidere kapitel 7.2.

Lavrisikoprocedurer kan foretages ved terapeutisk INR-niveau, mens højrisikoprocedurer kun bør udføres ved subterapeutisk INR-niveau.
Knæalloplastik i generel anæstesi
Flere studier har vist, at knæralloplastik kan udføres under opretholdt VKA-behandling med acceptabel blødningsrisiko (154-157). Simpson et al. fandt i en retrospektiv undersøgelse øget hyppighed af blødningskomplikationer ved knæalloplastik under opretholdt VKA-behandling, men en del af patienterne havde INR over terapeutisk niveau og nogle fik heparin-bridging (158). Hos patienter med patientrelateret øget blødningsrisiko bør knæalloplastik i generel anæstesi udføres ved subterapeutisk INR, men hos patienter med høj tromboserisiko og ingen blødningstilbøjelighed bør opretholdt VKA-behandling foretrækkes.
Andre indgreb
Patienter med AF blev i forbindelse med radiofrekvensablation randomiseret til heparin-bridging og pause med warfarin (N: 790) eller fortsat warfarinbehandling (N:794) (159). Der forekom 39 tromboemboliske tilfælde hos patienter, som pauserede warfarin, mod 2 tilfælde hos patienter i fortsat warfarinbehandling (odds ratio, 13; 95% CI: 3.1–55.6; P‹0.001).
Wallace et al. udførte 55 håndkirurgiske indgreb på patienter i VKA-behandling med INR ‹3,0 (160). To patienter fik mindre blødningskomplikationer uden sequelae.
Indgreb med høj risiko for blødningskomplikationer
Denne gruppe omfatter dels indgreb, hvor der erfaringsmæssigt hyppigt opstår blødning, herunder operationer i rigt vaskulariseret væv (fx thyreoidea, lever, milt, nyre, prostata), større canceroperationer (fx åben rectumkirurgi og operationer i inflammeret eller cikatricielt væv, reoperationer) og dels indgreb, som sjældent er ledsaget af blødningskomplikationer, men hvor blødning kan få meget alvorlige følger, fx neuroaksial blokade og endoskopiske højrisikoprocedurer. I begge tilfælde er der tale om patienter, hvor man må kræve nær normale hæmostaseforhold inden indgrebet.
Indgreb med intermediær risiko for blødningskomplikationer
Denne gruppe omfatter patienter, som ikke skønnes at have høj blødningsrisiko, men hvor der på den anden side ikke er evidens for, at blødningsrisikoen er lav.
Præoperativ pausering af AK-behandling med warfarin (Marevan®) ud fra estimeret blødningsrisiko
Tabel 15 giver en oversigt over retningslinjer for målværdi af INR ved forskellige invasive procedurer, hvor blødningsrisikoen ved indgrebene skønnes henholdsvis lav, intermediær og høj.
Warfarinpausens varighed afhænger af warfarindosis: Kortest pause gives til patienter, der får ›5 mg dgl. og længst pause til patienter, der får ‹5 mg dgl. Hos patienter, der får ‹2,5 mg warfarin dgl., og patienter, som får phenprocoumon (Marcoumar®), kan man vælge enten at holde længere pause (5-7 dage) eller undlade pause og give tabl. Menadion 5-10 mg 36 timer præoperativt.
Det skal bemærkes, at den præsenterede opdeling i lav, intermediær og høj blødningsrisiko i tabel 15 kun gælder for indgreb foretaget i forbindelse med VKA-behandling. De nævnte indgreb kan have højere eller lavere blødningsrisiko, når de foretages i forbindelse med behandling med trombocythæmmere eller anden antitrombotisk behandling.
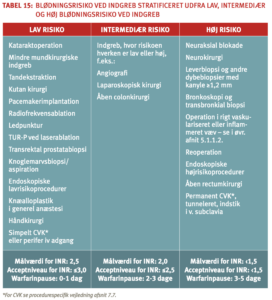

Reversering af behandling med vitamin K-antagonister (VKA)
Der er følgende muligheder for reversering af VKA-behandling:

1. Seponering/pausering af VKA
Ved planlagte invasive procedurer med høj blødningsrisiko pauseres VKA-behandling i nogle dage, så INR kan falde til acceptabelt niveau. Af hensyn til patientens tromboserisiko under pausen bør denne være så kort som muligt. Pausens længde afhænger af:
a. Det anvendte VKA-middel (Marcoumar® kræver ca. 3 gange længere pause end Marevan®)
b. Dosis af VKA-middel (lav dosis kræver længere pause end høj dosis)
c. INR ved indledning af pausen
d. Ønsket INR-niveau efter pausen
Ved INR i terapeutisk niveau og middel dosis af Marevan® (ca. 5 mg dgl.) kræves 3-4 dages pause for at få INR ‹1,5.
2. Indgift af vitamin K
Indgift af milligramdoser af vitamin K vil altid føre til dannelse af funktionsdygtige vitamin K-afhængige faktorer, uanset om behandling med VKA pauseres eller ej (161). VKA hindrer ikke effekten af vitamin K, men hæmmer resyntesen af vitamin K i vitamin K-cyklus. Begyndende effekt af vitamin K ses 4-6 timer efter i.v. injektion og 6-8 timer efter oral administration (162). Fuld effekt indtræder først ca. 36 timer efter i.v. eller oral indgift. Til reversering af VKA-behandling i få dage gives 2-5 mg vitamin K. Hvis der ønskes længerevarende neutralisering af behandlingen gives 10 mg. Højere doser af vitamin K giver ikke hurtigere effekt, men vil medføre, at der går over en uge, inden det igen vil være muligt at opnå virkning af VKA.
3. Frisk-frosset plasma (FFP)
FFP indeholder alle de vitamin K-afhængige koagulationsfaktorer og kan således anvendes til relativt hurtig reversering af VKA-behandling. FFP har i mange år været det foretrukne middel til reversering af VKA-behandling ved akut kirurgi, og denne indikation er i USA den almindeligste årsag til brug af FFP (163). Behandling med FFP er dog forbundet med forskellige problemer:
a. Reversering af VKA-behandling kræver et stort volumen FFP (20-30 ml/kg)
b. Behandling kan først gives, når FFP er bestilt og optøet i blodbanken
c. Koncentrationen af vitamin K-afhængige faktorer i FFP kan være lavere end forventet
d. FFP er ikke virusinaktiveret, medmindre man vælger kommercielt produkt (Octaplas LG®)
e. FFP kan medføre immunmedierede komplikationer (fx TRALI)
FFP har stadig en plads i behandlingen af blødende VKA-patienter med stort blodtab. Disse patienter har brug for både volumen og koagulationsfaktorer. Men til VKA-patienter med kritisk blødning uden stort blodtab, fx intrakraniel blødning, bør behandling med faktorkoncentrat foretrækkes, da brug heraf ikke er forbundet med ovennævnte problemer.
4. Protrombinkomplekskoncentrater (PCC)
PCC indeholder et koncentrat af alle de vitamin K-afhængige koagulationsfaktorer og kan således principielt betragtes som ideelle midler til reversering af VKA-behandling. Man har tidligere været tilbageholdende med anvendelse af PCC, primært på grund af risiko for overførsel af virusinfektioner, men også på grund af risiko for tromboemboliske komplikationer. Med de seneste årtiers udvikling af virusinaktiveringsmetoder kan brug af PCC nu anses for at være sikrere end brug af FFP, og skånsomme fraktioneringsmetoder har gjort det muligt at fremstille PCC uden måleligt indhold af aktiverede koagulationsfaktorer. En undersøgelse af PCC-midlet Octaplex®, som er markedsført i Danmark til reversering af VKA-behandling, viste således, at Octaplex® i modsætning til to andre PCC-midler ikke indeholdt målelige mængder af aktiveringspeptidet protrombinfragment 1.2 (164). Med Octaplex® kan man hurtigt og effektivt neutralisere den antikoagulerende virkning af VKA (165). Dette kan have afgørende betydning hos fx VKA-patienter med intracerebral blødning eller ved akutte invasive procedurer på patienter med høj INR. Da prisen for behandling med Octaplex® er i størrelsesordenen 10.000 kr, bør behandlingen reserveres til patienter med alvorlig blødning på grund af mangel på vitamin K-afhængige koagulationsfaktorer.
Octaplex® leveres i hætteglas med 500 IE faktor IX og omtrent samme indhold af de øvrige vitamin K-afhængige faktorer (det nøjagtige indhold er angivet på pakningen). Indholdet opløses hurtigt i de 20 ml medfølgende solvens og er herefter klar til i.v. injektion. Octaplex® bør som andre plasmaprodukter gives langsomt i.v. (1 ml/min) de første minutter under observation for eventuelle, sjældne overfølsomhedsreaktioner. Injektionshastigheden kan gradvis øges til 5-10 ml/min, hvis der ikke kommer pulsstigning eller andre tegn på intolerans.
Dosis af Octaplex® afhænger af den ønskede stigning i de vitamin K-afhængige faktorer. Ved behandling af livstruende blødning hos VKA-patienter bør man stile efter at øge faktorniveauet til 100%. Ved akut kirurgi på VKA-patienter vil en øgning af faktorniveauet til ›50% i reglen være tilstrækkeligt. Injektion af 1 IE/kg medfører en ca 2% stigning i plasmakoncentrationen af de vitamin K-afhængige faktorer. Da effekten af VKA-behandling angives INR-enheder, er det ikke umiddelbart indlysende, hvor meget Octaplex®, der skal gives for at reversere VKA-behandlingen. INR kan dog i dag ret præcist omregnes til faktorkoncentrationer, da man ved analysen efterhånden alle steder anvender højsensitivt tromboplastin (ISI-værdi tæt på 1,0).
Tabel 17 nedenfor viser den omtrentlige sammenhæng mellem INR og F(II+VII+X) under forudsætning af at der ved analysen er anvendt tromboplastin med ISI på 0,9-1,1:
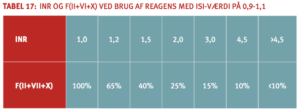
5. Doseringseksempel
Laparotomi for akut abdomen på en VKA-patient, der vejer 60 kg og har en INR på 5,5. Ønsket faktorniveau: ≥65%. Aktuelt faktorniveau: skønsmæssigt 5%.
Octaplex®-dosis = ([Ønsket faktorniveau i %] – [Aktuelt faktorniveau i %]) x Legemsvægt x 0,5
Octaplex®-dosis = (65 – 5) x 60 x 0,5 = 1800 IE
Der gives 4 pakker Octaplex® (2000 IE). Samtidig gives 5-10 mg fytomenadion i.v. for at undgå rebound-effekt af VKA under eliminationen af Octaplex® (166).
Når VKA-behandlingen genoptages postoperativt, bør det ske med patientens vanlige vedligeholdelsesdosis. Man kan da forvente, at INR vil stige til terapeutisk niveau i løbet af ca. 1 uge. Stigningen i INR kan være forsinket nogle dage på grund af den præoperative dosis af vitamin K. Der gives lavmolekylært heparin som tromboseprofylakse, indtil INR er terapeutisk niveau.
Tabel 18 herunder viser udregnede eksempler på dosering af Octaplex® ved reversering af VKA-behandling.
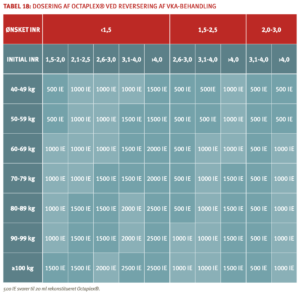
Heparin-bridging, hvornår og hvordan
Principperne for heparin-bridging er gennemgået i afsnit 3.3, hvor det bl.a. fremgår, at de senere års udbredte brug af heparin-bridging har ført til en stigende hyppighed af perioperative blødninger, uden at man samtidig har set et fald i tromboemboliske komplikationer. De foreliggende undersøgelser har overvejende inkluderet patienter med ikke-høj tromboserisiko, og et fald i en i forvejen lav incidens af tromboemboliske komplikationer har derfor heller ikke kunnet forventes. Det må stadig forventes, at der er en nettogevinst ved brug heparin-bridging til patienter med høj tromboserisiko, men de hyppige blødningskomplikationer viser, at der bør udvises stor forsigtighed med heparindosering tæt på tidspunktet for indgreb. Specielt er det vigtigt med en lang, individualiseret ”trap-op”-periode efter ingrebet, hvor heparindosis ikke øges, før der er god sikkerhed for, at der er opnået holdbar hæmostase.
Tabel 19 viser en oversigt over anvendelse af heparin-bridging perioperativt hos patienter i VKA-behandling. Heparin-bridging anvendes kun i de tilfælde, hvor det af hensyn til blødningsrisikoen er nødvendigt at ophæve virkningen af VKA-behandlingen. Heparin-bridging med LMH i 75-100% terapeutisk dosering gives kun til patienter med høj tromboserisiko. Præoperativ behandling med LMH stoppes 18-24 timer præoperativt, ved indgreb i neuroaksial blokade dog mindst 24 timer præoperativt. Postoperativt genoptages behandlingen tidligst 6 timer efter indgrebet med LMH i profylaksedosis. Der fortsættes med profylaksedosis i mindst 2 dage, hvorefter dosis optrappes gradvist til terapeutisk niveau under iagttagelse af tegn på blødningskomplikationer. Hos patienter, hvor den perorale VKA-behandling ikke kan genoptages, fx. ved ventrikelsonde eller hos patienter, som postoperativt har paralyse af tarmen, fortsættes behandlingen med LMH i terapidoser (hvis indikationen ræver dette), indtil den perorale medicinering kan genoptages.
Patienter med ikke-høj tromboserisiko skal kun have LMH i profylaksedosis postoperativt, hvis tromboserisikoen ved indgrebet indicerer dette. For begge grupper gælder, at VKA kan genoptages i operationsdøgnet med patientens sædvanlige dosis.

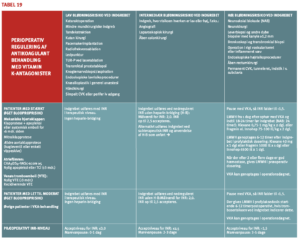
Retningslinjer for regulering af antitrombotisk behandling
Elektive invasive procedure


Akutte invasive procedurer
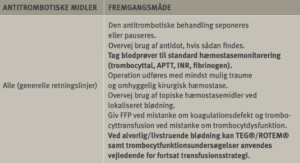
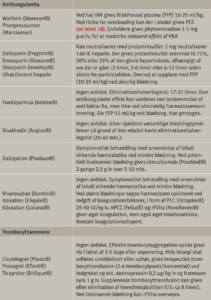

Perioperativ dosering af NOAK
Inden operationen tages stilling til varigheden af præoperativ pausering af NOAK vurderet ud fra eGFR og skønnet blødningsrisiko ved indgrebet. Ved VKA-behandling er det dokumenteret, at små indgreb med lav blødningsrisiko kan udføres under opretholdt VKA-behandling. Erfaringerne med præoperativ nedregulering af dosis af NOAK er endnu begrænsede. Derfor anbefales der mindst 1 døgns præoperativ pause. Ved indgreb, hvor blødningsrisikoen skønnes høj, pauseres NOAK i ca. 5 halveringstider forud for indgrebet. Hvis risikoen for blødningskomplikation skønnes lav, kan indgrebet udføres efter pausering af NOAK i 2-3 halveringstider (se tabel 20).
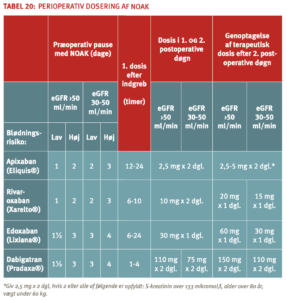
Efter indgrebet genoptages NOAK efter nogle timer. Hos NOAK-behandlede patienter, som post-operativt ikke er i stand til at indtage tabletter, kan antikoagulerende behandling med LMH anvendes, indtil behandling per oralt kan genoptages.
I de ortopædkirurgiske studier af NOAK blev første dosis givet i tidsintervallerne som vist i tabel 20. I de første postoperative døgn gives profylaksedosis svarende til doserne, der er anvendt ved knæ- og hoftealloplastik. Hos patienter, som præoperativt fik terapeutisk dosis, øges dosis efter 2. postoperative døgn eller senere, når sikker hæmostase er opnået. Ved udførelse af procedurer med særlig høj risiko for blødning eller ved postoperativ blødning bør det overvejes at udskyde genoptagelsen af den antikoagulerende behandling til mere end 24-48 timer postoperativt. I disse tilfælde er det vigtigt at vurdere patientens risiko for trombose. Er der tale om en patient med høj risiko for trombose, skal dette tages med ind i beslutningen om udskydelse og argumentationen dokumenteres.
Reversering af NOAK
Patienter, som accidentielt eller i suicidal øjemed har indtaget store mængder NOAK inden for de sidste 4 timer, kan behandles med oral indgift af en suspension af 50 g aktivt kul til voksne og 1 g/kg til børn. Aktivt kul bør ikke gives til patienter med gastrointestinal blødning.
Dabigatran kan eventuelt fjernes ved dialyse, men den praktiske værdi heraf er omdiskuteret. De orale FXa-hæmmere er kraftigt proteinbundne og kan derfor ikke dialyseres bort.
Reversering af dabigatran
Dabigatran-antidoten idarucizumab (Praxbind®) er aktuelt den eneste specifikke NOAK-antidot. Idarucizumab er Fab-fragment af et humaniseret monoklonalt antistof, som selektivt inaktiverer dabigatran og er uden virkning på andre antikoagulantia (167). Interim analyse af RE-VERSE AD (www.clinicaltrials.gov NCT02104947) omfattede 90 dabigatranbehandlede patienter, hvoraf 39 skulle have foretaget uopsætteligt kirurgisk indgreb og 51 blev behandlet for alvorlig blødning (168). RE-VERSE AD er et kohortestudie uden planlagt kontrolgruppe, og interim analysen viste, at idarucizumab 5 g i.v. reverserede forlængede koagulationstider i løbet af få minutter hos 88-98% af patienterne, med effekt i mindst 12 timer og blødningskontrol opnåedes indenfor 12 timer. Ved kirurgiske indgreb blev det vurderet, at 33/36 (92%) af patienterne havde normal hæmostase. 5 patienter (5,6%) fik tromboemboliske komplikationer, og 18/90 patienter (20%) døde (168).
De registrerende indikationer for brug af Idarucizumab er:
» Anvendelse til akut kirurgi/akutte uopsættelige procedure
» Livstruende eller ukontrollerede blødninger
Indtil flere studier og mere erfaring haves, skal Idarucizumab anvendes med forsigtighed og udelukkende til patienter med livstruende blødning. Behandlingen må betragtes som en specialistopgave og rådgivning herfra skal søges, da fuld reversering indebærer øget risiko for tromboemboliske komplikationer. Genoptagelse af koagulationshæmmende behandling har høj prioritet.
Reversering af orale faktor Xa-hæmmere
Specifikke antidoter mod de orale faktor Xa-hæmmere er endnu ikke tilgængelige. Blødning under behandling med orale faktor Xa-hæmmere behandles primært med traditionelle midler, dvs kompression, topisk virkende hæmostatika og balanceret blodkomponentterapi, jvf Sundhedsstyrelsens retningslinjer ved moderat kontrollabel blødning. Ved ukontrolleret, eventuelt livstruende blødning gives PCC (Octaplex®) 50 IE/kg. Det er vist, at denne dosis kan normalisere blodtabet fra en hudstasebiopsi hos personer, der har fået edoxaban i terapeutisk dosis (89). Da infusion af PCC medfører stigning i faktorerne II, VII og IX til supranormalt niveau, kan behandlingen være forbundet med stigende tromboserisiko i takt med, at faktor Xa-hæmmeren elimineres. Grandhi et al. gav PCC til 18 patienter, der havde fået intrakraniel bledning under behandling med rivaroxaban eller apixaban (169). Der fandtes god effekt hos 6 patienter, men 6 patienter døde, og 1 fik lungeemboli. I et retrospektivt studie af Beynon et al. omfattende 55 patienter med intrakraniel blødning under behandling med NOAK, fandtes ingen sikker hæmostatisk effekt af PCC-infusion (90).
Andexanet alfa er modificeret faktor Xa, der har højere affinitet til faktor Xa-hæmmere end naturligt faktor Xa, og som er uden prokoagulant virkning. Andexanet alfa er under klinisk afprøvning som antidot mod faktor Xa-hæmmere (170). Flere andre midler er under afprøvning som antidot mod faktor Xa-hæmmere; for nærmere information se (171).

Procedurespecifikke vejledninger
I de foregående kapitler er der givet generelle retningslinjer for håndtering af antitrombotisk behandling i forbindelse med invasive procedurer, og retningslinjerne er resumeret i 6.1 – 6.3.
Ved visse indgreb kan der foreligge særlige omstændigheder, som gør det ønskeligt, at der udarbejdes specifikke retningslinjer for den/de pågældende indgreb.
» Neuraksial blokade
» Gastrointestinal endoskopi
» Elektiv bronkoskopi og transbronkial biopsi
» Billeddiagnostiske interventioner
» Neurokirurgiske indgreb
» Lumbalpunktur
» Centrale venekatetre
Neuraksial blokade
Indikation for neuroaxial blokade (NAB)
Udførelse af NAB bør altid være baseret på en individuel vurdering af indikationen og risikoen for komplikationer, herunder spinalt hæmatom (SH). Nærværende vejledning beskriver retningslinjer for, hvor forsigtighed skal udvises. Generelt skal disse retningslinjer følges. I særlige tilfælde kan NAB udføres på tungtvejende indikation på baggrund af forventet bedre risikoprofil i forhold til morbiditet og mortalitet. Dette gælder i forhold til f.eks. forventet luftvejsvurdering, konkurrerende lidelser og smertedækning. I disse tilfælde skal de tilgrundliggende overvejelser dokumenteres.
Blødningsrisiko uden antitrombotisk behandling
Neuraksial blokade (NAB) finder udbredt anvendelse, men kan eventuelt føre til SH. SH er en meget sjælden, men frygtet komplikation, da den ofte medfører svær og blivende invaliditet. Denne vejledning er ikke en generel vejledning i udførelse af NAB, men fokuser alene på forebyggelse af SH ved anvendelse af NAB til patienter i antitrombotisk behandling.
Incidencen af SH afhænger bl.a. af patientens alder og skønnes at være 1:200.000 ved obstetrisk epidural blokade, mens SH er rapporteret hos 1:22.000 ved NAB hos ældre kvinder med hoftefraktur og 1:3.600 ved knæalloplastik (172-174). De sjældne tilfælde af SH i forbindelse med obstetriske indgreb, er ofte associeret til koagulopati i forbindelse med obstetriske komplikationer (eks. større blødning, pre-eklampsi, påvirket leverfunktion). Andre risikofaktorer for SH er karkirurgiske indgreb, cava inferior atresi, nyre- og leverpåvirkning samt koagulopati (175).
Generelt kan risikofaktorerne for udvikling af post-NAB SH ofte relateres til proceduren eller være patient- eller medicinrelateret, men komplikationen ses også hos patienter uden kendte risikofaktorer (176).
Risikoen for SH ved anlæggelse af NAB er ca. 10 gange højere, hvis der er besværligheder ved anlæggelsen (gentagne forsøg), og/eller hvis der opstår blødning i forbindelse med anlæggelsen (172;177;178). Hvis NAB gennemføres, bør det overvejes at øge tidsintervallet til administration/genoptagelse af eventuel antitrombotisk behandling. Et andet kritisk øjeblik for udvikling af SH, er ved fjernelse af det epidurale kateter, da hæmostasen kan være kompromitteret i efterforløbet af det operative indgreb. Risikoen for spinalt hæmatom fundet ligeså stor ved fjernelsen af kateteret som ved anlæggelsen (177). Fjernelse skal derfor også betragtes som en højrisikoprocedure, og den antitrombotiske plan indrettes efter dette.
Blødningsrisiko ved antitrombotisk behandling
Over halvdelen af de i litteraturen beskrevne tilfælde af SH i forbindelse med NAB er opstået hos patienter, der er behandlet med antitrombotiske midler (179). Der er de senere år udarbejdet amerikanske, europæiske og skandinaviske retningslinjer, hvor der ret detaljeret er taget stilling til, hvordan antitrombotisk behandling skal håndteres hos patienter, som får anlagt og fjernet NAB (174;175;180-185).
Lavmolekylært heparin (LMH)
LMH blev introduceret som kirurgisk tromboseprofylakse i 1980erne, og i de første studier af sikkerheden ved brug af LMH fandt man ingen øget hyppighed af spinalt hæmatom. I USA fandt man i løbet af 18 måneder efter markedsføring af enoxaparin 8 tilfælde af spinalt hæmatom hos patienter, der var opereret i NAB, og det blev sandsynliggjort, at årsagen til den øgede hyppighed var, at man i USA anvendte højere doser af enoxaparin (30 mg x 2 dgl.) end i Europa (20 eller 40 mg dgl) (186). Erfaringerne førte til, at man efterfølgende har defineret minimumsintervaller mellem injektion af LMH og anlæggelse af kateter til NAB: 10 timer efter 4.000-5.000 IE og 24 timer efter terapeutiske doser (150-200 IE/kg). Intervallernes længde er baseret på ekspertvurderinger og kendskab til eliminationshastigheden for LMH. Man bør imidlertid være opmærksom på, at længere intervaller kan være påkrævet hos patienter med nyreinsufficiens, hvor udskillelsen af LMH er nedsat (187).
I forhold til tidsinterval fra anlæggelse af kateter til NAB (eller manipulation med kateteret) og til indgivelse af antitrombotisk behandling, er der defineret et rekommanderet minimumsinterval på 6 timer, og et praktisk anvendt tidsinterval på 2-4 timer i de Skandinaviske retningslinjer for NAB (175).
Efter atraumatisk anlæggelse af NAB medfører tromboseprofylakse med UFH kun ringe blødningsrisiko, men efter traumatisk anlæggelse forøger heparin den relative risiko for blødningskomplikation over 100 gange (188). UFH anvendes i dag næsten ikke længere som tromboseprofylakse, men behandlingen i terapidoser (›5000 U; 70- 100 U/kg) anvendes fortsat til forskellige indikationer. I de tilfælde anbefales det, på baggrund af blødningsrisiko, at afbryde heparininfusionen 4 timer før anlæggelse. Samtidig anbefales det at kontrollere, at APTT er normaliseret, og at trombocyttallet er normalt inden anlæggelse. Det anbefales ligeledes, at man venter 6 timer efter kirurgi, inden infusionen genoptages (175).
Vitamin K-antagonister (VKA)
Der findes kasuistiske meddelelser, som rapporterer udvikling af SH efter NAB under fortsat og overdoseret VKA-behandling. Samtidig findes der større undersøgelser (n=1000, n=1030), som ikke påviser udvikling af SH ved NAB under fortsat VKAbehandling (INR 2,0) ved vaskulær kirurgi, og som ikke påviser komplikationer ved fjernelse af katetre ved INR mellem 1,5 – 4,3 (189;190). På grund af usikkerheden omkring blødningsrisikoen kræver man arbitrært, at INR skal være ‹1,5 (188).
Fondaparinux
Fondaparinux er en faktor Xa-hæmmer med lang halveringstid (ca 17 timer), som kan være betydeligt forlænget ved patienter med nedsat nyrefunktion. Det anbefales, at tromboseprofylakse med fondaparinux indledes 6-24 timer postoperativt. Behandlingen giver således ingen problemer ved anlæggelse af NAB. Blødningsproblemer kan imidlertid opstå, hvis epiduralkateteret først fjernes efter påbegyndt behandling med fondaparinux. Der anbefales da et interval på mindst 36 timer fra seneste injektion af fondaparinux til fjernelse af kateter (183). Længere tid ved nedsat nyrefunktion.
NOAK
Selv om dabigatran etexilat, rivaroxaban og apixaban efterhånden har været anvendt i nogle år, er erfaringerne med NAB hos NOAK-behandlede patienter stadig begrænsede. I de ortopædkirugiske lanceringsstudier blev NOAK først givet postoperativt, tidligst i dabigatran-studierne (1-4 timer postoperativt). Der er ikke rapporteret SH ved NAB til NOAK-patienter i forbindelse med de kirurgiske lanceringsstudier, men samlet er der dog kun behandlet omkring 12.500 patienter, og set i lyset af, at SH er en meget sjælden komplikation, og at NOAK kun blev givet postoperativt, har vi herfra ingen konklusive data på sikkerheden ved anvendelse af NAB til patienter i NOAK-behandling (184). Anvendelse af NAB til patienter i præoperativ NOAK-behandling har været genstand for en del diskussion i litteraturen (182;184;191). I mangel af observationelle data har halveringstiderne for de forskellige NOAK og patientens kreatinin clearance dannet grundlag for anbefalinger af varigheden af præoperativ pause med NOAK.
Der har dog været meget forskellige holdninger til tidsintervallerne mellem NOAK-administration og NAB. I retningslinjerne fra European Society of Anaesthesiology (ESA) i 2010 fandt man det tilstrækkeligt med en pause på 2 halveringstider fra seneste dosis NOAK til kateteranlæggelse eller -fjernelse (183). I retningslinjerne fra American Society of Regional Anesthesia and Pain Medicine (ESRA) i 2015 anbefaler man derimod en pause på 5-6 halveringstider (192).
Tilsvarende anbefaler amerikanerne et langt interval på 24 timer fra kateterfjernelse til start på NOAK, mens man ifølge de europæiske retningslinjer kan nøjes med 4-6 timer (se tabel 21). Ingen af de to vejledninger oplyser om forholdsregler hos patienter, som behandles med edoxaban.
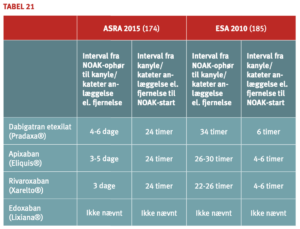
Da det generelt gælder, at der ved anlæggelse eller fjernelse af kanyle eller kateter ved NAB principielt kræves et normalt fungerende hæmostasesystem, kan det forekomme dristigt at anbefale to halveringstider som tilstrækkeligt interval fra NOAKadministration til katetermanipulation, specielt da analyser har vist stor variation i plasmakoncentrationen af NOAK under vedligeholdelsesbehandling. Variationen, som kan skyldes interaktion med anden medicin eller genetiske forskelle i eliminationsmekanismerne, kan betyde, at en del patienter efter pause i 2 halveringstider vil have en plasmakoncentration, som svarer til næsten terapeutisk koncentration hos andre patienter. Det må derfor indtil videre anbefales, at intervallet mellem NOAK-administration og katetermanipulation svarer til 5 halveringstider af det anvendte NOAK. Ved fjernelse af kanyle eller kateter efter NAB kan der være småkarblødning, som hurtigt ophører hos patienter normal hæmostase. Spørgsmålet om, hvornår man kan indlede antitrombotisk behandling efter NAB uden at fremkalde kapillær reblødning er vanskeligt at besvare. Mange års erfaring har vist, at det er sikkert at indlede behandling med LMH 4 timer efter fjernelse af kanyle eller kateter. Blødningsrisikoen ved heparinbehandling er mindst lige så stor som ved behandling med NOAK. Det er derfor vanskeligt at forstå den amerikanske anbefaling af, at NOAK-behandling først kan indledes 24 timer efter kanyle/kateterfjernelse. NOAK burde kunne påbegyndes efter samme interval som LMH, men i mangel på observationelle data anbefales, som foreslået af ESA, et lidt længere interval på 4-6 timer.
Trombocytfunktionshæmmende midler
ASA anvendt som tromboseprofylakse har ringe betydning for blødningsrisikoen i forbindelse med NAB (188). Mere potente trombocythæmmende midler som clopidogrel, prasugrel, ticagrelor og glykoprotein IIb-IIIa hæmmere kan imidlertid øge blødningsrisikoen, specielt hvis de gives sammen med antikoagulerende midler. Da der ikke findes data vedrørende sikkerheden ved anvendelse af disse midler i forbindelse med NAB, anbefales et interval mellem seneste medicinindgift og anlæggelse/fjernelse af kateter svarende til tiden til reetablering af næsten normal trombocytfunktion, d.v.s. 7 døgn for clopidogrel og prasugrel, 5 døgn for ticagrelor, 2 døgn for abciximab og 10 timer for eptifibatid (175;193).
Fibrinolytika
Fibrinolysemidlerne alteplase, reteplase og tenecteplase har alle korte halveringstider (5-25 minutter), men systemisk fibrinolysebehandling medfører ofte et betydeligt fald i P-fibrinogen, og NAB må anses for kontraindiceret, indtil P-fibrinogen er normaliseret, hvilket normalt sker i løbet af 1-2 døgn. Hvis NAB overvejes mindre et døgn efter ophør med systemisk fibrinolysebehandling, skal P-fibrinogen kontrolleres inden kateteranlæggelse.
Fibrinolysebehandling er kontraindiceret de første dage efter NAB, da behandlingen indebærer risiko for opløsning af dannede koagler i den epidurale karvæg, og dermed risiko for spinal hæmatomdannelse. Denne risiko persisterer formentlig i op til 10 dage efter adminstrationen af trombolysebehandlingen (182;193).
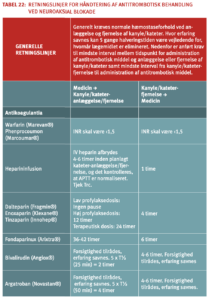
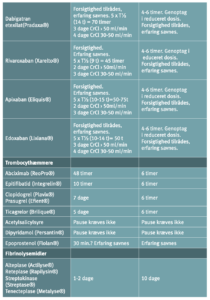
Gastrointestinal endoskopi med og uden biopsi
Ved endoskopiske procedurer på patienter i antitrombotisk behandling skal risikoen for trombose ved endoskopi under pauseret behandling afvejes over for risikoen for blødning, hvis indgrebet foretages under opretholdt behandling. Afvejningen vanskeliggøres af, at de foreliggende erfaringer overvejende er baseret på observationelle studier og ekspertvurderinger snarere end prospektive randomiserede undersøgelser.
Blødningsrisiko uden antitrombotisk behandling
Blødningsrisikoen vurderes ud fra oplysninger om den patientrelaterede blødningstendens, co-morbiditet og især ud fra det planlagte indgreb. Kwok og Fangel har på baggrund af litteraturstudier opstillet en liste over blødningsrisiko ved forskellige endoskopiske procedurer (194) (tabel 23).
I de i afsnit 5 nævnte retningslinjer er de endoskopiske procedurer opdelt i lavrisiko og højrisikoprocedurer (se tabel 14) i forhold til blødningsrisiko. Højrisikoprocedurerne er procedurer, hvor riskoen for større blødning (hospitalisering, intervention, transfusion, kirurgi) er ≥1%, og lavrisikoprocedurer, hvor risikoen for større blødning er ‹1% (tabel 15).
Diagnostisk endoskopi med eller uden biopsi regnes generelt for indgreb med lav risiko for blødning (153;195).
Ved endoskopi må også forhold som erfaring hos endoskopøren og den generelle risiko for læsioner ved biopsi, størrelse, morfologi og lokalisation af polyp, overvejes (196). For de patientrelaterede forhold er især alderen associeret til en øget risiko for postpolypektomi blødning (197), men også kolangitis, koagulopati og hemodialysis kan være risikofaktorer for post-polypektomiblødning (198). Forhold som nedsat nyrefunktion, cirrose, koagulopati (erhvervet eller kongenit) og trombocytopeni anses generelt for at øge blødningsrisikoen (199).
Hvis de anamnestiske oplysninger giver mistanke om abnorm blødningstendens, suppleres der med relevante blodprøver, eventuelt mere specifikke hæmostaseanalyser, rettet mod den kliniske mistanke.

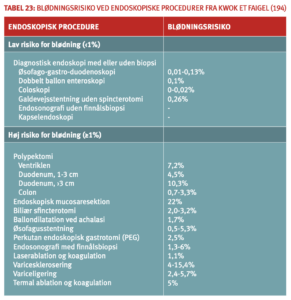
Blødningsrisiko ved antitrombotisk behandling
Vurdering af blødningsrisikoen ved endoskopi hos patienter i antitrombotisk behandling baserer sig på få og mindre prospektive studier, men for VKA-behandlingens vedkommende hovedsagelig på retrospektive undersøgelser (148). Sammenstemmende viser disse studier, at VKA-behandlingen er en uafhængig risikofaktor for blødning ved coloskopisk polypektomi (150;200;201).
Det vurderes, at lavrisikoindgreb kan udføres under fortsat VKA-behandling, forudsat at denne er stabil med INR 2-3 (tabel 24). Derimod bør der på grund af blødningsrisiko pauseres med warfarin til INR er ‹1,5 før procedurer ved indgreb med høj blødningsrisiko. For patienter med høj risiko for trombose (se tabel 19) anvendes heparin-bridging med terapidoser af LMH, der administreres som beskrevet i kapitlet om heparinbridging. Dette på trods af at evidensen for brug af bridging terapi ved endoskopiske procedurer er begrænsede (202).
Behandling med ASA og NSAID (nabumetone) viste i et stort case-control studie med 20.636 patienter ingen forskel i risikoen for en blødning postoperativt efter polypektomi (203). Andre studier har støttet dette fund (150;200;201). Det anbefales, at ASA og NSAID kan fortsættes uændret uafhængig af indgreb (194). Der foreligger ingen studier, som undersøger blødningsrisikoen ved endoskopi under behandling med dipyridamol, men det vurderes at blødningsrisikoen er mindre end med ASA (152;204).
Behandling med thienopyridiner (clopidogrel og prasugrel), ticagrelor samt GP IIb/ IIIa inhibitorer giver typisk mere blødningstendens end ASA og NSAID. En retrospektiv undersøgelse af patienter, der fik foretaget polypektomi, tyder dog på, at clopidogrelbehandling hos disse patienter kun sjældent er forbundet med blødningskomplikationer (205). Blødning under indgrebet blev observeret hos 3/142 (2,1%) i clopidogrelbehandling og hos 26/1243 (2,1%), som ikke fik clopidogrel. Blødning efter indgrebet sås hos henholdsvis 3,5% og 1,0% (p = 0,02). Alle clopidogrelbehandlede patienter, som fik senblødninger, fik også ASA/NSAID. Forfatterne anbefaler, at velindiceret clopidogrelbehandling ikke pauseres i forbindelse med polypektomi, men at man undgår dobbelt trombocythæmning, d.v.s. holder pause med ASA/NSAID. Med det begrænsede antal patienter er undersøgelsen dog for lille til, at man kan drage faste konklusioner på området.
Patienter i behandling med prasugrel og ticagrelor skal formentlig håndteres på samme måde som patienter i behandling med clopidogrel, men erfaring på området savnes. Guideline fra the American Society for Gastrointestinal Endoscopy anbefaler, at clopidogrel og prasugrel pauseres i 5-7 dage og ticagrelor i 3-5 dage forud for endoskopisk procedure med høj blødningsrisiko, dog således, at pausering af ADP-receptorhæmmerne bør undgås de første 30 dage efter PCI og stentimplantation (206). Under pausen med ADP-receptorhæmmer behandles patienterne med ASA. Endoskopiske procedurer med lav blødningsrisiko kan udføres uden pausering af ADP-receptorhæmmere.
Erfaring med de nye Xa- og IIa-antitrombotika savnes. Det antages dog, at de perioperative doseringer angivet i tabel 20 for dabigatran, apixaban, rivaroxaban og edoxaban også kan anvendes ved gastrointestinale endoskopiske procedurer (206).
Tabel 24 giver en oversigt over retningslinjer for håndtering af antitrombotisk behandling ved gastrointestinale endoskopiske procedurer.

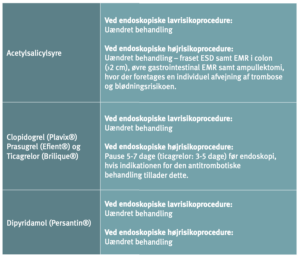
Genoptagelse af den antitrombotiske behandling
Der er ingen konsensus om den optimale timing for genoptagelsen af den antitrombotiske behandling. Warfarin kan genoptages i vedligeholdelsesdosis om aftenen efter det invasive indgreb. Ved høj risiko for trombose suppleres, såfremt blødningsrisikoen tillader det, med LMH i behandlingsdoser, indtil INR er i terapeutisk niveau i to på hinanden følgende målinger. For NOAK savnes data, men NOAK kan formentlig genoptages så snart hæmostasen er sikret. Ved påvirket nyrefunktion og ved høj blødningsrisiko (eks. ESD, EMR i colon ved læsioner ›2 cm, EMR i øvre gastrointestinal kanal og ampullektomi) genoptages post-operativt med reduceret dosis ligesom tidspunktet for genoptagelsen af behandlingen vurderes ud fra patientens trombose- og blødningsrisiko (se tabel 20). Pauserede trombocythæmmere kan genoptages dagen efter det invasive indgreb, hvis der ikke er tegn på postoperativ blødning. I de tilfælde hvor den antitrombotiske behandlingspause forlænges, skal det gøres efter nøje overvejelser af risikoen for tromboemboli uden antitrombotisk behandling.
Elektiv bronkoskopi og transbronkial biopsi
Blødningsrisiko uden antitrombotisk behandling
Mindre blødninger forekommer i 0,19% og alvorlige blødninger 0,26% af de patienterne som får foretaget bronkoskopi (207). Endobronkial ultralyd (EBUS) og endoskopisk ultralyd (EUS) anses ligeledes for at sikre procedurer med lav komplikationsrate (Jenssen C Ultrashall Med 2016; 37: 157-69). Alvorlig blødning ses sjældent ved den endoskopisk finnålsaspiration (EUS-FNA) (14/10941 patienter = 0,13%) (Wang, Gastrointest Endosc 2011; 73:283-90).
Over to tredjedele af de patienter, som udvikler blødning efter bronkoskopi, har normal koagulation og ingen kliniske risikofaktorer for blødning. De kliniske risikofaktorer for blødning, har en fin sammenhæng med abnorme koagulationsparametre, men kan ikke umiddelbart forudsige blødningsrisiko ved bronkoskopi (208). Kun hvis anamnesen giver mistanke om blødningstendens, eller hvis patienten er i antitrombotisk behandling, suppleres den kliniske vurdering med blodprøver til bestemmelse af hæmoglobin, trombocyttal, APTT, INR og eventuelt andre hæmostaseanalyser i relation til den kliniske mistanke eller anvendt antitrombotika (208;209). Tidligere studie har dokumenteret at transbronkial biopsi (TBB) medfører en fordobling af risiko for klinisk signifikant bronkoskopiinduceret blødning (210). Risikoen for blødning ses noget højere ved diffus lungesygdom, ved respiratorbehandling, ved nyresvigt (hæmodialyse patienter) og hos knoglemarvstransplanterede med trombocytopeni (209;211-213). Endvidere er tilstedeværelse af pulmonal hypertension en velkendt risikofaktor for blødning ved transbronkial bioptering.
Let til moderat trombocytopeni kontraindicerer ikke bronkoskopi. I et retrospektivt studie af hyppigheden af blødning efter bronkoskopi og bronkoalveolær lavage (BAL) på 150 patienter med trombocyttal ‹100 mia/l, heraf 72 patienter med trombocyttal på ‹50 mia/l og 15 patienter med trombocyttal på ‹20 mia/l, fik kun 1 patient med trombocyttal 61 mia/l blødning, som krævede kontinuerlig sugning efter indgrebet, men derefter ophørte spontant (214).
Blødningsrisiko ved antitrombotisk behandling
Vurdering af blødningsrisikoen ved bronkoskopi og TBB på patienter i antitrombotisk behandling er baseret på få kohordeundersøgelser, små patientserier og kasuistiske meddelelser. Dyreeksperimentelle undersøgelser på grise har givet resultater, som næppe kan overføres til den humane klinik.
Hos patienter i AK-behandling bør INR på undersøgelsestidspunktet være ‹1,5, men der foreligger ikke kliniske studier bagved. Der er tale om konsensusbeslutning ud fra anden litteratur på det endoskopiske område (208;215;216).
Erfaring med NOAK savnes. Det antages dog, at de perioperative doseringer angivet i tabel 20 for dabigatran, apixaban, rivaroxaban og edoxaban også kan anvendes ved transbronkiale procedurer.
Behandling med acetylsalicylsyre synes ikke at øge hyppigheden af blødning ved TBB. Alvorlig blødning efter TBB ses hos ‹1% (209;211). Derimod er TBB under behandling med clopidogrel rapporteret at være forbundet med betydelig blødningsrisiko (217). Blandt 604 patienter, der fik foretaget TBB, opstod der blødningskomplikation hos 16 af 18 patienter (89%), der fik clopidogrel vs 3,4% af de patienter som ikke var behandlet, og hos 12 af 12 patienter (100%), der fik clopidogrel samt acetylsalicylsyre versus 3,5% af de ubehandlede patienter (217). Det forventes, at behandling med prasugrel og ticagrelor, vil kunne være forbundet med lignende blødningskomplikationer, men data mangler.
I modsætning til ovennævnte studie fandt Stather et al. i en retrospetiv undersøgelse ingen blødningskomplikationer hos 12 patienter, der under behandling med clopidogrel og ASA (7 patienter) eller clopidogrel alene (5 patienter) havde fået foretaget endobronchial ultralyd-guidet transbroncial nåleaspiration (EBUS-TBNA) (218). Da det drejer sig om få patienter i en retrospektiv undersøgelse, må det fortsat generelt anbefales, at ADP-receptorhæmmere pauseres inden TBB, medmindre patienten har fået foretaget PCI og stentimplantation inden for de seneste 30 dage (22).
Ud fra de erfaringer som er draget på andre områder, forventes det ikke at behandling med dipyramidol eller kombinationen af ASA og dipyramidol øger blødningsrisikoen, men data mangler.

Billeddiagnostiske interventioner
Før den billeddiagnostiske intervention vurderes den individuelle, patientrelaterede blødningsrisiko, blødningsrisikoen ved indgrebet og behovet for evt. pausering af den antitrombotiske behandling. Den henvisende læge og radiologen, bør altid foretage en aktuel afvejning af indikationen for indgrebet i forhold til patientens blødningsrisko ved indgrebet og tromboserisiko ved nødvendig pausering af antitrombotisk behandling.
Blødningsrisiko uden antitrombotisk behandling
Blødningsrisikoen vurderes ud fra den patientrelaterede blødningstendens (blød – ningsanamnese, familiære disposition, tidligere blødninger ved indgreb), co-morbidi – tet og det planlagte indgreb.
Der foreligger ikke solide undersøgelser, som kortlægger blødningsrisikoen ved de forskellige procedurer på området. Segal et al. fandt ved litteratursøgning 25 studier, hvor resultater af koagulationsanalyser og incidens af blødningskomplikationer ved forskellige invasive procedurer var beskrevet (54). Det drejede sig om mange forskel – lige typer indgreb, og langt hovedparten af undersøgelserne var observationelle stu – dier med kun få patienter. Forfatterne konkluderede, at der savnes randomiserede kontrollerede undersøgelser til at vurdering af betydningen af abnorme hæmostase – parametre for blødningsrisikoen ved invasive procedurer. D
et er således alene ud fra eksisterende erfaring og ekspertvurderinger, at de radio – logiske interventionelle procedurer inddeles i høj- og lavrisikoprocedurer (tabel 26).
Hæmostasescreening inden billeddiagnostiske interventioner
Ved lavrisikoprocedurer er værdien af hæmostasescreening inden interventioner dis – kutabel. Hos patienter uden anamnestiske eller aktuelle kliniske tegn på blødnings – tendens er der meget ringe sandsynlighed for at finde hæmostaseforstyrrelser, der in – dicerer udsættelse af indgrebet eller behandling med hæmostatika i forbindelse med proceduren (219 ;220). Ved lavrisikoprocedurer kan hæmostasescreening betragtes som overflødig, hvis der foreligger en normal blødningsanamnese.
Ved højrisikoprocedurer som f.eks. grovnålsbiopsi, i områder, hvor der ikke kan kom – primeres, anbefales det at bestemme patientens trombocyttal og INR, selv om det i flere arbejder anføres, at disse analyser uden samtidig klinisk vurdering af patientens blødningstendens giver en usikker vurdering af blødningsrisikoen (219 -221). Dette er i fuld overensstemmelse med de anførte betragtninger i denne rapports kapitel 2. APTT skal ikke anvendes rutinemæssigt, kun ved kendt behandling med hepariner. Blødningstid er i denne henseende en obsolet metode. Specielle koagulationsana – lyser og trombocytfunktionsundersøgelser skal kun udføres, såfremt blødnings – anamnesen, patientens sygdom eller objektiv undersøgelse giver mistanke om øget blødningstendens. I erkendelse af et behov for dokumentation og udelukkelse af kon – traindicerende tilstande, vurderes det, at man bør måle trombocyttal og INR, samt få oplyst, om patienten er i behandling med trombocythæmmere, NOAK, LMH eller andre antitrombotika, hvis effekt ikke fremgår af trombocyttal eller INR. Et trombocyttal ›40 x 109/l og en INR ≤ 1,4 anses som værende et acceptabelt niveau for udførelsen af et invasivt indgreb. Ved patienter med påvirket hæmostase anbefales det at blodprøverne er taget indenfor 24 timer. Ved patienter med forventet stabil hæmostase kan blodprøvesvarene være op til 1 uge gammel. Ved miltbiopsi skal der desuden foreligge en gylding BAC-test idet studier har vist, at blødningsrisikoen ved miltbiopsi er højere end ved leverbiopsi (222). Ved visse andre procedurer, hvor der vurderes at være høj blødningsrisiko med mulig fatal konsekvens bør der også foreligge en gyldig BAC-test. Hæmoglobinkoncentrationen bør oplyses fra klinikerne, hvis der er klinisk mistanke om anæmi, og er hæmoglobinen kritisk lav, bør der foreligge en BAC-test og en transfusionsstrategi forud for indgrebet.
Blødningsrisiko under antitrombotisk behandling
Meget få studier belyser dette specifik i forhold til det radiologiske område. Mange retningslinjer lægger sig op ad den viden, man har fra andre specialer. Dette fremgår også af den europæiske guideline fra 2009 og 2012, der i mangel på evidensbaserede data er baseret på konsensus i en ekspertkomité bestående af 18 medlemmer af the Standards of Practice Committee with Cardiovascular and Interventional Radiological Society of Europe (CIRSE) Endorsement (223).
Mammabiopsi
Inden for mammaområdet foreligger der få mindre studier, som alle konkluderer, at biopsi af mamma kan foretages uden at pausere med hverken warfarin, heparin eller ASA før biopsi (224;225).
Biopsi fra parenkymatøse organer i thorax og abdomen
Der foreligger begrænsede data, der beskriver den perioperative håndtering af antitrombotika i forhold til leverbiopsi. Ingen studier belyser om pausering er nødvendig, eller hvornår de forskellige antitrombotika kan pauseres eller genoptages igen. I litteraturen har man har tildels adapteret data fra andre kirurgiske områder (prostata, nyre, mamma, gastrointestinalt), hvor der foretages invasive procedure, og har genereret konsensus udfra disse, også på leverbiopsiområdet. Vel vidende at leveren er meget forskellig fra disse andre organer og meget vaskulariseret (221). I American Association for the Study of Liver Diseases (AASLD) anbefales fra flere til 10 dages pause med trombocythæmmere før biopsi, og genoptagelse 48-72 timer efter. Vedrørende antikoagulantia anbefales pausering, og for warfarin skal der pauseres mindst 5 dage, men der må individualiseres i forhold til INR, som ved indgrebet skal være ‹1,5. Warfarin må genoptages dagen efter leverbiopsien. Det anføres, at der er få data til at understøtte dette, at der hovedsagelig er tale om rekommendationer, som er ekstrapoleret ud fra biopsirisiko i andre organer. Der er således også her tale om, at man må foretage en individuel vurdering fra patient til patient både i forhold til patientens blødnings- og tromboserisiko.
På baggrund af ovennævnte position paper (221) samt erfaringer, som angiver, at der hyppigt opstår blødninger ved indgreb på leveren, idet leveren er rigt vaskulariseret, og idet en blødning i leveren kan få alvorlige følger, rubriceres leverbiopsi, ligesom de andre parenkymatøse organer, som højrisikoprocedure. Håndteringen af den antitrombotiske behandling i relation til leverbiopsi angives i denne rapport konservativt ud fra et sikkerhedsperspektiv, som tilgodeser blødningskomplikationen, men det er vigtigt at der tages aktivt stilling hos hver patient i henhold til den overordnede indikation for behandlingen.
I forhold til trombocytfunktionshæmmere anvendes tabel 10, hvor patienter med lav tromboembolisk risiko pauserer behandling med henholdsvis ASA og ADP-receptorhæmmere 3 og 7 dage præoperativt, og patienter med høj tromboembolisk risiko enten får den elektive procedure udsat, fortsætter ASA eller pauserer behandlingen med ADP-receptorhæmmere 5 dage præoperativt. Behandlingen genoptages i døgnet efter indgrebet, såfremt hæmostase er sikret.
LMH-behandling vurderes, at skulle pauseres 12 timer før procedure ved høj profylakse-dosis og 24 timer ved terapeutisk dosis.
Patienter i warfarinbehandling pauserer 3-5 dage før indgrebet, så INR falder til ≤1,4. Warfarin genoptages om aftenen efter indgrebet, når patienten kan indtage tabletter, såfremt hæmostasen er sikret.
Endnu mindre erfaring haves med NOAK. De anbefalinger, som foreligger i denne rapport, er udelukkende baseret på viden om farmakokinetik og analogisering til behandling med andre antikoagulerende behandlinger. Der foreligger få kliniske studier og ingen på leverbiopsipatienter.
Biopsi fra ekstremiteter og andre komprimerbare områder
Der foreligger ikke data, der understøtter nødvendigheden af at foretage hæmostaseundersøgelse af patienter, som ikke har en kendt koagulationsforstyrrelse. Vedrørende patienter i VKA-behandling, som skal have foretaget kutan kirurgi, henvises til kapitel 5.
Henvisning til billeddiagnostisk intervention
For at både den henvisende læge og radiologen kan foretage kvalificeret afvejning af såvel blødnings- som tromboserisikoen for den enkelte patient i antitrombotisk behandling, bør der altid foreligge følgende oplysninger til radiologen:
» Indikationen for interventionen
» Angivelse af det ønskede tidspunkt for intervention
» Indikationen for den antitrombotiske behandling
» Angivelse af typen af antitrombotisk behandling samt dosis
» Aktuel klinisk status for patienten og evt co-morbiditet – eks. akut klinisk medtaget med formodet øget blødningsrisiko eller tromboserisiko
» Angivelse af resultaterne på relevante hæmostasevariable
» Angivelse af plan for evt. pause med antitrombotika
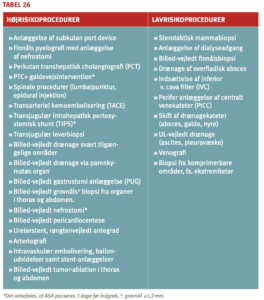

Neurokirurgiske indgreb
Traditionelt betegnes neurokirurgi som højrisikokirurgi, og en særlig udfordring ses ved de akutte cerebrale eller spinale hæmoragier, hvor den udløsende årsag netop er en anti-trombotisk behandling. I realiteten spænder neurokirurgien over hele spektret, fra meget lav blødningsrisiko som ved perifer nervekirurgi (226), til ekstrem højrisiko ved dybe hjerneoperationer eller operationer nær medulla, hvor selv meget få ml postoperativt hæmatom kan medføre svær invaliditet eller død. Det er derfor vigtigt at foretage en individuel risikovurdering som beskrevet i den generelle vejledning vedrørende risiko for venøs tromboemboli (VTE) vs. blødningsrisiko. Dels ud fra patientens almene risiko dels ud fra det forestående indgreb (se tabel 28).
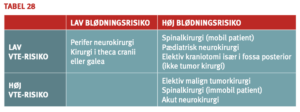
VTE profylakse
Patienter, som får udført større neurokirurgiske indgreb, er som udgangspunkt i moderat risiko for at få VTE, og bør rutinemæssigt modtage tromboseprofylakse (227;228). Der er dog store interindividuelle forskelle i VTE-risikoen, som afhænger dels af grundmorbus og dels af typen af indgreb (se tabel 28). Øget tendens til VTE ses ved intrakranielle procedurer, malignitet, lang operationstid, inferior parese (immobile patienter) og høj alder. Især patienter, som opereres for maligne cerebrale tumorer er særligt udsatte for VTE perioperativt og i tidlig postoperativ periode (229).
I neurokirurgien/spinalkirurgien benyttes gerne mekanisk tromboseprofylakse i form af kompressionsstrømper, som i modsætning til antikoagulantia ikke øger risikoen for postoperativt hæmatom. Kompressionsstrømper har ved flere RCT studier vist at nedbringe risikoen for DVT (227). Både ufraktioneret heparin (UFH) og lavmolekylært heparin (LMH) kan også benyttes. LMH bør som udgangspunkt først administreres dagen efter operation (se specifikke grænser i tabel 29) for at nedsætte risikoen for postoperativt hæmatom, da denne ellers er ca. dobbelt så høj (2.3 vs 1.4%) som hos patienter, der får mekanisk tromboseprofylakse eller ingen profylakse (230). Som udgangspunkt synes risikoen for letalt forløb af postoperativt hæmatom at være meget mindre end for letal lungeemboli (LE) hos postoperative patienter i antikoagulerende behandling (231).
Subaraknoidalblødning:
I et studie fandtes DVT hos 9,7% og LE hos 2% af patienter med rumperet intrakranielt aneurisme (232).
Kranietraume:
DVT-incidensen er opgjort til 3.8% i et enkelt materiale (233).
Tumor cerebri:
Patienter med hjernesvulst har en høj incidens af både DVT og LE med DVT-incidenser rapporteret helt op til 60%, dog helt afhængigt af diagnostisk metode. Risikoen for en symptomatisk DVT synes at ligge i omkring 25% inden for de første 12 måneder (229;234).
Spinalkirurgi:
Generelt er risikoen ved lumbal spinalkirurgi lav. Incidensen af DVT har været påvist så lav som 0,6% hos diskusprolapspatienter (235). Paraparesis inferior, fedme, langvarig immobilisering og operation over 45 min synes at øge incidencen, hvoraf de sidste 2 især ses ved fusionskirurgi i forhold til f.eks. simpel prolapskirurgi (236).
Pædiatrisk neurokirurgi:
VTE ses meget sjældent hos i øvrigt raske børn, og profylaktisk behandling er sjældent indiceret (237).
Spinalt traume (ST):
Uden tromboprofylakse har ST den højeste incidens af DVT af alle hospitaliserede patienter, flere studier har vist at op imod 60-100% har symptomatisk DVT (227;238). Endvidere har et studie vist, at LE er den 3. hyppigste dødsårsag ved ST(239). Flere studier tyder på, at LMH har større effekt end LDUH og mekanisk profylakse alene, men effektforskellene er små, og ingen af produkterne har overbevisende effekt på incidensen af VTE. Den antitrombotiske behandling bør uanset produkt, indledes så snart en evt. aktuel blødningsproblematik fra det samlede traume er under kontrol. Ved længere tids risiko for blødning fra f.eks. indre organer eller cerebralt, bør mekanisk lægkompression indledes. For patienter i længere genoptræningsforløb bør LMHW fortsættes (227).
Akutte neurokirugiske patienter:
Alle patienter mobiliseres hurtigst muligt efter klinisk skøn. Alle patienter påføres graduerede kompressionsstrømper (TED-strømper) dækkende crus og femur, og medicinsk profylakse med LMH opstartes efter vejledning på næste side (231) (tabel 29).
Pausering af antitrombotisk behandling
Vedrørende akut kirurgi med høj blødningsrisiko henvises der til det generelle kapitel om reversering af forskellige antitrombotiske præparater (kapitel 6).
Intracerebral hæmoragi (ICH) er en af de mest frygtede komplikationer ved patienter i antitrombotisk behandling. Ca 20-30% af patienter med en spontan ICH er i antitrombotisk behandling, hvilket sætter store krav til den samlede behandling af disse patienter (240;241). Patienternes hæmostaseforstyrrelse har betydning for hæmatomets volumen (242), som har væsentlig indflydelse på patientens prognose (243), og mortaliteten er fortsat høj (›40%) trods behandling med PCC (240;244). I den akutte situation må en individuel vurdering af patientens tromboserisiko og risiko for vækst af hæmatomet afgøre, hvor aggressivt patientens medicin skal reverseres. Er patienten i høj risiko for VTE, kan især en høj dosis af antidot medføre VTE, hvilket kan forklare noget af den høje samlede mortalitet.
Hos patienter i warfarinbehandling bør reverseringen (hvis ingen andre oplysninger foreligger) indledes så hurtigt som muligt med PCC efterfulgt af K-vitamin (244). Reverseringen bør indledes allerede ved den første telefoniske henvendelse til neurokirurgen, som ud fra anamnese, klinik og billedmateriale tager en beslutning i samarbejde med den henvisende læge, vedrørende dosis af antidotbehandling. FFP har i den henseende ikke nogen plads i den hyperakutte behandling (244). Ved patienter i behandling med orale faktor Xa-hæmmere findes som udgangspunkt ingen specifik antidotbehandling. Til gengæld ser det i litteraturen ud til, at disse præparater har lavere incidens af ICH (RELY, ROCKET-AF, og ARISTOTLE trials), samt at hæmatomet ikke ekspanderer i samme omfang som ved warfarinbehandling (in vitro studier) (245).
Ved traumer medførende epiduralt, subduralt eller parenchymatøst hæmatom gælder samme retningslinjer som for ICH patienter. Den multitraumatiserede patient vil ikke blive belyst i dette kapitel, da det vil blive for omfattende.
Ved SAH blødningen gælder samme retningslinjer. Patienter med kendte, ikke-akut blødende aneurismer bør i øvrigt behandles med antitrombotika som alle andre patienter, hvis der findes indikation herfor. Ingen studier har påvist en øget blødningstendens, vel vidende at en blødning, hvis den skulle indtræde, i så fald oftest ville være fatal (246).
De seneste år har hæmostasescreening med trombelastografi (TEG) eller/og trombelastometri (ROTEM) samt fuldblods trombocytaggregometri (Multiplate) vundet indpas i dansk neurokirurgi. Metoderne har vist sig egnede til vurdering af den mulititransfusionskrævende patient (247), men i neurokirurgien er litteraturen yderst sparsom, og der findes meget lidt generelt og ingen randomiserede undersøgelser, der belyser, om brugen af disse metoder kan nedsætte risikoen for postoperative hæmatomer eller den peroperative blødningsmængde. Indtil disse undersøgelser foreligger, kan metoderne ikke være en påkrævet del af den akutte neurokirurgiske indledende eller peroperative behandling. Brugen af metoderne må være den enkelte kirurgs beslutning.
Elektiv neurokirurgi med høj blødningsrisiko bør individuelt risikovurderes, og der henvises til de generelle afsnit for risikovurdering. Pga. den høje mortalitet og invaliditet (op til 30% mortalitet og 30% morbiditet) fra postoperative hæmatomer selv ved beskedne indgreb som f.eks. et borehul ved et kronisk subduralt hæmatom, er det i neurokirurgien vigtigt at se på samtlige præparater med indflydelse på hæmostasen, herunder også naturprodukter. I tabel 30 ses en oversigt over NSAID-præparater med indflydelse på hæmostasen, der ikke er nævnt tidligere i denne vejledning, men som kan influere på den neurokirurgiske behandling.
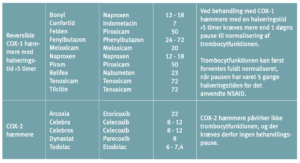

For naturpræparaterne anbefales pause på 14 dage, da man ikke kender omfanget af indtaget, virkningsvarigheden, samt at risikoen for at pausere disse ses som meget lille. Der findes formentlig adskillelige præparater med indflydelse på hæmostasen, men her listes de mest almindelige: Baldrian, Ephedra, Fiskeolie, Ginko, Ginseng, Hvidløgspræparater, Hyperikumpræparater, Ingefær.
Ved elektiv kirurgi med lav blødningsrisiko kan patienten opretholde den antitrombotiske behandling, hvis risikoen for VTE er stor set i forhold til generelle risiko (alder, malign sygdom ect., se tabel 7). I et studie af patienter opereret for karpaltunnelsyndrom i aktiv warfarinbehandling blev ingen postoperative hæmatomer observeret (226).
Lumbalpunktur
Lumbalpunktur (LBP) gennemføres med det formål at udhente materiale til diagnostik eller indgift af medicin. For vejledning om spinal/epidural bedøvelse (neuroaksial blok) se afsnit 7.1 i denne vejledning.
Risikoen for spinal blødning er meget lav (1/3600 – 1/200.000), men desværre forbundet med betydelige morbiditet, hvis den skulle indtræde (248). Risiko eksisterer under indstik og i timerne efter, og risikoen øges med kanyle størrelse (mindre er bedre), type (atraumatisk er bedre), gentagne indstik (1 er bedst) og endvidere ved samtidig effekt af antitrombotika.
Krav til trombocyttal anbefales forskelligt i flere lande med ›50 mia/l i USA (249), ›50 mia/l hos voksne og 20-40 mia/l hos børn i UK (250-252), og ›20 mia/L i Tyskland (253) i tilfælde hvor det er en planlagt procedure, men dette baseres på sparsom evidens. Koagulationsfaktorniveau målt ved INR eller PT forud for lumbalpunktur er dårligt belyst og praksis varierende (254).
På akut (eller vital) indikation gennemføres proceduren uden forsinkelse i ventetid på blodprøver, og hæmostasen overvejes normaliseret under og efter proceduren i tilfælde med effekt af antitrombotika eller udtalt klinisk koagulopati. Et godt eksempel er mistænkt akut meningitis, hvor lumbalpunktur skal foretages straks uden forsinkelse fraset tilfælde, hvor truende cerebral inkarceration mistænkes (CT skanning overvejes: Dansk selskab for infektionsmedicin. 2010).

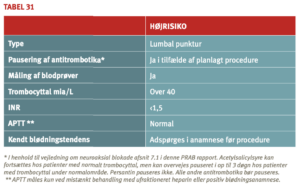
Overstående fritager ikke lægen for en individuel risikovurdering af patienten, og indikationen for proceduren er også betydende (akut eller elektiv).
Centrale venekatetre
Centralt venekateter (CVK) er en hyppig hospitalsprocedure. Adgangen kan etableres via perifere kar (fx ved albue som PICC/Longline) eller større centrale kar (vena jugularis/femoralis/subclavia). Risikoen for procedurerelaterede komplikationer er meget lav ved brug af perifer karadgang og lav ved anvendelse af større centrale kar. Komplikationerne omfatter blødning, hæmatom, pneumothorax, trombose, stenose og infektion, og afhænger af katetertype (ikke-tunneleret eller tunneleret), kateterstørrelsen (diameter), indstiksted og anlæggelsesteknik.
Det er i dag blevet standard praksis at anvende todimentional ultralyd til real-time visualisering af CVK-anlæggelse (255-257). Dette øger succesraten og mindsker komplikationsfrekvensen (258;259).
Blandt kritisk syge patienter med abnormal INR er risikoen for blødning 0,3% (260) og blandt hæmatologiske patienter med trombocytopeni det samme (261). Det er aktuelt uafklaret, hvad den kritiske grænse er for trombocyttal, INR og APTT i relation til CVK-anlæggelse. Effekten af plasma- og/eller trombocyttransfusioner er tilsvarende ukendt (261-263). Internationalt anvendes fx trombocyttal på 10-50 mia/l som grænse for CVK (261).
Anlæggelse af ikke-tunneleret CVK perifert eller i jugularis/femoralis hos en ukompliceret patient kan betragtes som ”lav blødningsrisiko” uden behov for monitorering af hæmostase eller pausering af antitrombotika (koagulations- og trombocytfunktionshæmmere). Tunneleret CVK eller mere komplekse katetre med porte/splitsheats etc. bør betragtes som forbundet med høj risiko for blødning eller hæmatom i indstiksområdet. Indstik i subclavia kan ikke manuelt komprimeres i tilfælde af blødning. Derfor tilrådes forsigtighed og af samme grund kategoriseres risikoen for proceduren som høj.
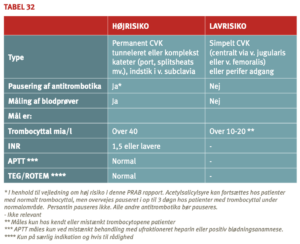
Overstående fritager ikke lægen for en individuel risikovurdering af patienten, og indikationen for proceduren er også betydende (akut eller elektiv). På akut (vital) indikation ses bort fra ovenstående, men proceduren tilpasses tilstanden og hæmostasen overvejes normaliseret under og efter proceduren, hvis der effekt af antitrombotika eller udtalt klinisk koagulopati.
Rekommandationer
Niveauer for rekommandationer og evidens
Til beskrivelse af dokumentationsniveau for anbefalinger er anvendt samme princip som i The 9th ACCP Conference on Antithrombotic and Thrombolytic Therapy (264). Grad 1 rekommandationer er anbefalinger, hvor der skønnes at være en sikker nettogevinst ved anvendelse af den beskrevne metode, mens nettogevinsten skønnes usikker ved grad 2 rekommandationer.
Den metodologiske styrke af de tilgrundliggende studier er angivet ved tilføjelse af et bogstav. Højeste styrke har A, hvor dokumentationen er skaffet ved veltilrettelagte og velgennemførte randomiserede kliniske undersøgelser (RCT) med éntydige resultater. Ved styrke B er dokumentationen baseret på RCT med inkonsistente resultater eller metodologiske svagheder. Styrke C repræsenterer resultater af observationelle studier og generaliseringer fra subgrupper af patienter inkluderet i RCT til grupper af patienter med lignende kliniske problemstillinger. De kliniske implikationer af vurderingerne strækker sig fra ’Stærk anbefaling’ (1A, 1B og 1C) til ’Svag anbefaling’ (2A, 2B og 2C).
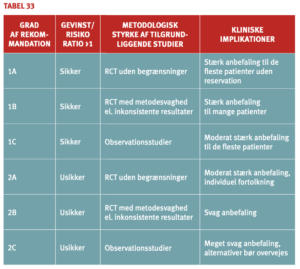
Generelt
» Beslutning om præoperativ pause med antitrombotiske midler bør ikke alene være baseret på en vurdering af patientens risiko for blødningskomplikation i forbindelse med indgrebet, men også inkludere en vurdering af risikoen for tromboemboliske komplikationer under pausen, idet tromboserisikoen i nogle tilfælde kan berettige, at indgrebet foretages trods øget blødningsrisiko (Grad 1C).
Vitamin K-antagonister (VKA)
» Ved invasive procedurer på patienter i behandling med VKA skal man i forbindelse med proceduren sikre sig, at behandlingsintensiteten er reguleret til passende niveau, idet INR over terapeutisk niveau er forbundet med høj risiko for blødningskomplikationer (Grad 1A).
» Ved uopsættelige indgreb på patienter, som har INR over terapeutisk niveau, og hvor man ikke kan afvente spontant eller vitamin K-induceret fald i INR, gives friskfrosset plasma 20-30 ml/kg eller protrombinkomplekskoncentrat (PCC) for at få INR ned i acceptabelt niveau (Grad 1C).
» Det anbefales, at VKA-behandling nedreguleres til INR ‹1,5 ved indgreb, hvor blødningskomplikationer erfaringsmæssigt opstår hyppigt eller hvor disse kan få meget alvorlige følger (Grad 1C). Disse højrisikoprocedurer omfatter f. eks.:
– Neuraksial blokade
– Neurokirurgi
– Endoskopiske højrisikoprocedurer
– Leverbiopsi og andre dybe biopsier med grov kanyle
– Bronkoskopi og transbronkial biopsi
– Re-operation
– Åben rectumkirurgi
– Operation i rigt vaskulariseret væv (fx thyreoidea, lever, nyre, prostata), større canceroperationer og operationer i inflammeret eller cicatricielt væv
» Følgende indgreb (lavrisikoprocedurer) kan foretages ved INR i terapeutisk niveau (INR 2-3):
– Kataraktoperation (Grad 1C+)
– Pacemakerimplantation (Grad 1C+)
– Knoglemarvsbiopsi (Grad 1C+)
– Mindre mundkirurgiske indgreb og tandekstraktion (Grad 1C+)
– Kutan kirurgi (Grad 1C)
– Ledpunktur (Grad 1C)
– Endoskopiske lavrisikoprocedurer (Grad 2C)
– Transuretral prostataresektion ved laserablation (Grad 2C)
– Transrektal prostatabiopsi (Grad 2C)
– Knæalloplastik i generel anæstesi (Grad 1C)
– Håndkirurgi (Grad 2C)
» Ved indgreb med intermediær blødningsrisiko anbefales det at stile efter INR ≤2,0 inden indgrebet (Grad 2C), dog således, at faktisk INR ‹2,5 accepteres (Grad 2C).
» Ved tandekstraktion og mundhulekirurgi anbefales brug af tamponer vædet med tranexamsyre eller mundskylning med en 5% tranexamsyreopløsning til sikring af hæmostase (Grad 1A).
» Ved pause med VKA før et indgreb bør man tage hensyn til:
– At patienter i warfarinbehandling typisk falder til subterapeutisk niveau på 3-5 dage (Grad 1C).
– At patienter, som får høj warfarindosis, falder hurtigere end dem, der får lav dosis (Grad 1C).
– At patienter, som får warfarin, falder hurtigere end dem, der får phenprocoumon (Grad 1A).
» Til patienter med høj risiko for tromboemboli anbefales det at give overlappende behandling med (lavmolekylært) heparin (heparin-bridging) i den periode, hvor INR er under terapeutisk niveau (Grad 2C). Heparinbehandlingen bør doseres, så der både tages hensyn til tromboserisiko og blødningsrisiko i forbindelse med indgrebet.
» Patienter, som har holdt pause med VKA i forbindelse med et indgreb, kan normalt genoptage VKA-behandling med hidtil anvendt vedligeholdelsesdosis straks efter indgrebet, idet der typisk går 4-6 dage, inden INR er tilbage i terapeutisk niveau (Grad 1C).
» Til patienter med ikke-høj risiko for tromboemboli frarådes anvendelse af overlappende behandling med (lavmolekylært) heparin (heparin-bridging) i den periode, hvor INR er under terapeutisk niveau (Grad 1B).
» Til patienter med ikke-høj risiko for tromboemboli og lav blødningsrisiko anbefales opretholdt eller let nedreguleret VKA-behandling i stedet for heparin-bridging (Grad 2C).
Lavmolekylært og ufraktioneret heparin (LMH og UFH)
» LMH medfører en dosisafhængig stigning i risikoen for blødningskomplikationer (Grad 1A). Lave profylaksedoser (2.000 – 3.500 IE sc) kan gives i umiddelbar tilslutning til operative indgreb (Grad 1A).
» Blødning under behandling med UFH og LMH kan behandles med iv injektion af protaminsulfat. 1 mg protaminsulfat ophæver den trombinhæmmende effekt af 140 IE UFH og LMH, men ikke anti-Xa effekten (Grad 1A).
» Det anbefales, at neuroaksial blokade tidligst anlægges 12 timer efter høj profylaksedosis af LMH (4.000 – 5.000 IE sc) og 24 timer efter terapeutisk dosis (150-200 IE/kg sc) (Grad 2C). Efter fjernelse af kateter bør der gå mindst 2 timer inden næste injektion af LMH (Grad 2C).
» Overlappende behandling med LMH eller UFH (heparin-bridging) anbefales perioperativt til patienter med høj tromboserisiko i forbindelse med pausering af VKAbehandling. Da heparin-bridging kun anbefales til patienter med høj tromboserisiko, bør behandlingen gives i terapeutisk dosering præoperativt frem til 24 timer før operationen. Postoperativt gives profylaksedosis indtil hæmostase er sikret, hvorefter terapeutisk dosering genoptages, indtil INR har været i terapeutisk niveau i mindst 2 døgn (Grad 2C).
» Endoskopiske lavrisikoprocedurer kan i forhold til blødningsrisiko udføres 12 timer efter sidste terapeutiske dosis. Profylaksedoser kræver ingen pause (Grad 2C).
» Endoskopiske højrisikoprocedurer kan i forhold til blødningsrisiko udføres 18-24 timer efter sidste terapeutiske dosis. Pause ved høje profylaksedoser er 12 timer før indgreb (Grad 2C).
» Ved høj risiko for trombose genoptages LMH behandlingen i behandlingsdoser så snart hæmostasen er sikret postoperativt (Grad 1C).
Trombocythæmmende midler
» Ved lav tromboserisiko holdes pause med trombocythæmmende midler (Grad 2C).
» Ved høj tromboserisiko fortsættes den trombocythæmmende behandlingen ved lav blødningsrisiko (Grad 1C), og der holdes kort pause eller monoterapi med trombocythæmmende behandling ved høj blødningsrisiko (Grad 2C).
» Behandling med clopidogrel, ticagrelor eller prasugrel øger risikoen for per- og postoperativ blødning. Ved elektive indgreb hos patienter med ikke-høj tromboserisiko og høj blødningsrisiko bør behandlingen pauseres 5-7 dage inden indgrebet (Grad 1B). Hos patienter med særlig høj tromboserisiko, f. eks. patienter med nylig indsat koronar stent, bør det overvejes om indgrebet kan udsættes eller udføres med kortere eller ingen behandlingspause (Grad 1C).
» Acetylsalicylsyre kan medføre øget blødningstendens ved koronar bypass kirurgi og visse andre operationer. Ved typer af elektiv kirurgi, hvor acetylsalicylsyre erfaringsmæssigt giver øget hyppighed af blødningskomplikationer, anbefales pause med acetylsalicylsyre ≥3 dage før operationen (Grad 1C).
» Ved neuroaksial blokade, karotiskirurgi, elektiv bronkoskopi, transbronkial biopsi samt endoskopiske lavrisikoprocedure er der ikke påvist øget hyppighed af blødningskomplikationer ved behandling med acetylsalicylsyre (Grad 2C).
» Ved invasive radiologiske højrisikoprocedurer anbefales 3 dages pause med acetylsalicylsyre ved ikke-høj risiko for trombose og så kort pause som muligt ved højrisiko for trombose (Grad 2C).
» Dipyridamol medfører ikke øget blødningstendens ved invasive procedurer (Grad 1C).
» Hos patienter med høj tromboserisiko kan i udvalgte tilfælde (CABG) overvejes at anvende cangrelor eller glycoprotein IIb/IIIa i pausen med ADP-receptorhæmmeren, men effekt og sikkerhed er endnu utilstrækkeligt belyst (Grad 2C).
» Anvendelse af lavmolekylært heparin til bridging ved pause med trombocythæmmer frarådes (Grad 2C).
» Der findes ingen antidot. Ved alvorlig blødning under behandling med clopidogrel, prasugrel, ticagrelor, abciximab samt eptifibatid kan trombocyttransfusion anvendes i forbindelse med indgrebet, hvis det er nødvendigt at operere patienten umiddelbart efter seponering af disse, evt. kan behandling med desmopressin 0,3 µg/kg i.v. og tranexamsyre 1 g i.v. overvejes (Grad 2C).
NOAK
» Elektive indgreb med høj blødningsrisiko kan udføres efter pause svarende til 5 halveringstider og ved skønnet lav blødningstid 2-3 halveringstider (Grad 2C). Erfaring savnes vedr. procedurespecikke forhold.
» Nyrefunktionen er betydende for det peri- og postoperative doseringsregime (Grad 1C).
» Heparin-bridging skal ikke anvendes ved pausering med NOAK (Grad 1C).
» Livstruende blødning under behandling med Dabigatran etexilat behandles med antidoten idaruxizumab 5 g i.v. som 2 på hinanden følgende infusioner a 2,5 g (indgivet over 5-10 minutter) (Grad 1C).
» Der findes endnu ingen antidot for Xa-hæmmerne. Blødning under behandling med rivaroxaban, edoxaban og apixaban kan forsøges behandlet med blodtransfusion, friskfrosset plasma og evt. PCC 25 IE/kg, evt gentaget (Grad 2C).
» Der anbefales at neuroaxial blokade tidligst anlægges efter 5 halveringstider (afhængig af nyrefunktion) og efter fjernelse af kateteret bør der gå mindst 4-6 timer inden næste dosis administreres (Grad 2C).
Appendiks
Antitrombotiske midler
Vitamin K-antagonister


Ufraktioneret heparin

Lavmolekykære hepariner



Pentasaccharider
Parenterale, direkte trombinhæmmere

Orale, direkte trombinhæmmere

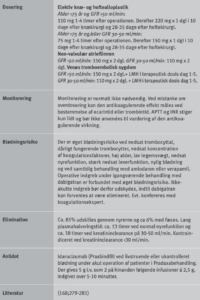
Orale, direkte faktor Xa-hæmmere

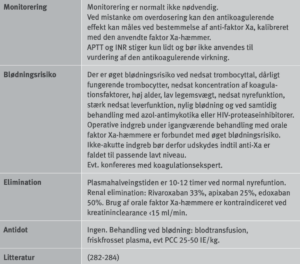

Antitrombin


Cyclooxygenasehæmmere
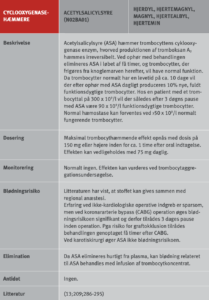
Fosfodiesterasehæmmere

ADP-receptorhæmmere


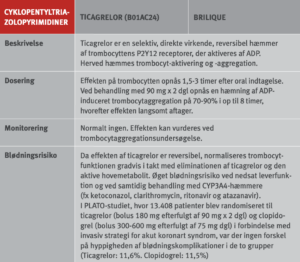


Glykoprotien IIb-IIIa hæmmere
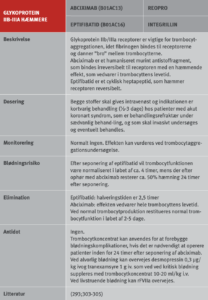
Syntetiske prostacykliner

Fibrinolytika



Litteratur
(1) Nielsen J, Husted SE, Münster AMB. Perioperativ regulering af antikoagulant behandling (PRAB-rapporten). 2011. Ref Type: Generic.
(2) Dansk Cardiologisk Selskab. Trombokardiologirapporten. 2016. Ref Type: Generic.
(3) Agnelli G, Bolis G, Capussotti L, Scarpa RM, Tonelli F, Bonizzoni E et al. A clinical outcome-based prospective study on venous thromboembolism after cancer surgery: the @RISTOS project. Ann Surg 2006; 243(1):89-95.
(4) Clagett GP, Reisch JS. Prevention of venous thromboembolism in general surgical patients. Results of meta-analysis. Ann Surg 1988; 208(2):227-240.
(5) Douketis JD, Spyropoulos AC, Kaatz S, Becker RC, Caprini JA, Dunn AS et al. Perioperative Bridging Anticoagulation in Patients with Atrial Fibrillation. N Engl J Med 2015; 373(9):823-833.
(6) Nielsen JD, Munster AB, Husted SE. [Perioperative heparin bridging is rarely indicated]. Ugeskr Laeger 2016; 178(9).
(7) Omran H, Bauersachs R, Rubenacker S, Goss F, Hammerstingl C. The HAS-BLED score predicts bleedings during bridging of chronic oral anticoagulation. Results from the national multicentre BNK Online bRiDging REgistRy (BORDER). Thromb Haemost 2012; 108(1):65-73.
(8) Douketis JD, Johnson JA, Turpie AG. Low-molecular-weight heparin as bridging anticoagulation during interruption of warfarin: assessment of a standardized periprocedural anticoagulation regimen. Arch Intern Med 2004; 164(12):1319-1326.
(9) Dunn AS, Turpie AG. Perioperative management of patients receiving oral anticoagulants: a systematic review. Arch Intern Med 2003; 163(8):901-908.
(10) Garcia DA, Regan S, Henault LE, Upadhyay A, Baker J, Othman M et al. Risk of thromboembolism with short-term interruption of warfarin therapy. Arch Intern Med 2008; 168(1):63-69.
(11) Kovacs MJ, Kearon C, Rodger M, Anderson DR, Turpie AG, Bates SM et al. Single-arm study of bridging therapy with low-molecular-weight heparin for patients at risk of arterial embolism who require temporary interruption of warfarin. Circulation 2004; 110(12):1658-1663.
(12) Douketis JD, Spyropoulos AC, Spencer FA, Mayr M, Jaffer AK, Eckman MH et al. Perioperative management of antithrombotic therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl):e326S-e350S.
(13) Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324(7329):71-86.
(14) Dansk Cardiologisk Selskab. Akut koronart syndrom. National Behandlingsvejledning, kapitel 1. 2016. Ref Type: Generic.
(15) Montalescot G, Sabatine MS. Oral dual antiplatelet therapy: what have we learnt from recent trials? Eur Heart J 2016; 37(4):344-352.
(16) Palmerini T, Stone GW. Optimal duration of dual antiplatelet therapy after drug-eluting stent implantation: conceptual evolution based on emerging evidence. Eur Heart J 2016; 37(4):353-364.
(17) Iakovou I, Schmidt T, Bonizzoni E, Ge L, Sangiorgi GM, Stankovic G et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293(17):2126-2130.
(18) Agnelli G, Bergqvist D, Cohen AT, Gallus AS, Gent M. Randomized clinical trial of postoperative fondaparinux versus perioperative dalteparin for prevention of venous thromboembolism in high-risk abdominal surgery. Br J Surg 2005; 92(10):1212-1220.
(19) A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348(9038):1329-1339.
(20) Lip GY, Windecker S, Huber K, Kirchhof P, Marin F, Ten Berg JM et al. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous coronary or valve interventions: a joint consensus document of the European Society of Cardiology Working Group on Thrombosis, European Heart Rhythm Association (EHRA), European Association of Percutaneous Cardiovascular Interventions (EAPCI) and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS) and Asia-Pacific Heart Rhythm Society (APHRS). Eur Heart J 2014; 35(45):3155-3179.
(21) Mehran R, Baber U, Steg PG, Ariti C, Weisz G, Witzenbichler B et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary intervention (PARIS): 2 year results from a prospective observational study. Lancet 2013; 382(9906):1714-1722.
(22) Eisenberg MJ, Richard PR, Libersan D, Filion KB. Safety of short-term discontinuation of antiplatelet therapy in patients with drug-eluting stents. Circulation 2009; 119(12): 1634-1642.
(23) Camm AJ, Lip GY, De Caterina R, Savelieva I, Atar D, Hohnloser SH et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation—developed with the special contribution of the European Heart Rhythm Association. Europace 2012; 14(10):1385-1413.
(24) Olesen JB, Lip GY, Hansen ML, Hansen PR, Tolstrup JS, Lindhardsen J et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ 2011; 342:d124.
(25) Segal JB, McNamara RL, Miller MR, Powe NR, Goodman SN, Robinson KA et al. Anticoagulants or antiplatelet therapy for non-rheumatic atrial fibrillation and flutter. Cochrane Database Syst Rev 2001;(1):CD001938.
(26) Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364(9):806-817.
(27) Dansk Cardiologisk Selskab. Hjerteklapsygdom. National behandlingsvejledning, kapitel 6. 2016. Ref Type: Generic
(28) Dansk Cardiologisk Selskab. Peroral antikoagulansbehandling. National behandlingsvejledning, kapitel 14. 2016. Ref Type: Generic
(29) Baudet EM, Oca CC, Roques XF, Laborde MN, Hafez AS, Collot MA et al. A 5½ year experience with the St. Jude Medical cardiac valve prosthesis. Early and late results of 737 valve replacements in 671 patients. J Thorac Cardiovasc Surg 1985; 90(1): 137-144.
(30) Stein PD, Schunemann HJ, Dalen JE, Gutterman D. Antithrombotic therapy in patients with saphenous vein and internal mammary artery bypass grafts: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):600S-608S.
(31) Salem DN, Stein PD, Al Ahmad A, Bussey HI, Horstkotte D, Miller N et al. Antithrombotic therapy in valvular heart disease—native and prosthetic: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):457S-482S.
(32) Salem DN, O’Gara PT, Madias C, Pauker SG. Valvular and structural heart disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133(6 Suppl):593S-629S.
(33) Lund O, Nielsen SL, Arildsen H, Ilkjaer LB, Pilegaard HK. [St Jude’s bi-leaflet aortic valve prosthesis throughout two decades. Quality profile and risk factors]. Ugeskr Laeger 2001; 164(1):55-60.
(34) Kvidal P, Bergstrom R, Malm T, Stahle E. Long-term follow-up of morbidity and mortality after aortic valve replacement with a mechanical valve prosthesis. Eur Heart J 2000; 21(13):1099-1111.
(35) Van de WF, Brueckmann M, Connolly SJ, Friedman J, Granger CB, Hartter S et al. A comparison of dabigatran etexilate with warfarin in patients with mechanical heart valves: THE Randomized, phase II study to evaluate the safety and pharmacokinetics of oral dabigatran etexilate in patients after heart valve replacement (RE-ALIGN). Am Heart J 2012; 163(6):931-937.
(36) Gherli T, Colli A, Fragnito C, Nicolini F, Borrello B, Saccani S et al. Comparing warfarin with aspirin after biological aortic valve replacement: a prospective study. Circulation 2004; 110(5):496-500.
(37) Sundt TM, Zehr KJ, Dearani JA, Daly RC, Mullany CJ, McGregor CG et al. Is early anticoagulation with warfarin necessary after bioprosthetic aortic valve replacement? J Thorac Cardiovasc Surg 2005; 129(5):1024-1031.
(38) Vahanian A, Alfieri O, Andreotti F, Antunes MJ, Baron-Esquivias G, Baumgartner H et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33(19):2451-2496.
(39) Jorgensen CC, Jacobsen MK, Soeballe K, Hansen TB, Husted H, Kjaersgaard-Andersen P et al. Thromboprophylaxis only during hospitalisation in fast-track hip and knee arthroplasty, a prospective cohort study. BMJ Open 2013; 3(12):e003965.
(40) Silverstein MD, Heit JA, Mohr DN, Petterson TM, O’Fallon WM, Melton LJ, III. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch Intern Med 1998; 158(6):585-593.
(41) Schulman S. Advances in the management of venous thromboembolism. Best Pract Res Clin Haematol 2012; 25(3):361-377.
(42) Siragusa S, Malato A, Anastasio R, Cigna V, Milio G, Amato C et al. Residual vein thrombosis to establish duration of anticoagulation after a first episode of deep vein thrombosis: the Duration of Anticoagulation based on Compression UltraSonography (DACUS) study. Blood 2008; 112(3):511-515.
(43) Khorana AA, Kuderer NM, Culakova E, Lyman GH, Francis CW. Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood 2008; 111(10):4902-4907.
(44) Pengo V, Ruffatti A, Legnani C, Gresele P, Barcellona D, Erba N et al. Clinical course of high-risk patients diagnosed with antiphospholipid syndrome. J Thromb Haemost 2010; 8(2):237-242.
(45) Halaby R, Popma CJ, Cohen A, Chi G, Zacarkim MR, Romero G et al. D-Dimer elevation and adverse outcomes. J Thromb Thrombolysis 2015; 39(1):55-59.
(46) Kodama J, Seki N, Fukushima C, Kusumoto T, Nakamura K, Hongo A et al. Elevated preoperative plasma D-dimer levels and the incidence of venous thromboembolism in Japanese females with gynecological cancer. Oncol Lett 2013; 5(1):299-304.
(47) Stender MT, Frokjaer JB, Larsen TB, Lundbye-Christensen S, Thorlacius-Ussing O. Preoperative plasma D-dimer is a predictor of postoperative deep venous thrombosis in colorectal cancer patients: a clinical, prospective cohort study with oneyear follow-up. Dis Colon Rectum 2009; 52(3):446-451.
(48) Spyropoulos AC, Anderson FA, Jr., Fitzgerald G, Decousus H, Pini M, Chong BH et al. Predictive and associative models to identify hospitalized medical patients at risk for VTE. Chest 2011; 140(3):706-714.
(49) Mahan CE, Liu Y, Turpie AG, Vu JT, Heddle N, Cook RJ et al. External validation of a risk assessment model for venous thromboembolism in the hospitalised acutely-ill medical patient (VTE-VALOURR). Thromb Haemost 2014; 112(4):692-699.
(50) Khorana AA, McCrae KR. Risk stratification strategies for cancer-associated thrombosis: an update. Thromb Res 2014; 133 Suppl 2:S35-S38.
(51) Ay C, Simanek R, Vormittag R, Dunkler D, Alguel G, Koder S et al. High plasma levels of soluble P-selectin are predictive of venous thromboembolism in cancer patients: results from the Vienna Cancer and Thrombosis Study (CATS). Blood 2008; 112(7):2703-2708.
(52) Moore RA, Adel N, Riedel E, Bhutani M, Feldman DR, Tabbara NE et al. High incidence of thromboembolic events in patients treated with cisplatinbased chemotherapy: a large retrospective analysis. J Clin Oncol 2011; 29(25):3466-3473.
(53) Verso M, Agnelli G, Barni S, Gasparini G, LaBianca R. A modified Khorana risk assessment score for venous thromboembolism in cancer patients receiving chemotherapy: the Protecht score. Intern Emerg Med 2012; 7(3):291-292.
(54) Segal JB, Dzik WH. Paucity of studies to support that abnormal coagulation test results predict bleeding in the setting of invasive procedures: an evidencebased review. Transfusion 2005; 45(9):1413-1425.
(55) Peterson P, Hayes TE, Arkin CF, Bovill EG, Fairweather RB, Rock WA, Jr. et al. The preoperative bleeding time test lacks clinical benefit: College of American Pathologists’ and American Society of Clinical Pathologists’ position article. Arch Surg 1998; 133(2):134-139.
(56) Sibbing D, Braun S, Morath T, Mehilli J, Vogt W, Schomig A et al. Platelet reactivity after clopidogrel treatment assessed with point-of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol 2009; 53(10):849-856.
(57) Solbeck S, Meyer MA, Johansson PI, Meyer AS, Cotton BA, Stensballe J et al. Monitoring of dabigatran anticoagulation and its reversal in vitro by thrombelastography. Int J Cardiol 2014; 176(3):794-799.
(58) Dias JD, Norem K, Doorneweerd DD, Thurer RL, Popovsky MA, Omert LA. Use of Thromboelastography (TEG) for Detection of New Oral Anticoagulants. Arch Pathol Lab Med 2015; 139(5):665-673.
(59) Casutt M, Konrad C, Schuepfer G. Effect of rivaroxaban on blood coagulation using the viscoelastic coagulation test ROTEM. Anaesthesist 2012; 61(11):948-953.
(60) Heit JA. Perioperative management of the chronically anticoagulated patient. J Thromb Thrombolysis 2001; 12(1):81-87.
(61) Beinart R, Abu SR, Segev A, Hod H, Guetta V, Shechter M et al. The incidence and clinical predictors of early stent thrombosis in patients with acute coronary syndrome. Am Heart J 2010; 159(1):118-124.
(62) Waite LH, Phan YL, Spinler SA. Cangrelor: a novel intravenous antiplatelet agent with a questionable future. Pharmacotherapy 2014; 34(10):1061-1076.
(63) Warshauer J, Patel VG, Christopoulos G, Kotsia AP, Banerjee S, Brilakis ES. Outcomes of preoperative bridging therapy for patients undergoing surgery after coronary stent implantation: a weighted meta-analysis of 280 patients from eight studies. Catheter Cardiovasc Interv 2015; 85(1):25-31.
(64) Capodanno D, Musumeci G, Lettieri C, Limbruno U, Senni M, Guagliumi G et al. Impact of bridging with perioperative low-molecular-weight heparin on cardiac and bleeding outcomes of stented patients undergoing non-cardiac surgery. Thromb Haemost 2015; 114(2):423-431.
(65) Kearon C, Hirsh J. Management of anticoagulation before and after elective surgery. N Engl J Med 1997; 336(21):1506-1511.
(66) Siegal D, Yudin J, Kaatz S, Douketis JD, Lim W, Spyropoulos AC. Periprocedural heparin bridging in patients receiving vitamin K antagonists: systematic review and meta-analysis of bleeding and thromboembolic rates. Circulation 2012; 126(13):1630-1639.
(67) Clark NP, Witt DM, Davies LE, Saito EM, McCool KH, Douketis JD et al. Bleeding, Recurrent Venous Thromboembolism, and Mortality Risks During Warfarin Interruption for Invasive Procedures. JAMA Intern Med 2015; 175(7):1163-1168.
(68) Steinberg BA, Peterson ED, Kim S, Thomas L, Gersh BJ, Fonarow GC et al. Use and outcomes associated with bridging during anticoagulation interruptions in patients with atrial fibrillation: findings from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF). Circulation 2015; 131(5):488-494.
(69) Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12):1139-1151.
(70) Torn M, Rosendaal FR. Oral anticoagulation in surgical procedures: risks and recommendations. Br J Haematol 2003; 123(4):676-682.
(71) Sundhedsstyrelsen. National klinisk retningslinje for Indikation for transfusion med blodkomponenter. 2014. Ref Type: Generic.
(72) Sundhedsstyrelsen. Vejledning om blodtransfusion. 1-23. 2015. Ref Type: Generic.
(73) Collyer TC, Gray DJ, Sandhu R, Berridge J, Lyons G. Assessment of platelet inhibition secondary to clopidogrel and aspirin therapy in preoperative acute surgical patients measured by Thrombelastography Platelet Mapping. Br J Anaesth 2009; 102(4):492-498.
(74) Velik-Salchner C, Maier S, Innerhofer P, Streif W, Klingler A, Kolbitsch C et al. Point-of-care whole blood impedance aggregometry versus classical light transmission aggregometry for detecting aspirin and clopidogrel: the results of a pilot study. Anesth Analg 2008; 107(6):1798-1806.
(75) Reiter RA, Mayr F, Blazicek H, Galehr E, Jilma-Stohlawetz P, Domanovits H et al. Desmopressin antagonizes the in vitro platelet dysfunction induced by GPIIb/IIIa inhibitors and aspirin. Blood 2003; 102(13):4594-4599.
(76) Carless PA, Henry DA, Carson JL, Hebert PP, McClelland B, Ker K. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst Rev 2010;(10):CD002042.
(77) Rohde JM, Dimcheff DE, Blumberg N, Saint S, Langa KM, Kuhn L et al. Health careassociated infection after red blood cell transfusion: a systematic review and meta-analysis. JAMA 2014; 311(13):1317-1326.
(78) Salpeter SR, Buckley JS, Chatterjee S. Impact of more restrictive blood transfusion strategies on clinical outcomes: a meta-analysis and systematic review. Am J Med 2014; 127(2):124-131.
(79) Villanueva C, Colomo A, Bosch A, Concepcion M, Hernandez-Gea V, Aracil C et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013; 368(1):11-21.
(80) Franchini M. The use of desmopressin as a hemostatic agent: a concise review. Am J Hematol 2007; 82(8):731-735.
(81) Lethagen S. Desmopressin in mild hemophilia A: indications, limitations, efficacy, and safety. Semin Thromb Hemost 2003; 29(1):101-106.
(82) Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet 2010; 376(9734):23-32.
(83) Pleym H, Stenseth R, Wahba A, Bjella L, Karevold A, Dale O. Single-dose tranexamic acid reduces postoperative bleeding after coronary surgery in patients treated with aspirin until surgery. Anesth Analg 2003; 96(4):923-8, table.
(84) Pleym H. [Drugs to reduce transfusion needs during surgery]. Tidsskr Nor Laegeforen 2008; 128(7):829-830.
(85) Keyhani S, Esmailiejah AA, Abbasian MR, Safdari F. Which Route of Tranexamic Acid Administration is More Effective to Reduce Blood Loss Following Total Knee Arthroplasty? Arch Bone Jt Surg 2016; 4(1):65-69.
(86) Sindet-Pedersen S. Haemostasis in oral surgery—the possible pathogenetic implications of oral fibrinolysis on bleeding. Experimental and clinical studies of the haemostatic balance in the oral cavity, with particular reference to patients with acquired and congenital defects of the coagulation system. Dan Med Bull 1991; 38(6):427-443.
(87) Spahn DR, Bouillon B, Cerny V, Coats TJ, Duranteau J, FernandezMondejar E et al. Management of bleeding and coagulopathy following major trauma: an updated European guideline. Crit Care 2013; 17(2):R76.
(88) Levi M, Moore KT, Castillejos CF, Kubitza D, Berkowitz SD, Goldhaber SZ et al. Comparison of three-factor and four-factor prothrombin complex concentrates regarding reversal of the anticoagulant effects of rivaroxaban in healthy volunteers. J Thromb Haemost 2014; 12(9):1428-1436.
(89) Zahir H, Brown KS, Vandell AG, Desai M, Maa JF, Dishy V et al. Edoxaban effects on bleeding following punch biopsy and reversal by a 4-factor prothrombin complex concentrate. Circulation 2015; 131(1):82-90.
(90) Beynon C, Sakowitz OW, Storzinger D, Orakcioglu B, Radbruch A, Potzy A et al. Intracranial haemorrhage in patients treated with direct oral anticoagulants. Thromb Res 2015; 136(3):560-565.
(91) Pernod G, Albaladejo P, Godier A, Samama CM, Susen S, Gruel Y et al. Management of major bleeding complications and emergency surgery in patients on long-term treatment with direct oral anticoagulants, thrombin or factor-Xa inhibitors: proposals of the working group on perioperative haemostasis (GIHP) – March 2013. Arch Cardiovasc Dis 2013; 106(6- 7):382-393.
(92) Rossaint R, Bouillon B, Cerny V, Coats TJ, Duranteau J, Fernandez-Mondejar E et al. Management of bleeding following major trauma: an updated European guideline. Crit Care 2010; 14(2):R52.
(93) Levi M, Levy JH, Andersen HF, Truloff D. Safety of recombinant activated factor VII in randomized clinical trials. N Engl J Med 2010; 363(19):1791-1800.
(94) OWREN PA, AAS K. The control of dicumarol therapy and the quantitative determination of prothrombin and proconvertin. Scand J Clin Lab Invest 1951; 3(3):201-208.
(95) Jespersen J, Hansen MS, Dyerberg J, Ingerslev J, Jensen G, Jorgensen M et al. [Standardized prothrombin time determinations and optimal anticoagulant therapy]. Ugeskr Laeger 1991; 153(5):355-360.
(96) International Committee for Standardization in Haematology, International Committee on Thrombosis and Haemostasis: ICSH/ICTH recommendations for reporting prothrombin time in oral anticoagulant control. Thromb Haemost 1985; 53(1):155-156.
(97) Cannegieter SC, Rosendaal FR, Wintzen AR, van der Meer FJ, Vandenbroucke JP, Briet E. Optimal oral anticoagulant therapy in patients with mechanical heart valves. N Engl J Med 1995; 333(1):11-17.
(98) Hylek EM, Singer DE. Risk factors for intracranial hemorrhage in outpatients taking warfarin. Ann Intern Med 1994; 120(11):897-902.
(99) Fihn SD, McDonell M, Martin D, Henikoff J, Vermes D, Kent D et al. Risk factors for complications of chronic anticoagulation. A multicenter study. Warfarin Optimized Outpatient Follow-up Study Group. Ann Intern Med 1993; 118(7):511-520.
(100) Palareti G, Leali N, Coccheri S, Poggi M, Manotti C, D’Angelo A et al. Bleeding complications of oral anticoagulant treatment: an inception-cohort, prospective collaborative study (ISCOAT). Italian Study on Complications of Oral Anticoagulant Therapy. Lancet 1996; 348(9025):423-428.
(101) Segal JB, McNamara RL, Miller MR, Kim N, Goodman SN, Powe NR et al. Prevention of thromboembolism in atrial fibrillation. A meta-analysis of trials of anticoagulants and antiplatelet drugs. J Gen Intern Med 2000; 15(1):56-67.
(102) Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk of major bleeding in outpatients treated with warfarin. Am J Med 1998; 105(2):91-99.
(103) Saour JN, Sieck JO, Mamo LA, Gallus AS. Trial of different intensities of anticoagulation in patients with prosthetic heart valves. N Engl J Med 1990; 322(7):428-432.
(104) Wells PS, Forgie MA, Simms M, Greene A, Touchie D, Lewis G et al. The outpatient bleeding risk index: validation of a tool for predicting bleeding rates in patients treated for deep venous thrombosis and pulmonary embolism. Arch Intern Med 2003; 163(8):917-920.
(105) Cheng HY. Is age a risk factor for warfarin-related major bleeds in elderly patients with atrial fibrillation? J Am Geriatr Soc 2006; 54(7):1155.
(106) McCormick D, Gurwitz JH, Goldberg RJ, Ansell J. Longterm anticoagulation therapy for atrial fibrillation in elderly patients: efficacy, risk, and current patterns of use. J Thromb Thrombolysis 1999; 7(2):157-163.
(107) Fang MC, Chang Y, Hylek EM, Rosand J, Greenberg SM, Go AS et al. Advanced age, anticoagulation intensity, and risk for intracranial hemorrhage among patients taking warfarin for atrial fibrillation. Ann Intern Med 2004; 141(10):745-752.
(108) Katz J, Feldman MA, Bass EB, Lubomski LH, Tielsch JM, Petty BG et al. Risks and benefits of anticoagulant and antiplatelet medication use before cataract surgery. Ophthalmology 2003; 110(9):1784-1788.
(109) Hall DL, Steen WH, Jr., Drummond JW, Byrd WA. Anticoagulants and cataract surgery. Ophthalmic Surg 1988; 19(3):221-222.
(110) Konstantatos A. Anticoagulation and cataract surgery: a review of the current literature. Anaesth Intensive Care 2001; 29(1):11-18.
(111) McCormack P, Simcock PR, Tullo AB. Management of the anticoagulated patient for ophthalmic surgery. Eye 1993; 7 (Pt 6):749-750.
(112) Blinder D, Manor Y, Martinowitz U, Taicher S. Dental extractions in patients maintained on oral anticoagulant therapy: comparison of INR value with occurrence of postoperative bleeding. Int J Oral Maxillofac Surg 2001; 30(6):518-521.
(113) Campbell JH, Alvarado F, Murray RA. Anticoagulation and minor oral surgery: should the anticoagulation regimen be altered? J Oral Maxillofac Surg 2000; 58(2):131-135.
(114) Carter G, Goss A. Tranexamic acid mouthwash—a prospective randomized study of a 2-day regimen vs 5-day regimen to prevent postoperative bleeding in anticoagulated patients requiring dental extractions. Int J Oral Maxillofac Surg 2003; 32(5):504-507.
(115) Souto JC, Oliver A, Zuazu-Jausoro I, Vives A, Fontcuberta J. Oral surgery in anticoagulated patients without reducing the dose of oral anticoagulant: a prospective randomized study. J Oral Maxillofac Surg 1996; 54(1):27-32.
(116) Todd DW. Anticoagulated patients and oral surgery. Arch Intern Med 2003; 163(10):1242.
(117) Wahl MJ. Dental surgery in anticoagulated patients. Arch Intern Med 1998; 158(15):1610-1616.
(118) Wahl MJ. Myths of dental surgery in patients receiving anticoagulant therapy. J Am Dent Assoc 2000; 131(1):77-81.
(119) Webster K, Wilde J. Management of anticoagulation in patients with prosthetic heart valves undergoing oral and maxillofacial operations. Br J Oral Maxillofac Surg 2000; 38(2): 124-126.
(120) Weibert RT. Oral anticoagulant therapy in patients undergoing dental surgery. Clin Pharm 1992; 11(10):857-864.
(121) Zanon E, Martinelli F, Bacci C, Cordioli G, Girolami A. Safety of dental extraction among consecutive patients on oral anticoagulant treatment managed using a specific dental management protocol. Blood Coagul Fibrinolysis 2003; 14(1):27-30.
(122) Kramer E, Hadad E, Westreich M, Shalom A. Lack of complications in skin surgery of patients receiving clopidogrel as compared with patients taking aspirin, warfarin, and controls. Am Surg 2010; 76(1):11-14.
(123) Lewis KG, Dufresne RG, Jr. A meta-analysis of complications attributed to anticoagulation among patients following cutaneous surgery. Dermatol Surg 2008; 34(2):160-164.
(124) Alcalay J. Cutaneous surgery in patients receiving warfarin therapy. Dermatol Surg 2001; 27(8):756-758.
(125) Otley CC, Fewkes JL, Frank W, Olbricht SM. Complications of cutaneous surgery in patients who are taking warfarin, aspirin, or nonsteroidal anti-inflammatory drugs. Arch Dermatol 1996; 132(2):161-166.
(126) Billingsley EM, Maloney ME. Intraoperative and postoperative bleeding problems in patients taking warfarin, aspirin, and nonsteroidal antiinflammatory agents. A prospective study. Dermatol Surg 1997; 23(5): 381-383.
(127) Kargi E, Babuccu O, Hosnuter M, Babuccu B, Altinyazar C. Complications of minor cutaneous surgery in patients under anticoagulant treatment. Aesthetic Plast Surg 2002; 26(6):483-485.
(128) Syed S, Adams BB, Liao W, Pipitone M, Gloster H. A prospective assessment of bleeding and international normalized ratio in warfarin-anticoagulated patients having cutaneous surgery. J Am Acad Dermatol 2004; 51(6):955-957.
(129) Alcalay J, Alkalay R. Controversies in perioperative management of blood thinners in dermatologic surgery: continue or discontinue? Dermatol Surg 2004; 30(8):1091-1094.
(130) Bunick CG, Aasi SZ. Hemorrhagic complications in dermatologic surgery. Dermatol Ther 2011; 24(6):537-550.
(131) Cheng M, Hua W, Chen K, Pu J, Ren X, Zhao X et al. Perioperative anticoagulation for patients with mechanic heart valve(s) undertaking pacemaker implantation. Europace 2009; 11(9):1183-1187.
(132) Goldstein DJ, Losquadro W, Spotnitz HM. Outpatient pacemaker procedures in orally anticoagulated patients. Pacing Clin Electrophysiol 1998; 21(9): 1730-1734.
(133) Ahmed I, Gertner E, Nelson WB, House CM, Dahiya R, Anderson CP et al. Continuing warfarin therapy is superior to interrupting warfarin with or without bridging anticoagulation therapy in patients undergoing pacemaker and defibrillator implantation. Heart Rhythm 2010; 7(6):745-749.
(134) Thal S, Moukabary T, Boyella R, Shanmugasundaram M, Pierce MK, Thai H et al. The relationship between warfarin, aspirin, and clopidogrel continuation in the peri-procedural period and the incidence of hematoma formation after device implantation. Pacing Clin Electrophysiol 2010; 33(4):385-388.
(135) Birnie DH, Healey JS, Wells GA, Verma A, Tang AS, Krahn AD et al. Pacemaker or defibrillator surgery without interruption of anticoagulation. N Engl J Med 2013; 368(22):2084-2093.
(136) Sant’anna RT, Leiria TL, Nascimento T, Sant’anna JR, Kalil RA, Lima GG et al. Metaanalysis of continuous oral anticoagulants versus heparin bridging in patients undergoing CIED surgery: reappraisal after the BRUISE study. Pacing Clin Electrophysiol 2015; 38(4):417-423.
(137) Yang X, Wang Z, Zhang Y, Yin X, Hou Y. The safety and efficacy of antithrombotic therapy in patients undergoing cardiac rhythm device implantation: a meta-analysis. Europace 2015; 17(7):1076-1084.
(138) Sticherling C, Marin F, Birnie D, Boriani G, Calkins H, Dan GA et al. Antithrombotic management in patients undergoing electrophysiological procedures: a European Heart Rhythm Association (EHRA) position document endorsed by the ESC Working Group Thrombosis, Heart Rhythm Society (HRS), and Asia Pacific Heart Rhythm Society (APHRS). Europace 2015; 17(8):1197-1214.
(139) Salvati G, Punzi L, Pianon M, Valvason C, Schiavon F, Noal N et al. [Frequency of the bleeding risk in patients receiving warfarin submitted to arthrocentesis of the knee]. Reumatismo 2003; 55(3):159-163.
(140) Thumboo J, O’Duffy JD. A prospective study of the safety of joint and soft tissue aspirations and injections in patients taking warfarin sodium. Arthritis Rheum 1998; 41(4):736-739.
(141) Ahmed I, Gertner E. Safety of arthrocentesis and joint injection in patients receiving anticoagulation at therapeutic levels. Am J Med 2012; 125(3):265-269. (142) Bain BJ. Bone marrow biopsy morbidity and mortality. Br J Haematol 2003; 121(6):949-951.
(143) Bain BJ. Morbidity associated with bone marrow aspiration and trephine biopsy – a review of UK data for 2004. Haematologica 2006; 91(9):1293-1294.
(144) Eikelboom JW. Bone marrow biopsy in thrombocytopenic or anticoagulated patients. Br J Haematol 2005; 129(4):562-563.
(145) Chowdhury R, Abbas A, Idriz S, Hoy A, Rutherford EE, Smart JM. Should warfarin or aspirin be stopped prior to prostate biopsy? An analysis of bleeding complications related to increasing sample number regimes. Clin Radiol 2012; 67(12):e64-e70.
(146) Kingston TE, Nonnenmacher AK, Crowe H, Costello AJ, Street A. Further evaluation of transurethral laser ablation of the prostate in patients treated with anticoagulant therapy. Aust N Z J Surg 1995; 65(1):40-43.
(147) El Hakim A, Moussa S. CUA guidelines on prostate biopsy methodology. Can Urol Assoc J 2010; 4(2):89-94.
(148) Gerson LB, Gage BF, Owens DK, Triadafilopoulos G. Effect and outcomes of the ASGE guidelines on the periendoscopic management of patients who take anticoagulants. Am J Gastroenterol 2000; 95(7): 1717-1724.
(149) Friedland S, Soetikno R. Colonoscopy with polypectomy in anticoagulated patients. Gastrointest Endosc 2006; 64(1):98-100.
(150) Hui AJ, Wong RM, Ching JY, Hung LC, Chung SC, Sung JJ. Risk of colonoscopic polypectomy bleeding with anticoagulants and antiplatelet agents: analysis of 1657 cases. Gastrointest Endosc 2004; 59(1):44-48.
(151) Kjeldsen J, Pless T, Meisner S, Bytzer P. [Endoscopy in patients receiving anticoagulation or antiplatelet therapy]. Ugeskr Laeger 2009; 171(17):1384-1386.
(152) Anderson MA, Ben Menachem T, Gan SI, Appalaneni V, Banerjee S, Cash BD et al. Management of antithrombotic agents for endoscopic procedures. Gastrointest Endosc 2009; 70(6):1060-1070.
(153) Veitch AM, Vanbiervliet G, Gershlick AH, Boustiere C, Baglin TP, Smith LA et al. Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines. Endoscopy 2016; 48(4):385-402.
(154) Chana R, Salmon L, Waller A, Pinczewski L. Warfarin management in patients on continuous anticoagulation therapy undergoing total knee replacement. J Bone Joint Surg Br 2011; 93(11):1497-1502.
(155) Phillips A, Dan M, Schaefer N, Randle R. Warfarin cessation is non-essential in patients undergoing total knee arthroplasty—a case-control study. J Orthop Surg Res 2015; 10:16.
(156) Rhodes DA, Severson EP, Hodrick JT, Dunn HK, Hofmann AA. Discontinuation of warfarin is unnecessary in total knee arthroplasty. Clin Orthop Relat Res 2010; 468(1):120-126.
(157) Larson BJ, Zumberg MS, Kitchens CS. A feasibility study of continuing dose-reduced warfarin for invasive procedures in patients with high thromboembolic risk. Chest 2005; 127(3):922-927.
(158) Simpson PM, Brew CJ, Whitehouse SL, Crawford RW, Donnelly BJ. Complications of perioperative warfarin therapy in total knee arthroplasty. J Arthroplasty 2014; 29(2):320-324.
(159) Di Biase L, Burkhardt JD, Santangeli P, Mohanty P, Sanchez JE, Horton R et al. Periprocedural stroke and bleeding complications in patients undergoing catheter ablation of atrial fibrillation with different anticoagulation management: results from the Role of Coumadin in Preventing Thromboembolism in Atrial Fibrillation (AF) Patients Undergoing Catheter Ablation (COMPARE) randomized trial. Circulation 2014; 129(25): 2638-2644.
(160) Wallace DL, Latimer MD, Belcher HJ. Stopping warfarin therapy is unnecessary for hand surgery. J Hand Surg [Br ] 2004; 29(3):203-205.
(161) Wentzien TH, O’Reilly RA, Kearns PJ. Prospective evaluation of anticoagulant reversal with oral vitamin K1 while continuing warfarin therapy unchanged. Chest 1998; 114(6):1546-1550.
(162) Lubetsky A, Yonath H, Olchovsky D, Loebstein R, Halkin H, Ezra D. Comparison of oral vs intravenous phytonadione (vitamin K1) in patients with excessive anticoagulation: a prospective randomized controlled study. Arch Intern Med 2003; 163(20):2469-2473.
(163) Ozgonenel B, O’Malley B, Krishen P, Eisenbrey AB. Warfarin reversal emerging as the major indication for fresh frozen plasma use at a tertiary care hospital. Am J Hematol 2007; 82(12):1091-1094.
(164) Lutze G, Heim M. Comparative Investigation of Prothrombin Complex Concentrates: Differences in Levels of Markers Indicating Activation of Coagulation. J.Thromb.Haemost. 3[Suppl.1], P1253. 2005. Ref Type: Abstract
(165) Riess HB, Meier-Hellmann A, Motsch J, Elias M, Kursten FW, Dempfle CE. Prothrombin complex concentrate (Octaplex) in patients requiring immediate reversal of oral anticoagulation. Thromb Res 2007; 121(1):9-16.
(166) Yasaka M, Sakata T, Minematsu K, Naritomi H. Correction of INR by prothrombin complex concentrate and vitamin K in patients with warfarin related hemorrhagic complication. Thromb Res 2003; 108(1):25-30.
(167) Glund S, Moschetti V, Norris S, Stangier J, Schmohl M, van Ryn J et al. A randomised study in healthy volunteers to investigate the safety, tolerability and pharmacokinetics of idarucizumab, a specific antidote to dabigatran. Thromb Haemost 2015; 113(5):943-951.
(168) Pollack CV, Jr., Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA et al. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373(6):511-520.
(169) Grandhi R, Newman WC, Zhang X, Harrison G, Moran C, Okonkwo DO et al. Administration of 4-Factor Prothrombin Complex Concentrate as an Antidote for Intracranial Bleeding in Patients Taking Direct Factor Xa Inhibitors. World Neurosurg 2015; 84(6):1956-1961.
(170) Siegal DM, Curnutte JT, Connolly SJ, Lu G, Conley PB, Wiens BL et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med 2015; 373(25):2413-2424.
(171) Gomez-Outes A, Suarez-Gea ML, Lecumberri R, TerleiraFernandez AI, Vargas-Castrillon E. Specific antidotes in development for reversal of novel anticoagulants: a review. Recent Pat Cardiovasc Drug Discov 2014; 9(1):2-10.
(172) Moen V, Dahlgren N, Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990- 1999. Anesthesiology 2004; 101(4):950-959.
(173) Moen V, Irestedt L, Dahlgren N. Major complications of central neuraxial block: the Third National Audit Project: some comments and questions. Br J Anaesth 2009; 103(1): 130-131.
(174) Neal JM, Barrington MJ, Brull R, Hadzic A, Hebl JR, Horlocker TT et al. The Second ASRA Practice Advisory on Neurologic Complications Associated With Regional Anesthesia and Pain Medicine: Executive Summary 2015. Reg Anesth Pain Med 2015; 40(5):401-430.
(175) Breivik H, Bang U, Jalonen J, Vigfusson G, Alahuhta S, Lagerkranser M. Nordic guidelines for neuraxial blocks in disturbed haemostasis from the Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesthesiol Scand 2010; 54(1):16-41.
(176) Cullen DJ, Bogdanov E, Htut N. Spinal epidural hematoma occurrence in the absence of known risk factors: a case series. J Clin Anesth 2004; 16(5):376-381.
(177) Vandermeulen EP, Van Aken H, Vermylen J. Anticoagulants and spinal-epidural anesthesia. Anesth Analg 1994; 79(6): 1165-1177.
(178) Wulf H. Epidural anaesthesia and spinal haematoma. Can J Anaesth 1996; 43(12):1260-1271.
(179) Tyagi A, Bhattacharya A. Central neuraxial blocks and anticoagulation: a review of current trends. Eur J Anaesthesiol 2002; 19(5):317-329.
(180) Horlocker TT, Wedel DJ, Benzon H, Brown DL, Enneking FK, Heit JA et al. Regional anesthesia in the anticoagulated patient: defining the risks. Reg Anesth Pain Med 2004; 29(2 Suppl 1):1-11.
(181) Vandermeulen E, Singelyn F, Vercauteren M, Brichant JF, Ickx BE, Gautier P. Belgian guidelines concerning central neural blockade in patients with drug-induced alteration of coagulation: an update. Acta Anaesthesiol Belg 2005; 56(2):139-146.
(182) Horlocker TT, Wedel DJ, Rowlingson JC, Enneking FK, Kopp SL, Benzon HT et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg Anesth Pain Med 2010; 35(1):64-101.
(183) Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, Samama CM. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27(12): 999-1015.
(184) Benzon HT, Avram MJ, Green D, Bonow RO. New oral anticoagulants and regional anaesthesia. Br J Anaesth 2013; 111 Suppl 1:i96-113.
(185) Poldermans D, Bax JJ, Boersma E, De Hert S, Eeckhout E, Fowkes G et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in noncardiac surgery: the Task Force for Preoperative Cardiac Risk Assessment and Perioperative Cardiac Management in Noncardiac Surgery of the European Society of Cardiology (ESC) and endorsed by the European Society of Anaesthesiology (ESA). Eur J Anaesthesiol 2010; 27(2):92-137.
(186) Tryba M, Wedel DJ. Central neuraxial block and low molecular weight heparin (enoxaparine): lessons learned from different dosage regimes in two continents. Acta Anaesthesiol Scand Suppl 1997; 111:100-104.
(187) Ain RJ, Vance MB. Epidural hematoma after epidural steroid injection in a patient withholding enoxaparin per guidelines. Anesthesiology 2005; 102(3):701-703.
(188) Horlocker TT, Wedel DJ, Benzon H, Brown DL, Enneking FK, Heit JA et al. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation). Reg Anesth Pain Med 2003; 28(3):172-197.
(189) Odoom JA, Sih IL. Epidural analgesia and anticoagulant therapy. Experience with one thousand cases of continuous epidurals. Anaesthesia 1983; 38(3):254-259.
(190) Parvizi J, Viscusi ER, Frank HG, Sharkey PF, Hozack WJ, Rothman RR. Can epidural anesthesia and warfarin be coadministered? Clin Orthop Relat Res 2007; 456:133-137.
(191) Li J, Halaszynski T. Neuraxial and peripheral nerve blocks in patients taking anticoagulant or thromboprophylactic drugs: challenges and solutions. Local Reg Anesth 2015; 8:21-32.
(192) Narouze S, Benzon HT, Provenzano DA, Buvanendran A, De Andres J, Deer TR et al. Interventional spine and pain procedures in patients on antiplatelet and anticoagulant medications: guidelines from the American Society of Regional Anesthesia and Pain Medicine, the European Society of Regional Anaesthesia and Pain Therapy, the American Academy of Pain Medicine, the International Neuromodulation Society, the North American Neuromodulation Society, and the World Institute of Pain. Reg Anesth Pain Med 2015; 40(3):182-212.
(193) Vandermeulen E. Anaesthesia and new antithrombotic drugs. Curr Opin Anaesthesiol 2005; 18(3):353-359.
(194) Kwok A, Faigel DO. Management of anticoagulation before and after gastrointestinal endoscopy. Am J Gastroenterol 2009; 104(12):3085-3097.
(195) Yao MD, von Rosenvinge EC, Groden C, Mannon PJ. Multiple endoscopic biopsies in research subjects: safety results from a National Institutes of Health series. Gastrointest Endosc 2009; 69(4):906-910.
(196) Sorbi D, Norton I, Conio M, Balm R, Zinsmeister A, Gostout CJ. Postpolypectomy lower GI bleeding: descriptive analysis. Gastrointest Endosc 2000; 51(6):690-696.
(197) DiPrima RE, Barkin JS, Blinder M, Goldberg RI, Phillips RS. Age as a risk factor in colonoscopy: fact versus fiction. Am J Gastroenterol 1988; 83(2):123-125.
(198) Nelson DB, Freeman ML. Major hemorrhage from endoscopic sphincterotomy: risk factor analysis. J Clin Gastroenterol 1994; 19(4):283-287.
(199) Matsumura T, Arai M, Maruoka D, Okimoto K, Minemura S, Ishigami H et al. Risk factors for early and delayed post-operative bleeding after endoscopic submucosal dissection of gastric neoplasms, including patients with continued use of antithrombotic agents. BMC Gastroenterol 2014; 14:172.
(200) Kim HS, Kim TI, Kim WH, Kim YH, Kim HJ, Yang SK et al. Risk factors for immediate postpolypectomy bleeding of the colon: a multicenter study. Am J Gastroenterol 2006; 101(6):1333-1341.
(201) Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. Risk factors for severe delayed postpolypectomy bleeding. Endoscopy 2008; 40(2):115-119.
(202) Constans M, Santamaria A, Mateo J, Pujol N, Souto JC, Fontcuberta J. Low-molecularweight heparin as bridging therapy during interruption of oral anticoagulation in patients undergoing colonoscopy or gastroscopy. Int J Clin Pract 2007; 61(2):212-217.
(203) Yousfi M, Gostout CJ, Baron TH, Hernandez JL, Keate R, Fleischer DE et al. Postpolypectomy lower gastrointestinal bleeding: potential role of aspirin. Am J Gastroenterol 2004; 99(9): 1785-1789.
(204) Boustiere C, Veitch A, Vanbiervliet G, Bulois P, Deprez P, Laquiere A et al. Endoscopy and antiplatelet agents. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2011; 43(5):445-461.
(205) Singh M, Mehta N, Murthy UK, Kaul V, Arif A, Newman N. Postpolypectomy bleeding in patients undergoing colonoscopy on uninterrupted clopidogrel therapy. Gastrointest Endosc 2010; 71(6):998-1005.
(206) Acosta RD, Abraham NS, Chandrasekhara V, Chathadi KV, Early DS, Eloubeidi MA et al. The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc 2016; 83(1):3-16.
(207) Facciolongo N, Patelli M, Gasparini S, Lazzari AL, Salio M, Simonassi C et al. Incidence of complications in bronchoscopy. Multicentre prospective study of 20,986 bronchoscopies. Monaldi Arch Chest Dis 2009; 71(1):8-14. (S. 86) Jenssen C Ultrashall Med 2016; 37: 157-69. (S. 86) Wang, Gastrointest Endosc 2011; 73:283-90.
(208) Kozak EA, Brath LK. Do “screening” coagulation tests predict bleeding in patients undergoing fiberoptic bronchoscopy with biopsy? Chest 1994; 106(3): 703-705.
(209) Herth FJ, Becker HD, Ernst A. Aspirin does not increase bleeding complications after transbronchial biopsy. Chest 2002; 122(4):1461-1464.
(210) Cordasco EM, Jr., Mehta AC, Ahmad M. Bronchoscopically induced bleeding. A summary of nine years’ Cleveland clinic experience and review of the literature. Chest 1991; 100(4):1141-1147.
(211) British Thoracic Society guidelines on diagnostic flexible bronchoscopy. Thorax 2001; 56 Suppl 1:i1-21.
(212) Mehta NL, Harkin TJ, Rom WN, Graap WET, Addrizzo-Harris DJ. Should Renal Insufficiency Be a Relative Contraindication to Bronchoscopic Biopsy? Jounal of Bronchology 2005; 12(2):81-83.
(213) Weiss SM, Hert RC, Gianola FJ, Clark JG, Crawford SW. Complications of fiberoptic bronchoscopy in thrombocytopenic patients. Chest 1993; 104(4):1025-1028.
(214) Nandagopal L, Veeraputhiran M, Jain T, Soubani AO, Schiffer CA. Bronchoscopy can be done safely in patients with thrombocytopenia. Transfusion 2016; 56(2):344-348.
(215) Du R, I, Blaikley J, Booton R, Chaudhuri N, Gupta V, Khalid S et al. British Thoracic Society guideline for diagnostic flexible bronchoscopy in adults: accredited by NICE. Thorax 2013; 68 Suppl 1:i1-i44.
(216) Wahidi MM, Rocha AT, Hollingsworth JW, Govert JA, Feller-Kopman D, Ernst A. Contraindications and safety of transbronchial lung biopsy via flexible bronchoscopy. A survey of pulmonologists and review of the literature. Respiration 2005; 72(3):285-295.
(217) Ernst A, Eberhardt R, Wahidi M, Becker HD, Herth FJ. Effect of routine clopidogrel use on bleeding complications after transbronchial biopsy in humans. Chest 2006; 129(3):734-737.
(218) Stather DR, MacEachern P, Chee A, Tremblay A. Safety of endobronchial ultrasoundguided transbronchial needle aspiration for patients taking clopidogrel: a report of 12 consecutive cases. Respiration 2012; 83(4):330-334.
(219) O’Connor SD, Taylor AJ, Williams EC, Winter TC. Coagulation concepts update. AJR Am J Roentgenol 2009; 193(6): 1656-1664.
(220) Shaw PH, Reynolds S, Gunawardena S, Krishnamurti L, Ritchey AK. The prevalence of bleeding disorders among healthy pediatric patients with abnormal preprocedural coagulation studies. J Pediatr Hematol Oncol 2008; 30(2):135-141.
(221) Rockey DC, Caldwell SH, Goodman ZD, Nelson RC, Smith AD. Liver biopsy. Hepatology 2009; 49(3):1017-1044.
(222) Tam A, Krishnamurthy S, Pillsbury EP, Ensor JE, Gupta S, Murthy R et al. Percutaneous image-guided splenic biopsy in the oncology patient: an audit of 156 consecutive cases. J Vasc Interv Radiol 2008; 19(1):80-87.
(223) Malloy PC, Grassi CJ, Kundu S, Gervais DA, Miller DL, Osnis RB et al. Consensus guidelines for periprocedural management of coagulation status and hemostasis risk in percutaneous image-guided interventions. J Vasc Interv Radiol 2009; 20(7 Suppl):S240-S249.
(224) Melotti MK, Berg WA. Core needle breast biopsy in patients undergoing anticoagulation therapy: preliminary results. AJR Am J Roentgenol 2000; 174(1):245-249.
(225) Somerville P, Seifert PJ, Destounis SV, Murphy PF, Young W. Anticoagulation and bleeding risk after core needle biopsy. AJR Am J Roentgenol 2008; 191(4):1194-1197.
(226) Naito K, Lequint T, Zemirline A, Gouzou S, Facca S, Liverneaux P. Should we stop oral anticoagulants in the surgical treatment of carpal tunnel syndrome? Hand (N Y ) 2012; 7(3):267-270.
(227) Geerts WH, Pineo GF, Heit JA, Bergqvist D, Lassen MR, Colwell CW et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):338S-400S.
(228) Salmaggi A, Simonetti G, Trevisan E, Beecher D, Carapella CM, DiMeco F et al. Perioperative thromboprophylaxis in patients with craniotomy for brain tumours: a systematic review. J Neurooncol 2013; 113(2):293-303.
(229) Marras LC, Geerts WH, Perry JR. The risk of venous thromboembolism is increased throughout the course of malignant glioma: an evidence-based review. Cancer 2000; 89(3): 640-646.
(230) Iorio A, Agnelli G. Lowmolecular-weight and unfractionated heparin for prevention of venous thromboembolism in neurosurgery: a metaanalysis. Arch Intern Med 2000; 160(15):2327-2332.
(231) Cote LP, Greenberg S, Caprini JA, Stone J, Arcelus JI, LopezJimenez L et al. Outcomes in neurosurgical patients who develop venous thromboembolism: a review of the RIETE registry. Clin Appl Thromb Hemost 2014; 20(8):772-778.
(232) Serrone JC, Wash EM, Hartings JA, Andaluz N, Zuccarello M. Venous thromboembolism in subarachnoid hemorrhage. World Neurosurg 2013; 80(6):859-863.
(233) Kim KS, Brophy GM. Symptomatic venous thromboembolism: incidence and risk factors in patients with spontaneous or traumatic intracranial hemorrhage. Neurocrit Care 2009; 11(1):28-33.
(234) Dickinson LD, Miller LD, Patel CP, Gupta SK. Enoxaparin increases the incidence of postoperative intracranial hemorrhage when initiated preoperatively for deep venous thrombosis prophylaxis in patients with brain tumors. Neurosurgery 1998; 43(5): 1074-1081.
(235) Nicol M, Sun Y, Craig N, Wardlaw D. Incidence of thromboembolic complications in lumbar spinal surgery in 1,111 patients. Eur Spine J 2009; 18(10):1548-1552.
(236) Yang SD, Ding WY, Yang DL, Shen Y, Zhang YZ, Feng SQ et al. Prevalence and Risk Factors of Deep Vein Thrombosis in Patients Undergoing Lumbar Interbody Fusion Surgery: A Single-Center Cross-Sectional Study. Medicine (Baltimore) 2015; 94(48):e2205.
(237) Monagle P, Chan A, Massicotte P, Chalmers E, Michelson AD. Antithrombotic therapy in children: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):645S-687S.
(238) Rogers FB, Shackford SR, Horst MA, Miller JA, Wu D, Bradburn E et al. Determining venous thromboembolic risk assessment for patients with trauma: the Trauma Embolic Scoring System. J Trauma Acute Care Surg 2012; 73(2):511-515.
(239) Waring WP, Karunas RS. Acute spinal cord injuries and the incidence of clinically occurring thromboembolic disease. Paraplegia 1991; 29(1):8-16.
(240) Flaherty ML. Anticoagulantassociated intracerebral hemorrhage. Semin Neurol 2010; 30(5):565-572.
(241) Stead LG, Jain A, Bellolio MF, Odufuye AO, Dhillon RK, Manivannan V et al. Effect of anticoagulant and antiplatelet therapy in patients with spontaneous intra-cerebral hemorrhage: Does medication use predict worse outcome? Clin Neurol Neurosurg 2010; 112(4):275-281.
(242) Cucchiara B, Messe S, Sansing L, Kasner S, Lyden P. Hematoma growth in oral anticoagulant related intracerebral hemorrhage. Stroke 2008; 39(11):2993-2996.
(243) Davis SM, Broderick J, Hennerici M, Brun NC, Diringer MN, Mayer SA et al. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage. Neurology 2006; 66(8):1175-1181.
(244) Le Roux P, Pollack CV, Jr., Milan M, Schaefer A. Race against the clock: overcoming challenges in the management of anticoagulant-associated intracerebral hemorrhage. J Neurosurg 2014; 121 Suppl:1-20.
(245) Lauer A, Pfeilschifter W, Schaffer CB, Lo EH, Foerch C. Intracerebral haemorrhage associated with antithrombotic treatment: translational insights from experimental studies. Lancet Neurol 2013; 12(4):394-405.
(246) Tarlov N, Norbash AM, Nguyen TN. The safety of anticoagulation in patients with intracranial aneurysms. J Neurointerv Surg 2013; 5(5):405-409.
(247) Gaarder C, Naess PA, Frischknecht CE, Hakala P, Handolin L, Heier HE et al. Scandinavian Guidelines— “The massively bleeding patient”. Scand J Surg 2008; 97(1):15-36.
(248) Estcourt LJ, Ingram C, Doree C, Trivella M, Stanworth SJ. Use of platelet transfusions prior to lumbar punctures or epidural anaesthesia for the prevention of complications in people with thrombocytopenia. Cochrane Database Syst Rev 2016;(5):CD011980.
(249) Kaufman RM, Djulbegovic B, Gernsheimer T, Kleinman S, Tinmouth AT, Capocelli KE et al. Platelet transfusion: a clinical practice guideline from the AABB. Ann Intern Med 2015; 162(3):205-213.
(250) NICE. Blood Transfusion. 2016. Ref Type: Internet Communication
(251) Gibson BE, Todd A, Roberts I, Pamphilon D, Rodeck C, BoltonMaggs P et al. Transfusion guidelines for neonates and older children. Br J Haematol 2004; 124(4):433-453.
(252) Guidelines for the use of platelet transfusions. Br J Haematol 2003; 122(1):10-23.
(253) 2 Platelet Concentrates. Transfus Med Hemother 2009; 36(6):372-382.
(254) Watson DM, Stanworth SJ, Wyncoll D, McAuley DF, Perkins GD, Young D et al. A national clinical scenario-based survey of clinicians’ attitudes towards fresh frozen plasma transfusion for critically ill patients. Transfus Med 2011; 21(2):124-129.
(255) Rupp SM, Apfelbaum JL, Blitt C, Caplan RA, Connis RT, Domino KB et al. Practice guidelines for central venous access: a report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology 2012; 116(3):539-573.
(256) Kiefer D, Keller SM, Weekes A. Prospective evaluation of ultrasound-guided short catheter placement in internal jugular veins of difficult venous access patients. Am J Emerg Med 2016; 34(3):578-581.
(257) Smith RN, Nolan JP. Central venous catheters. BMJ 2013; 347:f6570.
(258) Brass P, Hellmich M, Kolodziej L, Schick G, Smith AF. Ultrasound guidance versus anatomical landmarks for subclavian or femoral vein catheterization. Cochrane Database Syst Rev 2015; 1:CD011447.
(259) Brass P, Hellmich M, Kolodziej L, Schick G, Smith AF. Ultrasound guidance versus anatomical landmarks for internal jugular vein catheterization. Cochrane Database Syst Rev 2015; 1:CD006962.
(260) Carino GP, Tsapenko AV, Sweeney JD. Central line placement in patients with and without prophylactic plasma. J Crit Care 2012; 27(5):529-13.
(261) Estcourt LJ, Stanworth SJ, Doree C, Hopewell S, Trivella M, Murphy MF. Comparison of different platelet count thresholds to guide administration of prophylactic platelet transfusion for preventing bleeding in people with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation. Cochrane Database Syst Rev 2015;(11):CD010983.
(262) Estcourt LJ, Desborough M, Hopewell S, Doree C, Stanworth SJ. Comparison of different platelet transfusion thresholds prior to insertion of central lines in patients with thrombocytopenia. Cochrane Database Syst Rev 2015;(12):CD011771.
(263) Hall DP, Estcourt LJ, Doree C, Hopewell S, Trivella M, Walsh TS. Plasma transfusions prior to insertion of central lines for people with abnormal coagulation. Cochrane Database Syst Rev 2016; 9:CD011756.
(264) Guyatt GH, Norris SL, Schulman S, Hirsh J, Eckman MH, Akl EA et al. Methodology for the development of antithrombotic therapy and prevention of thrombosis guidelines: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl):53S-70S.
(265) Pabinger I, Brenner B, Kalina U, Knaub S, Nagy A, Ostermann H. Prothrombin complex concentrate (Beriplex P/N) for emergency anticoagulation reversal: a prospective multinational clinical trial. J Thromb Haemost 2008; 6(4):622-631.
(266) van Aart L, Eijkhout HW, Kamphuis JS, Dam M, Schattenkerk ME, Schouten TJ et al. Individualized dosing regimen for prothrombin complex concentrate more effective than standard treatment in the reversal of oral anticoagulant therapy: an open, prospective randomized controlled trial. Thromb Res 2006; 118(3):313-320.
(267) Hirsh J, Raschke R. Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):188S-203S.
(268) Koch A, Ziegler S, Breitschwerdt H, Victor N. Low molecular weight heparin and unfractionated heparin in thrombosis prophylaxis: meta-analysis based on original patient data. Thromb Res 2001; 102(4):295-309.
(269) Nieuwenhuis HK, Albada J, Banga JD, Sixma JJ. Identification of risk factors for bleeding during treatment of acute venous thromboembolism with heparin or low molecular weight heparin. Blood 1991; 78(9):2337-2343.
(270) Warkentin TE, Greinacher A. Heparin-induced thrombocytopenia: recognition, treatment, and prevention: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):311S-337S.
(271) Cheer SM, Dunn CJ, Foster R. Tinzaparin sodium: a review of its pharmacology and clinical use in the prophylaxis and treatment of thromboembolic disease. Drugs 2004; 64(13):1479-1502.
(272) Dunn CJ, Jarvis B. Dalteparin: an update of its pharmacological properties and clinical efficacy in the prophylaxis and treatment of thromboembolic disease. Drugs 2000; 60(1):203-237.
(273) Ibbotson T, Goa KL. Enoxaparin: an update of its clinical use in the management of acute coronary syndromes. Drugs 2002; 62(9):1407-1430.
(274) Gogarten W. The influence of new antithrombotic drugs on regional anesthesia. Curr Opin Anaesthesiol 2006; 19(5):545-550.
(275) Reynolds NA, Perry CM, Scott LJ. Fondaparinux sodium: a review of its use in the prevention of venous thromboembolism following major orthopaedic surgery. Drugs 2004; 64(14):1575-1596.
(276) Weitz JI, Hirsh J, Samama MM. New anticoagulant drugs: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):265S-286S.
(277) Moen MD, Keating GM, Wellington K. Bivalirudin: a review of its use in patients undergoing percutaneous coronary intervention. Drugs 2005; 65(13):1869-1891.
(278) McKeage K, Plosker GL. Argatroban. Drugs 2001; 61(4):515-522.
(279) Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12):1139-1151.
(280) Schulman S, Kearon C, Kakkar AK, Mismetti P, Schellong S, Eriksson H et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009; 361(24):2342-2352.
(281) van Ryn J, Stangier J, Haertter S, Liesenfeld KH, Wienen W, Feuring M et al. Dabigatran etexilate—a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010; 103(6):1116-1127.
(282) Abrams PJ, Emerson CR. Rivaroxaban: a novel, oral, direct factor Xa inhibitor. Pharmacotherapy 2009; 29(2):167-181.
(283) Eriksson BI, Kakkar AK, Turpie AG, Gent M, Bandel TJ, Homering M et al. Oral rivaroxaban for the prevention of symptomatic venous thromboembolism after elective hip and knee replacement. J Bone Joint Surg Br 2009; 91(5):636-644.
(284) Plitt A, Giugliano RP. Edoxaban: Review of pharmacology and key phase I to III clinical trials. J Cardiovasc Pharmacol Ther 2014; 19(5):409-416.
(285) Wiedermann CJ, Kaneider NC. A systematic review of antithrombin concentrate use in patients with disseminated intravascular coagulation of severe sepsis. Blood Coagul Fibrinolysis 2006; 17(7):521-526.
(286) Alam M, Goldberg LH. Serious adverse vascular events associated with perioperative interruption of antiplatelet and anticoagulant therapy. Dermatol Surg 2002; 28(11):992-998.
(287) Connor SE, Wingate JP. Management of patients treated with aspirin or warfarin and evaluation of haemostasis prior to prostatic biopsy: a survey of current practice amongst radiologists and urologists. Clin Radiol 1999; 54(9):598-603.
(288) Enver MK, Hoh I, Chinegwundoh FI. The management of aspirin in transurethral prostatectomy: current practice in the UK. Ann R Coll Surg Engl 2006; 88(3):280-283
(289) Ferraris VA, Ferraris SP. 1988: Preoperative aspirin ingestion increases operative blood loss after coronary artery bypass grafting. Updated in 1995. Ann Thorac Surg 1995; 59(4):1036-1037.
(290) Gogarten W, Buerkle H, Van Aken H. The use of concomitant antiplatelet drugs during neura – xial anethesia is contraindicated in Germany. Reg Anesth Pain Med 2003; 28(6):585-586.
(291) Lindblad B, Persson NH, Takolander R, Bergqvist D. Does low-dose acetylsalicylic acid prevent stroke after carotid sur – gery? A double-blind, placebocontrolled randomized trial. Stroke 1993; 24(8):1125-1128.
(292) Nielsen JD, Holm-Nielsen A, Jespersen J, Vinther CC, Settgast IW, Gram J. The effect of low-dose acetylsalicylic acid on bleeding after transurethral prostatectomy—a prospective, randomized, double-blind, placebo-controlled study. Scand J Urol Nephrol 2000; 34(3):194-198.
(293) Patrono C, Coller B, FitzGerald GA, Hirsh J, Roth G. Plateletactive drugs: the relationships among dose, effectiveness, and side effects: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl): 234S-264S.
(294) Taylor DW, Barnett HJ, Haynes RB, Ferguson GG, Sackett DL, Thorpe KE et al. Low-dose and high-dose acetylsalicylic acid for patients undergoing carotid endarterectomy: a randomised controlled trial. ASA and Carotid Endarterectomy (ACE) Trial Collaborators. Lancet 1999; 353(9171):2179-2184.
(295) Tytgat SH, Laman D M, Rijken A M, Klicks R, Voorwinde A, Ultee J M et al. Emboli rate during and early after carotid endarterec – tomy after a single preoperative dose of 120 mg acetylsalicylic acid—a prospective double-blind placebo controlled randomised trial. Eur J Vasc Endovasc Surg 2005; 29(2):156-161.
(296) Halkes PH, van Gijn J, Kappelle LJ, Koudstaal PJ, Algra A. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367(9523): 1665-1673.
(297) Teoh KH, Christakis GT, Weisel RD, Wong PY, Mee AV, Ivanov J et al. Dipyridamole preserved platelets and reduced blood loss after cardiopulmonary bypass. J Thorac Cardiovasc Surg 1988; 96(2):332-341.
(298) Park Y, Franchi F, Rollini F, Angiolillo DJ. Update on oral antithrombotic therapy for secondary prevention following non-ST segment elevation myocardial infarction. Trends Cardiovasc Med 2016; 26(4): 321-334.
(299) Cannon CP, Harrington RA, James S, Ardissino D, Becker RC, Emanuelsson H et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLAT O): a rando – mised double-blind study. Lancet 2010; 375(9711): 283-293.
(300) Husted S, van Giezen JJ. Ticagrelor: the first reversibly binding oral P2Y12 receptor antagonist. Cardiovasc Ther 2009; 27(4):259-274.
(301) Bhatt DL, Lincoff A M, Gibson C M, Stone GW, McNulty S, Montalescot G et al. Intravenous platelet blockade with cangrelor during PCI. N Engl J Med 2009; 361(24):2330-2341.
(302) Bhatt DL, Harrington RA. Platelet inhibition with cangrelor during PCI. N Engl J Med 2013; 369(4):393-394.
(303) Dyke C M. Safety of glycoprotein IIb-IIIa inhibitors: A heart sur – geon’s perspective. Am Heart J 1999; 138(4 Pt 2):307-316.
(304) Harder S, Klinkhardt U, Alvarez J M. Avoidance of bleeding during surgery in patients receiving anticoagulant and/or antiplate – let therapy: pharmacokinetic and pharmacodynamic considerati – ons. Clin Pharmacokinet 2004; 43(14):963-981.
(305) Lecompte T, Hardy JF. Antiplatelet agents and periope – rative bleeding. Can J Anaesth 2006; 53(6 Suppl):S103-S112.
(306) Plotkin JS, Kuo PC, Rubin LJ, Gaine S, Howell CD, Laurin J et al. Successful use of chronic epoprostenol as a bridge to liver transplantation in severe portopulmonary hypertension. Transplantation 1998; 65(4): 457-459.
(307) Albers GW, Amarenco P, Easton JD, Sacco RL, Teal P. Antithrombotic and thrombolytic therapy for ischemic stroke: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126(3 Suppl):483S-512S.
(308) Goodman SG, Menon V, Cannon CP, Steg G, Ohman E M, Harrington RA. Acute ST-segment elevation myo – cardial infarction: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133(6 Suppl):708S-775S.
Indholdsfortegenelse
