Udarbejdet af en arbejdsgruppe under Dansk Selskab for Anæstesiologi og Intensiv Medicin (DASAIM) 2022

Arbejdsgruppen
Fra DASAIM
Christine Lodberg Hvas, afdelingslæge, ph.d., klinisk lektor, Intensiv, Aarhus Universitetshospital (tovholder og korrespondance: chhvas@rm.dk )
Jo Bønding Andreasen, afdelingslæge, ph.d., Aalborg Universitetshospital
Lene Russell, afdelingslæge, ph.d., Rigshospitalet
Thomas Hildebrandt, overlæge, Intensiv, SUH-Roskilde
Nicolai Helligsøe Bæk, afdelingslæge, Bedøvelse og Intensiv, Kolding Sygehus
Fra andre selskaber
Kasper Adelborg, læge, ph.d., lektor, Blodprøver og Biokemi, Aarhus Universitetshospital
Peter Kampmann, overlæge, hæmatologisk afdeling, Rigshospitalet, medlem af bestyrelsen for Dansk Selskab for Trombose og Hæmostase
Formål
Formålet med denne vejledning er at hjælpe intensivlæger i Danmark i beslutningstagningen omkring patienter, der kan være ramt af dissemineret intravaskulær koagulation (DIC). Vejledning gennemgår patofysiologien bag DIC og redegør for hvilke patientgrupper, der hyppigst rammes af DIC, samt hvordan tilstanden kan monitoreres. Monitorering af heparinbehandling med måling af Anti-faktor Xa dækkes ikke af nærværende vejledning Differentialdiagnoser gennemgås og hvorledes disse adskiller sig klinisk og paraklinisk fra DIC, men behandlingen af disse tilstande gennemgås ikke i nærværende vejledning.
En væsentlige udfordringer ved DIC er, dels at erkende tilstanden og adskille den fra relevante differentialdiagnoser, at afgøre hvornår man skal overgå fra monitorering af tilstanden til aktiv behandling, samt hvilken aktiv behandling man skal gribe til, da evidensgrundlaget for dette er varierende og ofte sparsomt. Dog er der nogen konsensus mellem internationale selskabers anbefalinger, hvilket denne vejledning ønsker at sammenfatte. Vejledningen ønsker, gennem litteraturgennemgang, at anskueliggøre, hvilke hæmostatika, antikoagulantia og transfusioner, der er grundlag for at anvende på de forskellige stadier i denne uforudsigelige tilstand. Derved håber arbejdsgruppen på at kunne støtte den enkelte intensivlæge i diagnosen, monitoreringen og behandlingen af DIC.
Definition
DIC er en systemisk tilstand karakteriseret af samtidig pro- og antikoagulation.1 International Society on Thrombosis and Haemostasis (ISTH) definerer DIC som “an acquired syndrome characterised by the intravascular activation of coagulation with loss of localisation arising from different causes”.2
DIC er en heterogen tilstand, der kan initieres af flere forskellige mekanismer, og derfor varierer såvel det kliniske billede som laboratorieværdierne betydeligt.3 Overordnet involverer tilstanden hele det hæmostatiske system inklusive endotelcellerne4 og resulterer i øget koagulationsaktivering og dermed et øget forbrug af trombocytter og koagulationsproteiner,5-7 men også en depletering af de fysiologiske antikoagulerende proteiner.8
Til trods for at DIC-syndromet medfører koagulationsaktivering, med risiko for dannelse af mikrotromber, så er det mest almindelige symptom blødning sekundært til trombocytopeni og mangel på koagulationsfaktorer. Typisk ses blødning fra flere lokalisationer, herunder slimhinder, indstikssteder og sår.9 Dette paradoks er tidligere beskrevet, som at DIC-patientens blod er “hypercoagulable in the circulation and difficult to clot outside the vessels”.10
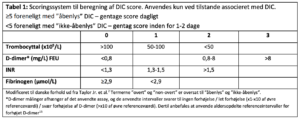
Der er udviklet flere scoringssystemer for DIC, bl.a. ved International Society on Thrombosis and Hemostasis (ISTH)2 samt Japanese Association for Acute Medicine (JAAM).11 ISTHs scoringsystem for diagnose af DIC, er baseret på en kombination af biokemiske laboratorieparametre og tilstedeværelsen af en underliggende tilstand, hvor der foreligger en kendt association med DIC (Tabel 1). DIC-scoren skal dog bruges som vejledning og ikke som diagnostisk redskab. Brug af DIC score hos en ren intensivpopulation er ikke valideret, og hos flere kritisk syge patientgrupper, såsom traumepatienter12 og hæmatologiske intensivpatienter,13 korrelerer DIC-score ikke nødvendigvis med forekomst af klinisk DIC eller med patientoutcome. Sammenhængen synes være stærkere hos kritisk syge patienter med infektion og/eller sepsis. 14
Patofysiologi
Intakt hæmostase sikrer koageldannelse ved karskade samt efterfølgende nedbrydning af klottet (fibrinolyse), således at vævshelingen kan begynde og flow på ny kan genoprettes. Det hæmostatiske system er normalt fysiologisk adaptivt, så aktivering af det prokoagulante system sekundært også vil aktivere systemets egne inhibitorer, hvorved responset begrænses og holdes lokalt. Ved DIC sker der en systemisk aktivering af koagulationssystemet medførende forbrug af koagulationsfaktorer, antikoagulerende proteiner og trombocytter, hvilket i svære tilfælde kan resultere i blødning og trombose.
Ved DIC ses altid en øget koagulation, men graden af fibrinolytisk aktivering varierer meget afhængig af udløsende årsag, hvorfor DIC groft kan inddeles i fibrinolytisk og antifibrinolytisk DIC.10,16 Fibrinolytisk DIC er karakteriseret ved blødning; denne tilstand ses i sin ”rene form”, om end sjældent, ved akut promyelocytisk leukæmi17,18 og i den tidlige fase efter stort traume.19 Ved antifibrinolytisk DIC er det fibrinolytiske system kun aktiveret i mindre grad og øget koagulation dominerer. Denne variant af DIC ses bl.a. ved nogle typer af sepsis, hvor forbrug af trombocytter og koagulationsfakturer i kombination med et hæmmet antifibrinolytisk system giver mikrovaskulær deponering af fibrin.16 Mikrovaskulær fibrin og mikrotrombose har tidligere været tilskrevet som årsag til multiorgansvigt ved svær sepsis.20-22 Senere forskning har vist, at mikrotromber kun sjældent ses ved sepsis. Til gengæld er immunmedierede forandringer i det mikrovaskulære system meget hyppigt ved sepsis, hvilket resulterer i nedsat organperfusion. Disse forandringer kan være reversible og graden af reversibilitet er associeret med outcome .23-25
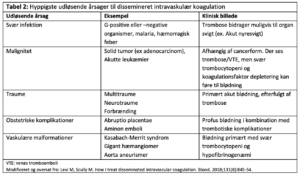
Underliggende
DIC opstår altid som komplikation til en underliggende sygdom, men ses hyppigst ved sepsis og alvorlig infektion,16 maligne sygdomme,26 obstetriske komplikationer1 og traumer, særligt hovedtraumer (Tabel 2).27 Fælles for disse lidelser er, at blodet eksponeres for tissue factor (TF), som er et kraftigt prokoagulant glycoprotein, som især findes i adventitia og i organkapsler. TF udtrykkes desuden på monocytter og makrofager ved cytokinmedieret aktivering og findes på flere typer af kræftceller samt på mikropartikler frigivet herfra. Bakterielle endotoxiner, såsom lipopolysaccharider (LPS), kan direkte aktivere koagulationen gennem en øget aktivering af TF.28
Koagulation er en del af immunforsvaret
Immunmedieret aktivering af koagulationssystemet er et fysiologisk og nødvendigt respons på infektion og fundamentalt for overlevelse. Ved sepsis initieres et komplekst inflammatorisk respons, som omfatter immunsystemet, koagulationssystemet og komplementkaskaden.29 (Figur 1) Dette sker simultant på flere niveauer. Kontaktaktiverede koagulationsfaktorer aktiveres af negativt ladede molekyler, såsom bakteriel LPS eller nukleinsyrer, der frigives fra beskadigede celler.30 Mononukleære celler stimuleres af cytokiner til at udtrykke TF.31 TF initierer de såkaldte “extrinsic” koagulationsfaktorer, primært koagulationsfaktor (f)VII, hvilket resulterer i dannelse af TF-fVIIa komplexet, fXa og trombin, som direkte aktiverer endotelceller, trombocytter og leukocytter og derved yderligere stimulerer det inflammatoriske respons.32
Trombin stimulerer trombocyt-neutrofil interaktionerne og dannelse af fibrin.33 Fibrin-net begrænser direkte spredning af infektionen, mens andre koagulationsproteiner giver feedback om opregulering af det medfødte/innate immunforsvar.34 Dermed begrænses infektionsspredningen og immuncellerne kan
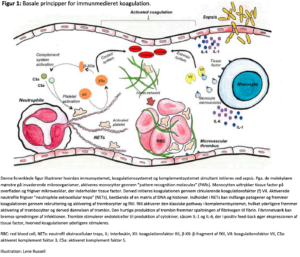
eliminere patogenerne. Betydningen af trombin i immunforsvaret er blandt andet eksemplificeret i dyreforsøg, hvor hæmning af trombin resulterede i øget bakterievækst og øget mortalitet..33 Aktiverede trombocytter har også en vigtig rolle i immunforsvaret, inklusive direkte aktivering af ’Neutrophile extracellular traps’ (NETs), der er afgørende for et fungerende immunforvar. NETs kan binde både patogener og blodceller og derigennem fremme destruktion af skadelige agens. NETs har også en koagulationsaktiverende effekt, der sandsynligvis spiller en stor rolle ved DIC. Dette illustreres ved at leukæmipatienter i kemo-induceret neutropeni og patienter med neutropen sepsis ikke får DIC.35
Aktivering af koagulationssystemet er således en nødvendig del af immunforsvaret. I nogle tilfælde er koagulationsaktiveringen dog meget voldsom og resultatet skadeligt.36
Excessiv dannelse af fibrin og defekter i antikoagulante mekanismer
Ved fulminant DIC er den TF-initierede koagulationsaktivering meget excessiv og de store mængder trombin der dannes, aktiverer cirkulerende trombocytter, stimulerer omdannelsen af fibrinogen til fibrin og hæmmer fibrinolysen. Desuden forstærker trombin det prokoagulante respons gennem positive feedbackmekanismer således at fibrin deponeres og danner klots sammen med aktiverede trombocytter og leukocytter. Proinflammatoriske mediatorer, der frigives fra aktiverede neutrofile granulocytter, inducerer endotelskade, hvorved endotelet mister sin antikoagulante evne.37 Desuden medfører den øgede aktivering af koagulationen forbrug og senere mangel på antikoagulante faktorer som protein C, protein S og antitrombin.
Forstyrrelser af fibrinolysen
De kliniske manifestationer ved DIC afhænger i høj grad af det fibrinolytiske respons, som kan være øget eller reduceret. Endotelskaden giver anledning til frigivelse af tissue plasminogen aktivator (tPA) hvorved plasminogens omdannelse til plasmin stimuleres med nedbrydning af fibrin til følge (hyperfibrinolyse).10
Hæmmet fibrinolyse ses hyppigst ved infektiøst betinget DIC og skyldes i høj grad frigivelse af Plasminogen Activator Inhibitor-1 (PAI-1) som frigives både fra beskadiget endotel og fra aktiverede trombocytter. Desuden medfører forbrug af plasminogen ved DIC med tiden hypofibrinolyse og en deraf følgende øget prokoagulant tilstand.38
Monitorering – biokemi og klinik
Det biokemisk hyppigste fund ved DIC er trombocytopeni.39 Trombocytopeni er dog et hyppigt fund hos intensiv patienter og har mange årsager ved kritisk sygdom.40 Derfor anbefales særligt ved fald i trombocyttal, at der tages supplerende DIC-tal (trombocyttal, INR, APTT, fibrinogen, D-dimer, og gerne antitrombin) og at der foretages beregning af DIC-score. ISTH anbefaler daglig DIC-scoring ved score ≥5 (åbenlys DIC), og kontrol af DIC-score efter 1-2 dage ved score <5 og fortsat progredierende tilstand.2 Systematisk DIC-scoring ved indlæggelse på intensiv har en mulig positiv effekt på overlevelsen.41
INR og protrombintid (PT)
ISTH guidelines anvender PT som standard ved DIC score. Denne parameter måles sjældent på danske hospitaler. I stedet anvendes INR, om end der ikke er internationalt vedtagne grænser for denne parameter ved DIC. Dette skyldes variationer mellem laboratoriernes assays og at INR analysen primært er udviklet til monitorering af vitamin K-antagonister. Dog er variationerne små, og da ISTH DIC score for PT/INR varierer fra 0-2, har dette ikke væsentlig indflydelse på den enkelte patients DIC score.42
D-dimer
D-dimer dannes ved degradering af krydsbundet fibrin gennem fibrinolyse. Dannelsen kræver aktivering af tre enzymer: trombin, aktiveret fXIII og plasmin. Processen starter med dannelsen af trombin, der derefter spalter fibrinogen til fibrin monomerer. Fibrin monomerer danner polymerer, hvis bindinger forstærkes af fXIII. Derefter sker spaltning ved plasmin. Dannelsen af D-dimer forudsætter både trombindannelse og fibrinolyse, og kan ikke isoleret ses som en fibrinolysemarkør.
D-dimer dannes ved alle tilstande, hvor der dannes trombose og er ikke en prædiktor for DIC i sig selv. Serielle målinger af D-dimer hos en DIC patient kan anvendes til at vurdere om den underliggende tilstand er under kontrol.43
Fibrinogen
Fibrinogen er substrat for trombin, der spalter fibrinogen til fibrin. Fibrin danner fibrinnetværk samt danner bindeled mellem trombocytter, således at der dannes et klot, som yderligere forstærkes vha. fXIII. Fibrinogen er dertil en akutfasereaktant, og stiger markant ved inflammation. Derfor er fibrinogen taget ud af JAAMs DIC score, når DIC er udløst af sepsis.11 Fibrinogen kan forblive indenfor eller over referenceintervallet indtil sent i DIC forløbet, og sensitiviteten for DIC er lav under pågående inflammation.44
Antitrombin
Antitrombin er kroppens kraftigste endogene hæmmer af koagulationen, og forbruges under DIC. Reduktion i antitrombin er vist at korrelere til graden af sepsis, således at antitrombin aktiviteten er ca. 80% af det normale ved sepsis, 60% ved svær sepsis og 40% ved fulminant DIC.45 Antitrombin anbefales at indgå i den daglige vurdering af patientens tilstand, også mhp. en eventuel substitution (se Håndtering af DIC). Antitrombin indgår i JAAMs DIC score.
Tromboelastometri/grafi (ROTEM/TEG)
Både ROTEM og TEG har været undersøgt i forbindelse med sepsis og DIC.46-49 ROTEM/TEG kan ikke i sig selv anvendes til diagnosticering af DIC, men kan anvendes som supplement til den konventionelle DICpakke. Dog er det væsentligt at understrege, at ROTEM/TEG-resultater, uden blødning, ikke skal give anledning til transfusion, hvorfor anvendelsen med den nuværende evidens, synes at have mest akademisk interesse.
ROTEM/TEG kan detektere den hypokoagulable tilstand, som har øget risiko for død.49 Dog er ROTEM/TEG ikke særligt sensitiv for dette, da standard reagenserne primært er udviklet til at monitorere tilstande med pågående blødning. ROTEM/TEG detekterer også hyperkoagulation, men der er ikke konsensus om hvorvidt dette gøres sikkert nok til at have klinisk konsekvens.48,49 Med modificerede assays, vil ROTEM/TEG have potentiale til at finde de rette patienter, såfremt vi opnår evidens for antikoagulerende behandling.48,50
ROTEM/TEG ved DIC kan understøtte behandlingen ved transfusionskrævende blødning efter vanlige retningslinjer mhp. at opnå en balanceret transfusionsstrategi. ROTEM/TEG kan ikke anvendes til at prædiktere blødning.51
Ved hyperfibrinolyse hos den blødende patient ved traume eller obstetrisk DIC/amnion-emboli kan ROTEM/TEG anvendes til at understøtte indikationen for anvendelse af tranexamsyre ved hyperfibrinolytisk DIC. Ved traumepatienter er det vist at ROTEM/TEG kan undervurdere graden af fibrinolyse.52 Dette medfører at man ved traumer i den akutte fase ikke skal afvente ROTEM/TEG før administration af tranexamsyre (se Håndtering af DIC).53
Hypofibrinolyse er ROTEM/TEG ikke særligt sensitiv for, da forskellene i lysis index er ganske små og indenfor referenceintervallet. Man kan således ikke, hos den enkelte patient, diagnosticere hypofibrinolyse vha. ROTEM/TEG.
Kliniske observationer
Makrovaskulær tromboemboli (ex dyb venetrombose, lungeemboli) diagnosticeres efter vanlige retningslinjer og undersøgelse herfor bør foretages på lav indikation, da DIC patienten vil have mange risikofaktorer for tromboemboli.54
Mikrotrombose og forstyrrelser i mikrocirkulationen står ikke i direkte sammenhæng med observationer af den systemiske hæmodynamik, f.eks. måling af blodtryk eller pulstrykvariation. Følgende markører kan guide ift. hvor påvirket mikrocikulationen er:55
- Kapillærrespons og marmorering: detekterer insufficient perfusion af perifert væv, men påvirkes ved anvendelse af vasokonstriktorer og af omgivende temperatur.
- Laktat: ændringer i laktat er omvendt proportional med mikrovaskulær perfusion.55 Ved sepsis ses dog også påvirkning af laktatnedbrydning i leveren, hvilket kan forstyrre denne sammenhæng.
- Veno-arteriel forskel i pCO2: forskellen mellem venøs og arteriel CO2 korrelerer til mirkocirkulationen, således at en PvaCO2 >6 mmHg (0,8 kPa) er korreleret til nedsat perfusion af mikrovaskulatur og øget heterogenitet af flow.56
Fremtidige biomarkører for DIC
Trombin generation
Trombin generation kan måles in vivo ved markørerne trombin-antitrombin (TAT) og protrombin fragment 1+2 (F1+2). Særligt TAT har vist sig som en markør for øget dødelighed ved sepsis patienter, men ingen af markørerne er implementeret i laboratoriernes standard analyser.50
Ex vivo trombin generation måles ved det funktionelle assay Calibrated Automated Thrombogram (ad modum Hemker), hvor plasma aktiveres med tissue factor. Derved måles hastighed for dannelse, peak og total trombin og det vises om patienten har nedsat potentiale for trombin dannelse og er hypokoagulabel, eller om patienten har øget potentiale for trombin dannelse og er hyperkoagulabel.57 Som ved TAT og F1+2 er måling af trombin generation primært en forskningsanalyse og mangler standardisering på tværs af laboratorier, før den kan anvendes i klinisk praksis.
Funktionelle assays, hvor trombin generation og fibrinolyse måles simultant, kan adskille ”coagulationpredominant, coagulation/fibrinolysis-balanced, fibrinolysis-predominant, and consumption-impaired coagulation”, hvilket i fremtiden har potentiale til brug ved klinisk beslutningstagning.58
Fibrinolyse
Hypofibrinolyse er associeret med øget dannelse af mikrotromber, men standard koagulationstests identificerer ikke denne tilstand. En mulig markør for hypofibrinolyse er PAI-1, hvor øget PAI-1 kan anvendes til at skelne åbenlys/ikke-åbenlys DIC og prædiktere udviklingen af DIC.50 Dertil er dynamiske clotlyse assays under anvendelse i forskningsmæssig sammenhæng, men disse analyser er ikke standardiserede på tværs af laboratorier, og kun sparsomt anvendt ved DIC patienter.59,60
Differentialdiagnoser til DIC
Flere tilstande kan ligne DIC uden at være dette og bør derfor håndteres anderkedes. Følgende afsnit vil berøre nogle af de vigtigste differentialdiagnoser, som klinikeren kan komme i kontakt med.
Levercirrose
Patienter med betydende levercirrose vil ofte have en påvirket koagulation grundet manglende syntese af koagulationsfaktorer (fII, fV, fVII, fIX, fX, fXI) samt et stabilt lavt trombocyttal grundet nedsat syntese af trombopoetin og forbrug i leveren. Trods dette er cirrosepatientens koagulationssystem oftest i en hårfin balance da fVIII og von Willebrands faktor (vWf) er inflammatorisk opreguleret, idet de ikke er leverderiverede, men syntetiseret i endothelet. Dertil har protein C og S nedsat syntese.61-64 Hos disse patienter vil en påvirkning, som sepsis eller traume, kunne skubbe til ligevægten og eventuelt udløse DIC eller en tilstand, der paraklinisk og grundet ledsagende blødning, kan ligne DIC. Tilstanden er karakteriseret ved en forøget fibrinolytisk aktivitet i et i forvejen skrøbeligt system og bliver i den engelske litteratur benævnt ”Accelerated Intravascular Coagulation and Fibrinolysis” (AICF).65 Hvor blødning ved DIC skyldes et forbrug og sekundær koagulopati, skyldes blødning ved ACIF hyperfibrinolyse og kan detekteres ved tegn på hyperfibrinolyse i ROTEM/TEG, forhøjet D-Dimer og lav fibrinogen.66 Differentieringen er vigtig da AICF, som DIC, er en alvorlig tilstand, med høj mortalitet og morbiditet.
HELLP
HELLP er en alvorlig tilstand karakteriseret af Hæmolyse, Eleverede Leverenzymer og trombocytopeni (Low Platelets), som primært tilskrives endotelskade i leveren med tilhørende trombocytaktivering, aggregation og forbrug.67
Tilstanden kan gradinddeles i 3 stadier iht. Tennessee klassifikationen ift trombocyttallet, og er i stigende grad associeret med DIC, hvor op mod 21% af alle gravide med HELLP også udvikler DIC.68
Differentialdiagnostisk er HELLP, som kompliceres af DIC, mere udfordrende, da gravide har forhøjet Ddimer og forhøjet fibrinogen, som kan skjule alvorligheden. Derfor er den enzymatiske koagulationspåvirkning i form af forhøjet INR vigtig for at få tanken.69
Heparin induceret trombocytopeni (HIT)
HIT er karakteriseret ved et anti-platelet factor 4 (PF4) antistof medieret respons med trombedannelser og forbrug af trombocytter efter eksponering af primært ufraktioneret heparin (sjældnere lavmolekylært heparin (LMWH)) Timingen i trombocytfaldet er essentiel sammen med en grundig anamnese.70,71 Scoringssystemer som 4T er udviklet for at hjælpe klinikeren i diagnosen, men den endelige diagnose stilles via Serotonin Release Assay (SRA) eller ELISA og kan være langsommelig grundet lokale forhold. Primære parakliniske fund er forskellige grader af trombocytopeni med trombosetendens, men uden ledsagende forbrugskoagulopati og dermed normale koagulationsparametre og ofte også normal antitrombin.70
Patienter med malign hæmatologisk sygdom Hæmatologiske intensivpatienter har meget ofte koagulationspåvirkning og hvis man scorer hæmatologiske intensivpatienter med ISTH’s DIC score, vil resultatet stort set altid blive en forhøjet score. Der er dog ikke påvist nogen association mellem forhøjet DIC-score og blødning eller tromboser hos hæmatologiske patienter. Leukæmipatienter i kemo-induceret neutropeni får ikke DIC. Den neutrofile celle og NETS spiller sandsynligvis en stor rolle. Hæmatologisk malignitet giver således DIC, når der er overt proliferation, men ikke i behandlingsfasen, og ikke under neutropen sepsis.
Intensiv terapi af kritisk syge patienter med hæmatologisk malignitet er kompleks og kræver tæt samarbejde med specialister i hæmatologi. Hæmatologiske cancersygdomme, og behandlingen deraf, resulterer ofte i udtalt trombocytopeni,7 hyperleukocytose,72 ændret blodviskocitet73 og aktiveret koagulation.74 Disse patienter har også signifikant øget risiko for blødning.75 Fraset trombocyttallet, så har standard biokemiske koagulationsmarkører lav prædiktiv værdi for blødninger.13,75 ROTEM/TEG er stort set altid påvirkede hos kritisk syge patienter med hæmatologisk cancer, men der foreligger ikke nogen association mellem analyseresultat og blødning.76
Trombotiske mikroangiopatier (TMA)
TMA er en sygdomsgruppe karakteriseret af trombocytopeni, mikroangiopatisk hæmolytisk anæmi og svær organdysfunktion. Disse tilstande kan være svære at skelne fra DIC, men da patogenese og behandlingsmuligheder adskiller sig betydeligt fra DIC, er korrekt diagnose ekstremt vigtig (Figur 2)
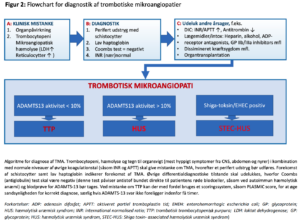
Hos patienter med organpåvirkning, trombocytopeni og tegn til hæmolyse, bør der laves perifer blodudstrygning for schistocytter hurtigst muligt. Ved forekomst af >10% schistocytter, og efter udelukkelse af andre årsager , skal TMA mistænkes.77 Umiddelbart efter tages prøver til analyse af ADAMTS13, da denne prøve er nødvendig for korrekt diagnose af trombotisk trombocytopenisk purpura (TTP). Hvis TTP eller hæmolytisk uræmisk syndrom (HUS) mistænkes, tages blodprøve fra for analyse af ADAMTS13 hvorefter plasmaferesebehandling opstartes indenfor 4 timer.78,79
Svært akut fosfolipidsyndrom (CAPS)
Svært akut fosfolipidsyndrom (engelsk. Catastrophic acute phospholipid syndrome, CAPS), er et sjældent, men ofte fatalt syndrom, der ubehandlet resulterer i tromboser i alle organer, multiorgansvigt og død.
CAPS kan i den tidlige fase ofte være meget svært at diagnosticere. En anamnese med fokus på tidligere tromboser, graviditetsproblemer og andre autoimmune sygdomme er ekstremt vigtig. Laboratoriemæssigt ser man ved CAPS typisk trombocytopeni, høj forekomst af schistocytter, hæmolyse og stigning i INR og Ddimer. Behandlingen består af heparin, plasmaferese, immunoglobuliner og rituximab.80
Erhvervet Hæmofili (Aquired Haemophilia; AHA)
Dette er en autoimmun tilstand, hvor et auto-antistof enten fjerner eller inhiberer en enkelt koagulationsfaktor fra plasma. Tilstanden diagnosticeres ca. 10 gange årligt i DK. Langt oftest er antistoffet rettet imod fVIII, og sjældent imod fII, fV, fIX eller fX. Patienterne har karakteristisk store subkutane hæmatomer flere steder på kroppen, og sivbløder uafladeligt fra indstikssteder og ved kirurgi. Tidvist også hæmaturi og GI-blødning. Biokemisk er de karakteriseret ved en meget lang APTT på ofte 60-120 sekunder, uendeligt lang R-tid/CT ved TEG/ROTEM, men normal INR, hvis der er tale om fVIII eller fIX antistoffer. Ved fII- eller fX-antistof er også INR markant forhøjet. Fibrinogen og trombocytter er normale, og til tider reaktivt forhøjede i relation til en underliggende inflammatorisk tilstand.
Diagnosen stilles ved biokemisk påvisning af et relevant antistof; enten ved koagulations-blandingsforsøg, eller ved måling af antistof-titer i Bethesda-enheder. Den diagnostiske proces sker i samarbejde med hæmatolog samt klinisk biokemiker. Behandlingen er i den akut blødende fase at give ”by-passing-agents” i form af aktiveret faktor VIIa (NovoSeven) eller Protrombin Complex Concentrate (FEIBA). Derudover immunsuppression og eventuelt plasmaferese.
Håndtering af DIC
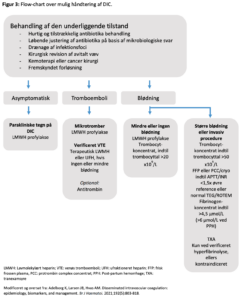
Idet DIC ikke er en selvstændig sygdom, men altid en komplikation til en underliggende tilstand som forårsager aktivering af koagulationssystemet, er det vigtigste at identificere og behandle denne tilstand (Figur 3, Tabel 4).
Håndteringen af DIC inddeles i tre dele:
- Behandling af udløsende årsag
- Tromboseprofylakse
- Understøttende behandling ved DIC med tromboemboliske – eller blødningsmanifestationer
Udløsende årsag behandles effektivt
Først og fremmest iværksættes tiltag for at begrænse eller eliminere den tilgrundliggende sygdom. Dette vil ofte føre til spontan bedring i DIC parametrene, hvor øvrig hæmostaseregulerende behandling med antikoagulantia og/eller hæmostatika – ud over tromboseprofylakse – ikke vil være nødvendig. Såfremt patienten udvikler blødning og/eller trombose kan behandlingsmulighederne under punkt 3 samt Figur 3 anvendes som guide. Dog må det understreges, at der kun er få kliniske studier at basere behandlingen på, og anbefalingerne hviler i høj grad på ”expert opinion”, observationelle data samt ekstrapolering fra andre patientgrupper.1,81-83
Tromboseprofylakse
Ved alle immobiliserede, kritisk syge patienter uden svær blødning og med trombocyttal > 30 x109 /L anbefales profylakse mod venøs tromboemboli med LMWH.84 Der er ikke lavet randomiserede studier, der 13 undersøger profylaktisk LMWH udelukkende til DIC patienter, men ud fra ”expert opinion” anbefales profylakse LMWH til alle DIC patienter, der ikke har transfusionskrævende blødning eller svær trombocytopeni.81 Undtaget er obstetrisk DIC og DIC ved Akut Promyelocyt Leukæmi, hvor blødningstendens typisk dominerer.81,85-87
Man har ved anvendelse af profylaktiske doser af dalteparin (fragmin), ved kritisk syge patienter med nyreinsufficiens, ikke set tegn på akkumulation ved anvendelse op til 30 dage.88,89 Studierne inkluderede dog ikke patienter med udtalt trombocytopeni og forsigtighed udvises ved trombocyttal <30 x109 /L.81
Understøttende terapi ved DIC med tromboemboliske – eller blødningsmanifestationer
Patienten med mulig symptomgivende DIC bør monitoreres dagligt med DIC-tal og screenes for symptomer på tromboemboli og blødningstendens. Ved dynamik i blodprøverne, særligt tiltagende trombocytopeni, bør overvejes flere daglige kontroller af DIC tal, f.eks. hver 8. time. Idet både pro- og antikoagulante faktorer forbruges, anbefales substitution kun i tilfælde af symptomer eller forud for invasive procedurer med høj blødningsrisiko.50,81,83
Følgende kan overvejes i tilfælde af blødning:
Trombocytpools
For intensivpatienter er der 4-5 gange højere risiko for alvorlig blødning ved trombocyttal under 50×109 /L, 90,91 . Ved svær blødning, eller forud for invasive procedurer med blødningsrisiko, er der i guidelines konsensus om at transfundere ved trombocyttal under 50×109/L.81 For øvrige intensivpatienter med DIC anbefales i de fleste guidelines en transfusionsgrænse på 20×109/L.1
Transfusionsgrænserne baserer sig på studier udført på patienter med hæmatologisk cancer.92 Grænserne er konsistente gennem DIC-guidelines og anbefalinger over tid,1,93 men baserer sig således ikke på DIC patienter. Der er i de hæmatologiske studier ikke påvist øget blødningstendens ved transfusionsgrænse 10 x109/L vs 20 x109/L, men da patienter med DIC har øget forbrug af trombocytter, har man ud fra et fysiologisk argument valgt den høje transfusionsgrænse.
Frisk frosset plasma
Transfusion af FFP overvejes ved aktiv blødning eller behov for invasiv procedure med stor blødningsrisiko OG samtidig forhøjelse af INR >1,5 eller forlængelse af APTT x1,5 over referenceintervallet. Der foreligger ikke randomiserede studier der understøtter denne anbefaling og den baserer sig på ”expert opinion”.81,82 Kliniske studier har også vist manglende effekt af FFP på hæmostasen hos kritisk syge patienter, særligt når f.eks. INR kun er let forhøjet (<2).94 ROTEM/TEG kan anvendes til at understøtte den kliniske beslutningstagning ved pågående transfusionskrævende blødning, men hverken INR/APTT eller ROTEM/TEG kan anvendes som prædiktorer for blødning og der bør ikke transfunderes på baggrund af paraklinik alene.51
Prothrombin complex concentrate (PCC; Octaplex® )
PCC er primært udviklet og undersøgt til reversering af vitamin K-antagonister.95,96 PCC er ikke undersøgt ved DIC, men kan overvejes som alternativ til FFP, hvis patienten er i stort væskeoverskud, 1 holdende in mente at PCC indeholder et begrænset antal koagulationsfaktorer (for Octaplex: fII, fVII, fIX, fX, protein S og C), hvor DIC inducerer en reduktion i samtlige koagulationsfaktorer. Det erindres at PCC ikke indeholder antitrombin og fibrinogen.
Cryoprecipitat
Som ved PCC, er der ikke lavet studier på dette ift. DIC-patienter, men cryoprecipitat kan anvendes ved multitransfusion eller stort væskeoverload. Koncentrationen af fibrinogen er en anelse højere i cryoprecipitat end i FFP.
Fibrinogen koncentrat
Substitution med fibrinogen koncentrat anbefales ved fibrinogen <4.5 µmol/L, eller FIBTEM/FF-MA under referenceværdi, hvis det er associeret med transfusionskrævende blødning.1,83 Ved DIC relateret til svær post-partum blødning anbefales substitution ved fibrinogen <6 µmol/L.
Vitamin K (Konakion®)
Indgår i dannelsen af fII (protrombin), fVII, fIX og fX samt de fysiologiske inhibitorer protein C og S. Substitueres ved kendt eller mistænkt vitamin-K mangel, fx malnutrition eller overdosering med vitamin-K antagonister. Dosering: 1-10 mg iv afhængig af sværhedsgraden af blødning. Maksimal effekt efter 36 timer. Disse anbefalinger baserer sig ikke på DIC-patienter, men er primært ekstrapoleret fra patienter med kronisk leversygdom.82
Tranexamsyre:
Tranexamsyre anbefales generelt ikke ved åbenlys DIC, idet fibrinolysen oftest er hæmmet. Dog kan tranexamsyre gives ved pågående blødning og åbenlys hyperfibrinolyse (se Monitorering vedr. diagnose af hyperfibrinolyse).
Hyperfibrinolyse ses ved traumer og amnionemboli.82 Ved amnionemboli, kan tranexamsyre overvejes ved ukontrollabel blødning.97 Ved traumer har traumatisk induceret koagulopati og DIC stort overlap, og er korreleret til dårligt outcome.98,99 Efter CRASH-2 indgår tranexamsyre i den præhospitale håndtering af traumepatienter og anbefales givet indenfor 3 timer efter traumet.100 Administration af tranexamsyre til traumepatienter, bør ikke afvente ROTEM/TEG i den akutte fase.53 Hos kritisk syge patienter med hæmatologisk malignitet og stor blødningsrisiko, kan tranexamsyre bruges som profylakse efter konference med hæmatologisk speciallæge. Ved promyelocytisk leukæmi anbefales tranexamsyre kun, hvis hyperfibrinolysen ikke er relateret til DIC.87
Følgende kan overvejes ved tromboemboliske manifestationer
Antikoagulerende behandling ved sepsis har ikke kunnet vise en gavnlig effekt på overlevelsen, mens antikoagulerende behandling ved DIC fortsat er omdiskuteret. En metaanalyse, inkluderende alle randomiserede studier med antikoagulation ved sepsis, viste en øget overlevelse hos subpopulationen af DIC-patienter, der modtog antikoagulerende behandling.101 En del af effekten var dog drevet af studier, hvor man undersøgte effekten af aktiveret protein C, som senere er blevet trukket tilbage fra markedet. Nedenfor gennemgås de antikoagulerende tiltag, der er tilgængelige ved trombotiske manifestationer hos DIC-patienten.
Antitrombin
Reduceret antitrombin aktivitet ved sepsisinduceret DIC er vist at være associeret med højere mortalitet,102,103 men de første randomiserede studier af substitution med antitrombin var små og kunne ikke sikkert dokumentere en gunstig effekt på mortalitet.104,105 I KyberSept blev 2314 patienter med sepsis randomiseret til supraterapeutiske doser antitrombin eller placebo, uden at man kunne vise effekt på overlevelsen.106 Posthoc analyser af patienter med DIC kunne dog vise reduceret 28 dages mortalitet (25.4% vs 40.0%, p=0.024) ved 3 dages substitution med antitrombin.107 I studierne så man større forekomst af blødningskomplikationer, særligt hos de som modtog både supraterapeutiske doser antitrombin og terapeutiske doser heparin.108 I den seneste metaanalyse, hvor der tages højde for at antitrombin udelukkende gives til DIC patienter, ses en svagt positiv effekt af antitrombin substitution. Dog er studierne behæftet med en høj grad af bias, hvilket potentielt kan medføre at effekten overvurderes og skaden undervurderes. Evidensen for antitrombin substitution er således fortsat svag.109 Substitution med antitrombin kan overvejes ved dokumenteret tromboembolisk tilstand og antitrombin<0,6 IE.93,109 Der substitueres da indtil et niveau omkring 0,6 IE og der udvises forsigtighed ved samtidig terapeutisk dosering med LMWH eller ufraktioneret heparin.
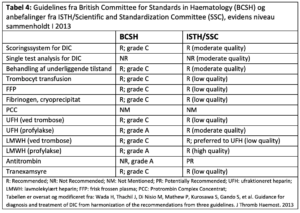
Terapeutisk heparin – LMWH vs ufraktioneret heparin
Ved trombotiske manifestationer (akral iskæmi, purpura fulminans) anbefales, med lav evidens (Tabel 4), LMWH i terapeutisk dosering, frem for ufraktioneret heparin.50,83,110 Ufraktioneret heparin er ikke vist at øge overlevelsen ved DIC,111 men kan overvejes som alternativ til LMWH, pga mulighed for reversering.
Referencer
1. Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol. 2009;145(1):24-33.
2. Taylor FB, Jr., Toh CH, Hoots WK, et al. Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327- 1330.
3. Semeraro N, Ammollo CT, Semeraro F, Colucci M. Sepsis, thrombosis and organ dysfunction. Thromb Res. 2012;129(3):290-295.
4. Madoiwa S. Recent advances in disseminated intravascular coagulation: endothelial cells and fibrinolysis in sepsis-induced DIC. J Intensive Care. 2015;3:8.
5. Muller-Berghaus G, ten Cate H, Levi M. Disseminated intravascular coagulation: clinical spectrum and established as well as new diagnostic approaches. Thromb Haemost. 1999;82(2):706-712.
6. Semeraro N, Ammollo CT, Semeraro F, Colucci M. Sepsis-associated disseminated intravascular coagulation and thromboembolic disease. Mediterr J Hematol Infect Dis. 2010;2(3):e2010024.
7. Drews RE. Critical issues in hematology: anemia, thrombocytopenia, coagulopathy, and blood product transfusions in critically ill patients. Clin Chest Med. 2003;24(4):607-622.
8. Collins PW, Macchiavello LI, Lewis SJ, et al. Global tests of haemostasis in critically ill patients with severe sepsis syndrome compared to controls. Br J Haematol. 2006;135(2):220-227.
9. Hunt BJ. Bleeding and coagulopathies in critical care. N Engl J Med. 2014;370(22):2153.
10. Gando S, Wada H, Thachil J, Scientific, Standardization Committee on DICotISoT, Haemostasis. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma-shock (COT/ACOTS). J Thromb Haemost. 2013;11(5):826-835.
11. Asakura H, Takahashi H, Uchiyama T, et al. Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thromb J. 2016;14:42.
12. Rizoli S, Nascimento B, Jr., Key N, et al. Disseminated intravascular coagulopathy in the first 24 hours after trauma: the association between ISTH score and anatomopathologic evidence. J Trauma. 2011;71(5 Suppl 1):S441-447.
13. Russell L, Madsen MB, Dahl M, Kampmann P, Perner A. Prediction of bleeding and thrombosis by standard biochemical coagulation variables in haematological intensive care patients. Acta Anaesthesiol Scand. 2018;62(2):196-206.
14. Squizzato A, Gallo A, Levi M, et al. Underlying disorders of disseminated intravascular coagulation: Communication from the ISTH SSC Subcommittees on Disseminated Intravascular Coagulation and Perioperative and Critical Care Thrombosis and Hemostasis. J Thromb Haemost. 2020;18(9):2400- 2407.
15. Nybo M, Hvas AM. [A national Danish guideline for age-adjusted fibrin D-dimer cut-off values in the diagnosis of venous thrombosis]. Ugeskr Laeger. 2018;180(15).
16. Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models. J Intensive Care. 2014;2(1):20.
17. Kolev K, Longstaff C. Bleeding related to disturbed fibrinolysis. Br J Haematol. 2016;175(1):12-23.
18. Coombs CC, Tavakkoli M, Tallman MS. Acute promyelocytic leukemia: where did we start, where are we now, and the future. Blood Cancer J. 2015;5:e304.
19. Sawamura A, Hayakawa M, Gando S, et al. Disseminated intravascular coagulation with a fibrinolytic phenotype at an early phase of trauma predicts mortality. Thromb Res. 2009;124(5):608-613.
20. Dhainaut JF, Shorr AF, Macias WL, et al. Dynamic evolution of coagulopathy in the first day of severe sepsis: relationship with mortality and organ failure. Crit Care Med. 2005;33(2):341-348.
21. Levi M, de Jonge E, van der Poll T. Sepsis and disseminated intravascular coagulation. J Thromb Thrombolysis. 2003;16(1-2):43-47.
22. Levi M, van der Poll T. Coagulation in sepsis: all bugs bite equally. Crit Care. 2004;8(2):99-100.
23. Sakr Y, Dubois MJ, De Backer D, Creteur J, Vincent JL. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock. Crit Care Med. 2004;32(9):1825-1831.
24. De Backer D, Donadello K, Favory R. Link between coagulation abnormalities and microcirculatory dysfunction in critically ill patients. Curr Opin Anaesthesiol. 2009;22(2):150-154.
25. De Backer D, Donadello K, Sakr Y, et al. Microcirculatory alterations in patients with severe sepsis: impact of time of assessment and relationship with outcome. Crit Care Med. 2013;41(3):791-799.
26. Yamashita Y, Wada H, Nomura H, et al. Elevated fibrin-related markers in patients with malignant diseases frequently associated with disseminated intravascular coagulation and venous thromboembolism. Intern Med. 2014;53(5):413-419.
27. Sun Y, Wang J, Wu X, et al. Validating the incidence of coagulopathy and disseminated intravascular coagulation in patients with traumatic brain injury–analysis of 242 cases. Br J Neurosurg. 2011;25(3):363-368.
28. Yang X, Cheng X, Tang Y, et al. Bacterial Endotoxin Activates the Coagulation Cascade through Gasdermin D-Dependent Phosphatidylserine Exposure. Immunity. 2019;51(6):983-996 e986.
29. Delabranche X, Helms J, Meziani F. Immunohaemostasis: a new view on haemostasis during sepsis. Ann Intensive Care. 2017;7(1):117.
30. Konigstein M, Havakuk O, Arbel Y, et al. Impact of Hemoglobin Drop, Bleeding Events, and Red Blood Cell Transfusions on Long-term Mortality in Patients Undergoing Transaortic Valve Implantation. Can J Cardiol. 2016;32(10):1239 e1239-1239 e1214.
31. Mirlashari MR, Hoiby EA, Holst J, Lyberg T. Outer membrane vesicles from Neisseria meningitidis: effects on cytokine production in human whole blood. Cytokine. 2001;13(2):91-97.
32. Opal SM, Esmon CT. Bench-to-bedside review: functional relationships between coagulation and the innate immune response and their respective roles in the pathogenesis of sepsis. Crit Care. 2003;7(1):23-38.
33. Claushuis TA, de Stoppelaar SF, Stroo I, et al. Thrombin contributes to protective immunity in pneumonia-derived sepsis via fibrin polymerization and platelet-neutrophil interactions. J Thromb Haemost. 2017;15(4):744-757.
34. Opal SM. Phylogenetic and functional relationships between coagulation and the innate immune response. Crit Care Med. 2000;28(9 Suppl):S77-80.
35. Ostafin M, Ciepiela O, Pruchniak M, et al. Dynamic Changes in the Ability to Release Neutrophil ExtraCellular Traps in the Course of Childhood Acute Leukemias. Int J Mol Sci. 2021;22(2).
36. Dutt T, Toh CH. The Yin-Yang of thrombin and activated protein C. Br J Haematol. 2008;140(5):505- 515.
37. Iba T, Kidokoro A, Fukunaga M, Nagakari K, Shirahama A, Ida Y. Activated protein C improves the visceral microcirculation by attenuating the leukocyte-endothelial interaction in a rat lipopolysaccharide model. Crit Care Med. 2005;33(2):368-372.
38. Panigada M, Sampietro F, L’Acqua C, et al. Impaired dynamics of clot formation and hypofibrinolysis in severe sepsis are coexisting and strictly related. Intensive Care Med. 2016;42(4):622-623.
39. Toh CH, Alhamdi Y, Abrams ST. Current Pathological and Laboratory Considerations in the Diagnosis of Disseminated Intravascular Coagulation. Ann Lab Med. 2016;36(6):505-512.
40. Levi M. Platelets in Critical Illness. Semin Thromb Hemost. 2016;42(3):252-257.
41. Umemura Y, Yamakawa K, Hayakawa M, Hamasaki T, Fujimi S, Japan Septic Disseminated Intravascular Coagulation study g. Screening itself for disseminated intravascular coagulation may reduce mortality in sepsis: A nationwide multicenter registry in Japan. Thromb Res. 2018;161:60-66.
42. Kim HK, Hong KH, Toh CH, Scientific, Standardization Committee on DICoTISoT, Haemostasis. Application of the international normalized ratio in the scoring system for disseminated intravascular coagulation. J Thromb Haemost. 2010;8(5):1116-1118.
43. Johnson ED, Schell JC, Rodgers GM. The D-dimer assay. Am J Hematol. 2019;94(7):833-839.
44. Bakhtiari K, Meijers JC, de Jonge E, Levi M. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation. Crit Care Med. 2004;32(12):2416-2421.
45. Iba T, Kidokoro A, Yagi Y. The role of the endothelium in changes in procoagulant activity in sepsis. J Am Coll Surg. 1998;187(3):321-329.
46. Brenner T, Schmidt K, Delang M, et al. Viscoelastic and aggregometric point-of-care testing in patients with septic shock – cross-links between inflammation and haemostasis. Acta Anaesthesiol Scand. 2012;56(10):1277-1290.
47. Andersen MG, Hvas CL, Tonnesen E, Hvas AM. Thromboelastometry as a supplementary tool for evaluation of hemostasis in severe sepsis and septic shock. Acta Anaesthesiol Scand. 2014;58(5):525-533.
48. Iba T, Ito T, Maruyama I, et al. Potential diagnostic markers for disseminated intravascular coagulation of sepsis. Blood Rev. 2016;30(2):149-155.
49. Muller MC, Meijers JC, Vroom MB, Juffermans NP. Utility of thromboelastography and/or thromboelastometry in adults with sepsis: a systematic review. Crit Care. 2014;18(1):R30.
50. Adelborg K, Larsen JB, Hvas AM. Disseminated intravascular coagulation: epidemiology, biomarkers, and management. Br J Haematol. 2021;192(5):803-818.
51. Larsen JB, Hvas AM. Predictive Value of Whole Blood and Plasma Coagulation Tests for Intra- and Postoperative Bleeding Risk: A Systematic Review. Semin Thromb Hemost. 2017;43(7):772-805.
52. Gall LS, Vulliamy P, Gillespie S, et al. The S100A10 Pathway Mediates an Occult Hyperfibrinolytic Subtype in Trauma Patients. Ann Surg. 2019;269(6):1184-1191.
53. Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care. 2019;23(1):98.
54. Minet C, Potton L, Bonadona A, et al. Venous thromboembolism in the ICU: main characteristics, diagnosis and thromboprophylaxis. Crit Care. 2015;19:287.
55. De Backer D, Ricottilli F, Ospina-Tascon GA. Septic shock: a microcirculation disease. Curr Opin Anaesthesiol. 2021;34(2):85-91.
56. Ospina-Tascon GA, Umana M, Bermudez WF, et al. Can venous-to-arterial carbon dioxide differences reflect microcirculatory alterations in patients with septic shock? Intensive Care Med. 2016;42(2):211-221.
57. Hemker HC, Al Dieri R, De Smedt E, Beguin S. Thrombin generation, a function test of the haemostatic-thrombotic system. Thromb Haemost. 2006;96(5):553-561.
58. Onishi T, Nogami K, Ishihara T, et al. A Pathological Clarification of Sepsis-Associated Disseminated Intravascular Coagulation Based on Comprehensive Coagulation and Fibrinolysis Function. Thromb Haemost. 2020;120(9):1257-1269.
59. Larsen JB, Hvas AM. Fibrin Clot Formation and Lysis in Plasma. Methods Protoc. 2020;3(4).
60. Larsen JB, Hvas AM. Fibrinolytic Alterations in Sepsis: Biomarkers and Future Treatment Targets. Semin Thromb Hemost. 2021;47(5):589-600.
61. Marks PW. Hematologic manifestations of liver disease. Semin Hematol. 2013;50(3):216-221.
62. Senzolo M, Burra P, Cholongitas E, Burroughs AK. New insights into the coagulopathy of liver disease and liver transplantation. World Journal of Gastroenterology. 2006;12(48):7725-7736.
63. Afdhal N, McHutchison J, Brown R, et al. Thrombocytopenia associated with chronic liver disease. J Hepatol. 2008;48(6):1000-1007.
64. Qamar AA, Grace ND, Groszmann RJ, et al. Incidence, prevalence, and clinical significance of abnormal hematologic indices in compensated cirrhosis. Clin Gastroenterol Hepatol. 2009;7(6):689- 695.
65. Joist JH. AICF and DIC in liver cirrhosis: expressions of a hypercoagulable state. Am J Gastroenterol. 1999;94(10):2801-2803.
66. Peterson TJ, Webb AM, Vipler BS. Use of thromboelastography in the management of liver cirrhosis and accelerated intravascular coagulation and fibrinolysis (AICF). BMJ case reports. 2016;2016.
67. DASAIMs obstetriske udvalg Os. PRÆEKLAMPSI / EKLAMPSI EN KLINISK GUIDELINE. 2017.
68. Haram K, Mortensen JH, Mastrolia SA, Erez O. Disseminated intravascular coagulation in the HELLP syndrome: how much do we really know? J Matern Fetal Neonatal Med. 2017;30(7):779-788.
69. Walker J, Bonavia A. To Clot or Not: HELLP Syndrome and Disseminated Intravascular Coagulation in an Eclamptic Patient with Intrauterine Fetal Demise. Case Rep Anesthesiol. 2020;2020:9642438.
70. East JM, Cserti-Gazdewich CM, Granton JT. Heparin-Induced Thrombocytopenia in the Critically Ill Patient. Chest. 2018;154(3):678-690.
71. Thachil J, Warkentin TE. How do we approach thrombocytopenia in critically ill patients? Br J Haematol. 2017;177(1):27-38.
72. Yanada M, Matsushita T, Asou N, et al. Severe hemorrhagic complications during remission induction therapy for acute promyelocytic leukemia: incidence, risk factors, and influence on outcome. Eur J Haematol. 2007;78(3):213-219.
73. Sharma K, Puniyani RR, Bhat SV, Advani SH, Hegde U, Rao S. Blood viscosity parameter correlation with types of leukemia. Physiol Chem Phys Med NMR. 1992;24(2):159-164.
74. Chang H, Kuo MC, Shih LY, et al. Clinical bleeding events and laboratory coagulation profiles in acute promyelocytic leukemia. Eur J Haematol. 2012;88(4):321-328.
75. Russell L, Holst LB, Kjeldsen L, Stensballe J, Perner A. Risks of bleeding and thrombosis in intensive care unit patients with haematological malignancies. Ann Intensive Care. 2017;7(1):119.
76. Russell L, Haase N, Perner A. Prediction of bleeding by thromboelastography in ICU patients with haematological malignancy and severe sepsis. Blood Coagul Fibrinolysis. 2018;29(8):683-688.
77. Azoulay E, Knoebl P, Garnacho-Montero J, et al. Expert Statements on the Standard of Care in Critically Ill Adult Patients With Atypical Hemolytic Uremic Syndrome. Chest. 2017;152(2):424-434.
78. Azoulay E, Bauer PR, Mariotte E, et al. Expert statement on the ICU management of patients with thrombotic thrombocytopenic purpura. Intensive Care Med. 2019;45(11):1518-1539.
79. Zheng XL, Vesely SK, Cataland SR, et al. ISTH guidelines for the diagnosis of thrombotic thrombocytopenic purpura. J Thromb Haemost. 2020;18(10):2486-2495.
80. Legault K, Schunemann H, Hillis C, et al. McMaster RARE-Bestpractices clinical practice guideline on diagnosis and management of the catastrophic antiphospholipid syndrome. J Thromb Haemost. 2018.
81. Squizzato A, Hunt BJ, Kinasewitz GT, et al. Supportive management strategies for disseminated intravascular coagulation. An international consensus. Thromb Haemost. 2016;115(5):896-904.
82. Levi M, Scully M. How I treat disseminated intravascular coagulation. Blood. 2018;131(8):845-854.
83. Wada H, Thachil J, Di Nisio M, et al. Guidance for diagnosis and treatment of DIC from harmonization of the recommendations from three guidelines. J Thromb Haemost. 2013.
84. Beitland S, Sandven I, Kjaervik LK, Sandset PM, Sunde K, Eken T. Thromboprophylaxis with low molecular weight heparin versus unfractionated heparin in intensive care patients: a systematic review with meta-analysis and trial sequential analysis. Intensive Care Med. 2015;41(7):1209-1219.
85. Rabinovich A, Abdul-Kadir R, Thachil J, Iba T, Othman M, Erez O. DIC in obstetrics: Diagnostic score, highlights in management, and international registry-communication from the DIC and Women’s Health SSCs of the International Society of Thrombosis and Haemostasis. J Thromb Haemost. 2019;17(9):1562-1566.
86. Sanz MA, Montesinos P. Advances in the management of coagulopathy in acute promyelocytic leukemia. Thromb Res. 2020;191 Suppl 1:S63-S67.
87. Wang TF, Makar RS, Antic D, et al. Management of hemostatic complications in acute leukemia: Guidance from the SSC of the ISTH. J Thromb Haemost. 2020;18(12):3174-3183.
88. Cook D, Douketis J, Meade M, et al. Venous thromboembolism and bleeding in critically ill patients with severe renal insufficiency receiving dalteparin thromboprophylaxis: prevalence, incidence and risk factors. Crit Care. 2008;12(2):R32.
89. Rabbat CG, Cook DJ, Crowther MA, et al. Dalteparin thromboprophylaxis for critically ill medicalsurgical patients with renal insufficiency. J Crit Care. 2005;20(4):357-363.
90. Strauss R, Wehler M, Mehler K, Kreutzer D, Koebnick C, Hahn EG. Thrombocytopenia in patients in the medical intensive care unit: bleeding prevalence, transfusion requirements, and outcome. Crit Care Med. 2002;30(8):1765-1771.
91. Vanderschueren S, De Weerdt A, Malbrain M, et al. Thrombocytopenia and prognosis in intensive care. Crit Care Med. 2000;28(6):1871-1876.
92. Triulzi DJ. How well do platelets prevent bleeding? Hematology Am Soc Hematol Educ Program. 2020;2020(1):518-522.
93. Papageorgiou C, Jourdi G, Adjambri E, et al. Disseminated Intravascular Coagulation: An Update on Pathogenesis, Diagnosis, and Therapeutic Strategies. Clin Appl Thromb Hemost. 2018;24(9_suppl):8S-28S.
94. Vibede E, Hvas CL, Tonnesen E, Hvas AM. The effect of fresh frozen plasma in critically ill patients. Acta Anaesthesiol Scand. 2017;61(5):492-501.
95. Goldstein JN, Refaai MA, Milling TJ, Jr., et al. Four-factor prothrombin complex concentrate versus plasma for rapid vitamin K antagonist reversal in patients needing urgent surgical or invasive interventions: a phase 3b, open-label, non-inferiority, randomised trial. Lancet. 2015;385(9982):2077-2087.
96. Sarode R, Milling TJ, Jr., Refaai MA, et al. Efficacy and safety of a 4-factor prothrombin complex concentrate in patients on vitamin K antagonists presenting with major bleeding: a randomized, plasma-controlled, phase IIIb study. Circulation. 2013;128(11):1234-1243.
97. Erez O, Mastrolia SA, Thachil J. Disseminated intravascular coagulation in pregnancy: insights in pathophysiology, diagnosis and management. Am J Obstet Gynecol. 2015;213(4):452-463.
98. Gando S, Otomo Y. Local hemostasis, immunothrombosis, and systemic disseminated intravascular coagulation in trauma and traumatic shock. Crit Care. 2015;19:72.
99. Gando S, Shiraishi A, Wada T, et al. A multicenter prospective validation study on disseminated intravascular coagulation in trauma-induced coagulopathy. J Thromb Haemost. 2020;18(9):2232- 2244.
100. Shakur H, Roberts I, Bautista R, et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010;376(9734):23-32.
101. Umemura Y, Yamakawa K, Ogura H, Yuhara H, Fujimi S. Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials. J Thromb Haemost. 2016;14(3):518-530.
102. Fourrier F, Chopin C, Goudemand J, et al. Septic shock, multiple organ failure, and disseminated intravascular coagulation. Compared patterns of antithrombin III, protein C, and protein S deficiencies. Chest. 1992;101(3):816-823.
103. Levi M, van der Poll T. The role of natural anticoagulants in the pathogenesis and management of systemic activation of coagulation and inflammation in critically ill patients. Semin Thromb Hemost. 2008;34(5):459-468.
104. Fourrier F, Chopin C, Huart JJ, Runge I, Caron C, Goudemand J. Double-blind, placebo-controlled trial of antithrombin III concentrates in septic shock with disseminated intravascular coagulation. Chest. 1993;104(3):882-888.
105. Baudo F, Caimi TM, de Cataldo F, et al. Antithrombin III (ATIII) replacement therapy in patients with sepsis and/or postsurgical complications: a controlled double-blind, randomized, multicenter study. Intensive Care Med. 1998;24(4):336-342.
106. Warren BL, Eid A, Singer P, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA. 2001;286(15):1869-1878.
107. Kienast J, Juers M, Wiedermann CJ, et al. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J Thromb Haemost. 2006;4(1):90-97.
108. Hoffmann JN, Wiedermann CJ, Juers M, et al. Benefit/risk profile of high-dose antithrombin in patients with severe sepsis treated with and without concomitant heparin. Thromb Haemost. 2006;95(5):850-856.
109. Wiedermann CJ. Antithrombin concentrate use in disseminated intravascular coagulation of sepsis: meta-analyses revisited. J Thromb Haemost. 2018;16(3):455-457.
110. Sakuragawa N, Hasegawa H, Maki M, Nakagawa M, Nakashima M. Clinical evaluation of lowmolecular-weight heparin (FR-860) on disseminated intravascular coagulation (DIC)–a multicenter co-operative double-blind trial in comparison with heparin. Thromb Res. 1993;72(6):475-500.
111. Liu XL, Wang XZ, Liu XX, et al. Low-dose heparin as treatment for early disseminated intravascular coagulation during sepsis: A prospective clinical study. Exp Ther Med. 2014;7(3):604-608.
Indholdsfortegenelse
